CITOQUINA QUE INDUCE APOPTOSIS.
Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo que consiste de:
a) un dominio extracelular de la TRAIL humana de la SEQ ID NO: 2; y b) un fragmento de dicho dominio extracelular de (a) en donde el fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL, en donde dicho polipéptido TRAIL humano soluble es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05077545.
Solicitante: IMMUNEX CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE THOUSAND OAKS, CA 91320-1799 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WILEY, STEVEN, R., GOODWIN, RAYMOND, G..
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Junio de 1996.
Clasificación Internacional de Patentes:
- C07K14/705Q
- C07K16/28Q
- C07K7/06A
- C07K7/08A
Clasificación PCT:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C07K1/14 C07 […] › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Extracción; Separación; Purificación.
- C07K14/52 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Citoquinas; Linfoquinas; Interferones.
- C07K16/24 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/17 C12N 15/00 […] › Insulinas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia.
PDF original: ES-2362191_T3.pdf
Fragmento de la descripción:
Antecedentes de la invención
La muerte celular programada conocida como apoptosis es distinta de la muerte celular debida a necrosis. La apoptosis se produce en embriogénesis, metamorfosis, atrofia de tejido con dependencia endocrina, recambio normal de tejido, y muerte de timocitos inmunológicos (inducida a través de su complejo antígeno-receptor o por medio de glucocorticoides) (Itoh et al., Cell 66: 233, 1991). Durante la maduración de células T en el timo, se destruyen las células T que reconocen autoantígenos a través del proceso apoptótico, mientras que otros son seleccionados positivamente. Se ha sugerido la posibilidad de que algunas células T que reconocen ciertos autoepítopos (por ejemplo, ineficientemente procesados y que presentan determinantes antigénicos de una autoproteína dada) evadan este proceso de eliminación y posteriormente jueguen un papel en enfermedades autoinmunes (Gammon et al., Immunology Today 12: 193, 1991).
Se ha reportado que un antígeno de la superficie de la célula conocido como Fas media la apoptosis y se cree que juega un papel en la supresión clonal de células T autorreactivas (Itoh et al., Cell 66: 233,1991; Watanabe-Fukunage et al., Nature 356: 314, 1992). Se ha reportado que el entrelazamiento de un anticuerpo monoclonal específico con Fas induce que diferentes líneas de células experimenten apoptosis (Yonehara et al., J. Exp. Med., 169: 1747, 1989; Trauth et al., Science, 245: 301, 1989). Sin embargo, bajo ciertas condiciones, el enlazamiento de un anticuerpo monoclonal específico con Fas puede tener un efecto coestimulador sobre células T recientemente aisladas (Alderson et al., J. Exp. Med. 178:2231, 1993).
Los ADN que codifican un ligando de Fas de rata (Suda et al., Cell, 75: 1169, 1993) y un ligando de Fas humana (Takahashi et al., International Immunology 6: 1567, 1994) han sido aislados. El enlazamiento del ligando de Fas con células que expresan al antígeno de Fas se ha demostrado que induce apoptosis (Suda et al., ver más arriba, y Takahashi et al., ver más arriba).
Es deseable la investigación relacionada con la existencia e identidad de otra(s) molécula(s) que juega(n) un papel en la apoptosis. La identificación de tales moléculas proporcionaría un medio adicional de regulación de la apoptosis, así como proporcionar una mayor comprensión en el desarrollo de autotolerancia por parte del sistema inmunológico y la etiología de enfermedades autoinmunes.
Resumen de la invención
La presente invención proporciona una nueva proteína citoquina, así como ADN aislado que codifica la citoquina y vectores de expresión que contienen al ADN aislado. Las propiedades de la nueva citoquina, que es un miembro de la familia de ligandos del factor de necrosis tumoral (TNF), incluyen la habilidad para inducir apoptosis de ciertos tipos de células objetivo. Esta proteína es denominada por lo tanto Ligando que Induce Apoptosis Relacionada con TNF (TRAIL). Entre los tipos de células que mueren por el contacto con TRAIL están células cancerosas tales como células de leucemia, linfoma, y melanoma, y células infectadas con un virus.
Un método para producir polipéptidos TRAIL que involucra el cultivo de células huésped transformadas con un vector de expresión recombinante que contiene ADN que codifica TRAIL bajo condiciones apropiadas para expresión de TRAIL, recuperando luego el polipéptido TRAIL expresado a partir del cultivo. También se proporcionan anticuerpos dirigidos contra polipéptidos TRAIL.
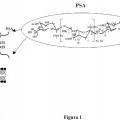
Breve descripción de los dibujos
La Figura 1 presenta los resultados de un ensayo descrito en el ejemplo 8. El ensayo demostró que un polipéptido TRAIL humano soluble indujo la muerte de células Jurkat, que son una línea e células de leucemia.
La Figura 2 presenta los resultados de un ensayo descrito en el ejemplo 11. El contacto con un polipéptido TRAIL humano soluble indujo la muerte de fibroblastos humanos infectados con citomegalovirus, mientras que los fibroblastos infectados en forma no viral no murieron.
Descripción detallada de la invención
Se proporciona aquí una nueva proteína denominada TRAIL, junto con el ADN que codifica TRAIL y vectores de expresión recombinante que contienen el ADN para TRAIL, como se define en las reivindicaciones. Un método para producir polipéptidos TRAIL recombinantes involucra el cultivo de células huésped transformadas con los vectores de expresión recombinante bajo condiciones apropiadas para la expresión de TRAIL, y la recuperación de la TRAIL expresada, como se define en las reivindicaciones.
La presente invención también proporciona anticuerpos que enlazan específicamente proteínas TRAIL. En una modalidad, los anticuerpos son anticuerpos monoclonales.
La proteína TRAIL induce apoptosis de ciertos tipos de células objetivo, tal como las células transformadas que incluyen pero no se limitan a células cancerosas y a células infectadas por virus. Como se demuestra en los ejemplos 5, 8, 9, yd 10 más adelante, la apoptosis inducida por TRAIL de líneas de células humanas de leucemia, linfoma, y melanoma. Entre los usos de TRAIL se utiliza en la muerte de células cancerosas. TRAIL encuentra un uso adicional en el tratamiento de infecciones virales. La infección con citomegalovirus (CMV) volvió a los fibroblastos humanos susceptibles a la apoptosis cuando se los puso en contacto con TRAIL, mientras que los fibroblastos no infectados no murieron a través del contacto con TRAIL (ver el ejemplo 11).
Más adelante, en el ejemplo 1 se describe el aislamiento de un ADN que codifica TRAIL humano. La secuencia de nucleótidos del ADN humano para TRAIL aislados en el ejemplo 1 se presenta en la SEQ ID NO: 1, y la secuencia de aminoácidos codificada de tal modo se presenta en la SEQ ID NO: 2. Esta proteína humana TRAIL contiene un dominio citoplasmático en el terminal N (aminoácidos 1 -18), una región transmembrana (aminoácidos 19 -38), y un dominio extracelular (aminoácidos 39 -281). El dominio extracelular contiene una región de enlazamiento del receptor.
Las células de la cepa DH10B de E. coli transformadas con un vector recombinante que contiene este ADN humano para TRAIL fueron depositadas con la American Type Culture Collection el 14 de junio de 1995, y se les asignó el número de acceso no. 69849. El depósito se hizo bajo los términos del Tratado de Budapest. El vector recombinante en la cepa depositada es el vector de expresión pDC409 (descrito en el ejemplo 5). Se digirió el vector con SalI y NotI, y se ligó el ADN humano para TRAIL que incluye la región completa de codificación mostrada en la SEQ ID NO: 1 dentro del vector.
Se aisló el ADN que codifica una segunda proteína TRAIL humana como se describe en el ejemplo 2. La secuencia de nucleótidos de este ADN es presentado en la SEQ ID NO: 3, y la secuencia de aminoácidos codificada de tal modo es presentada en la SEQ ID NO: 4. La proteína codificada contiene un dominio citoplasmático en el terminal N (aminoácidos 1 -18), una región transmembrana (aminoácidos 19 -38), y un dominio extracelular (aminoácidos 39 101).
El ADN de la SEQ ID NO: 3 carece de una porción del ADN de la SEQ ID NO: 1, y es por lo tanto denominado el clon de la variante de supresión de TRAIL humana (huTRAILdv). Los nucleótidos 18 a 358 de la SEQ ID NO: 1 son idénticos a los nucleótidos 8 a 348 del ADN de huTRAILdv de la SEQ ID NO: 3. Los nucleótidos 359 a 506 de la SEQ ID NO: 1 faltan en el ADN clonado de la SEQ ID NO: 3. La supresión provoca un desplazamiento en el marco de lectura, que resulta en un codón de detención en el marco después el aminoácido 101 de la SEQ ID NO: 4. El ADN de la SEQ ID NO: 3 codifica por lo tanto una proteína truncada. Los aminoácidos 1 a 90 de la SEQ ID NO: 2 son idénticos a los aminoácidos 1 a 90 de la SEQ ID NO: 4. Sin embargo, debido a la supresión, la porción del terminal C de la proteína huTRAILdv (aminoácidos 91 a 101 de la SEQ ID NO: 4) se diferencia de los residuos en las posiciones correspondientes en la SEQ ID NO: 2. En contraste con la proteína huTRAIL de longitud completa, la proteína huTRAILdv truncada no exhibe la habilidad para inducir apoptosis de las células de leucemia de la célula T de la línea de células Jurkat.
El ADN que codifica una proteína TRAIL de ratón también ha sido aislado, como se describe en el ejemplo 3. La secuencia de nucleótidos de este ADN es presentada en la SEQ ID NO: 5 y la secuencia de aminoácidos codificada de tal modo está presentada en la SEQ ID NO:... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo que consiste de:
a) un dominio extracelular de la TRAIL humana de la SEQ ID NO: 2; y
b) un fragmento de dicho dominio extracelular de (a) en donde el fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL,
en donde dicho polipéptido TRAIL humano soluble es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
2. Un polipéptido TRAIL de la reivindicación 1, que contiene una secuencia de aminoácidos seleccionada del grupo que consiste de:
a) el dominio extracelular de TRAIL humano (aminoácidos 39 a 281 de la SEQ ID NO: 2); y
b) un fragmento de dicho dominio extracelular, en donde dicho fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
3. Un polipéptido TRAIL de la reivindicación 2, que contiene la secuencia de aminoácidos x hasta 281 de la SEQ ID NO: 2, en donde x representa un entero de 39 a 95.
4. Un polipéptido TRAIL de la reivindicación 1, en donde dicho polipéptido TRAIL soluble contiene una sustitución(es) conservadora(s) en una secuencia de aminoácidos seleccionada del grupo que consiste de:
a) un dominio extracelular de TRAIL humana (aminoácidos 39 a 281 de la SEQ ID NO: 2); y
b) un fragmento de dicho dominio extracelular en donde el fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL,
en donde la TRAIL sustituida en forma conservadora es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
5. Un oligómero que comprende de dos a tres polipéptidos TRAIL solubles de cualquiera de las reivindicaciones 1 a
4.
6. Un trímero TRAIL que contiene tres polipéptidos TRAIL solubles de cualquiera de las reivindicaciones 1 a 4.
7. Un polipéptido TRAIL purificado, en donde dicho polipéptido TRAIL es un fragmento de la proteína TRAIL humana de la SEQ ID NO: 2, en donde dicho fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
8. Una proteína de fusión que comprende un polipéptido TRAIL de acuerdo con cualquiera de las reivindicaciones 1 a 7, fusionada a un polipéptido heterólogo.
9. Una proteína de fusión de acuerdo con la reivindicación 8, en donde dicho polipéptido heterólogo promueve oligomerización.
10. Un oligómero de acuerdo con la reivindicación 5, que comprende tres polipéptidos TRAIL solubles.
11. Una composición que comprende un polipéptido TRAIL, oligómero, o proteína de fusión de acuerdo con cualquiera de las reivindicaciones 1 a 10, y un portador, diluyente o excipiente fisiológicamente aceptable.
12. Una composición que comprende un oligómero de acuerdo con la reivindicación 10, y un portador, diluyente o excipiente fisiológicamente aceptable.
13. Un ADN aislado que codifica un polipéptido TRAIL, en donde dicho polipéptido TRAIL es un fragmento de la proteína TRAIL humana de la SEQ ID NO: 2, en donde dicho fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
14. Un ADN aislado que codifica un polipéptido TRAIL soluble, en donde dicho polipéptido TRAIL soluble comprende una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo que consiste de:
a) el dominio extracelular de la proteína TRAIL humana de la SEQ NO:2; y
b) un fragmento de dicho dominio extracelular en donde el fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL;
en donde dicho polipéptido TRAIL soluble es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
15. Un ADN de la reivindicación 14, en donde dicho polipéptido TRAIL soluble comprende una secuencia de aminoácidos seleccionada del grupo que consiste de:
a) el dominio extracelular de TRAIL humano (aminoácidos 39 a 281 de la SEQ ID NO: 2); y
b) un fragmento de dicho dominio extracelular, en donde dicho fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
16. Un ADN de la reivindicación 15, en donde dicho polipéptido TRAIL soluble comprende la secuencia de aminoácidos x a 281 de la SEQ ID NO: 2, en donde x representa un entero de 39 a 95.
17. Un ADN de la reivindicación 14, en donde dicho polipéptido TRAIL soluble comprende una sustitución(es) conservadora(s) en una secuencia de aminoácidos seleccionada del grupo que consiste de:
a) el dominio extracelular de TRAIL humano (aminoácidos 39 a 281 de la SEQ ID NO: 2); y
b) un fragmento de dicho dominio extracelular en donde el fragmento es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL,
en donde el TRAIL sustituido en forma conservadora es capaz de inducir apoptosis de células cancerosas sensibles a TRAIL.
18. Un vector de expresión que comprende un ADN de acuerdo con cualquiera de las reivindicaciones 13 a 17.
19. Un proceso para preparar un polipéptido TRAIL, que comprende el cultivo de una célula huésped transformada con un vector de acuerdo con la reivindicación 18 bajo condiciones que promueven la expresión de TRAIL, y la recuperación del polipéptido TRAIL.
20. Un polipéptido, oligómero o proteína de fusión TRAIL de acuerdo con cualquiera de las reivindicaciones 1 a 10 para uso en medicina humana.
Patentes similares o relacionadas:
OLIGOPÉPTIDOS NO PROTEOLIZABLES INHIBIDORES DE LA GLICOPROTEINA GP41 DEL VIH, del 21 de Octubre de 2011, de UNIVERSIDAD DEL PAIS VASCO UNIVERSIDAD DE VALENCIA: Oligopéptidos no proteolizables inhibidores de la glicoproteína 41 del virus del SIDA. La presente invención se refiere a la identificación de oligopéptidos, […]
PÉPTIDOS ESPECÍFICOS PARA LAS METÁSTASIS Y SUS APLICACIONES EN DIAGNÓSTICO Y TERAPÉUTICAS, del 19 de Julio de 2011, de UNIVERSITA' DEGLI STUDI DI TORINO: Un péptido capaz de fijarse selectivamente a células metastásicas, preferiblemente células de metástasis hepáticas humanas, que tiene el motivo de secuencia LRS, una longitud […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
COMPOSICIÓN COSMÉTICA O FARMACÉUTICA QUE CONTIENE PÉPTIDOS CON LA SECUENCIA ARG-GLY-SER, del 3 de Junio de 2011, de SOCIETE D'EXTRACTION DES PRINCIPES ACTIFS ( VINCIENCE SA): Composición cosmética y/o dermatológica y/o farmacéutica caracterizada porque contiene en un medio aceptable, como principio activo, por lo menos un péptido de fórmula […]
LIGACIÓN QUÍMICA "SEUDO"- NATURAL, del 1 de Junio de 2011, de AMYLIN PHARMACEUTICALS, INC.: Procedimiento para sintetizar un polipéptido deseado de fórmula: aaNH2-Q-aax-aay-W-aaCOOH en la que Q y W indican cada uno la presencia opcional de uno o más restos […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]
POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]
RECUPERACIÓN EFICAZ DE PROTEÍNAS REPLEGADAS CORRECTAMENTE, del 13 de Diciembre de 2011, de IMMUNEX CORPORATION: Un método para promover una conformación deseada de una forma soluble recombinante glicosilada de un receptor de TNF que ha sido secretado por una célula de mamífero, […]