Receptores de factor de necrosis tumoral alfa y beta.
SE REVELAN PROTEINAS RECEPTORAS DEL FACTOR DE NECROSIS TUMORAL,
DNAS Y VECTORES DE EXPRESION QUE CODIFICAN LOS RECEPTORES TNF, Y PROCESOS PARA LA PRODUCCION DE RECEPTORES TNF COMO PRODUCTOS DE CULTIVO DE CELDAS RECOMBINANTES
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E90309875.
Solicitante: IMMUNEX CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 51 UNIVERSITY STREET SEATTLE WASHINGTON 98101 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GOODWIN, RAYMOND, G., SMITH, CRAIG, A., BECKMANN, PATRICIA M.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K14/715 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para citoquinas; para linfoquinas; para interferones.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
PDF original: ES-2080809_T3.pdf
Fragmento de la descripción:
Receptores de factor de necrosis tumoral alfa y beta.
Antecedentes de la invención
La presente invención se refiere en general a receptores de citoquinas y, más específicamente, a receptores de factores de necrosis tumoral.
El factor de necrosis tumoral a (TNFa , también conocido como caquectina) y el factor de necrosis tumoral b (TNFb , también conocido como linfotoxina) son proteínas secretoras endógenas homólogas de mamífero capaces de inducir una amplia variedad de efectos sobre un gran número de tipos de células. Las grandes similitudes en las características estructurales y funcionales de estas dos citoquinas han dado como resultado su descripción colectiva como "TNF". Se han aislado clones de cDNA complementario que codifican TNFa (Pennica y otros, Nature 312:724, 1984) y TNFb (Gray y otros, Nature 312:721, 1984), permitiendo mayor caracterización estructural y biológica del TNF.
Las proteínas de TNF inician su efecto biológico sobre las células uniéndose a proteínas receptoras de TNF (TNF-R) específicas expresadas sobre la membrana plasmática de una célula sensible a TNF. Se observó en primer lugar que el TNFa y el TNFb se unían a un receptor común en la línea de células de carcinoma cervical humano ME-180 (Aggarwal y otros, Nature 318:665, 1985). Las estimaciones del tamaño de los TNF-R determinadas por estudios de marcaje por afinidad variaban de 54 a 175 kDa (Creasey y otros, Proc. Natl. Acad. Sci. USA 84:3293, 1987; Stauber y otros, J. Biol. Chem. 263:19098, 1988; Hohmann y otros, J. Biol. Chem. 264:14927, 1989). Aunque la relación entre estos TNF-Rs de masa molecular diferente no está clara, Hohmann y otros (J. Biol. Chem. 264:14927, 1989) daban cuenta de que al menos existen dos receptores de la superficie celular diferentes para TNF sobre tipos de células diferentes. Estos receptores tienen una masa molecular aparente de aproximadamente 80 kDa y de aproximadamente 55-60 kDa, respectivamente. Ninguna de las publicaciones anteriores, sin embargo, daba cuenta de la purificación hasta homogeneidad de receptores de TNF de la superfie celular.
Además de los receptores de la superficie celular para TNF, también se han identificado proteínas solubles de orina humana capaces de unirse a TNF (Peetre y otros, Eur. J. Haematol. 41:414, 1988; Seckinger y otros, J. Exp. Med. 167:1511, 1988; Seckinger y otros, J. Biol. Chem. 264:11966, 1989; Solicitud de Patente del Reino Unido, Publicación Nº 2 218 101 A de Seckinger y otros; Engelmann y otros, J. Biol. Chem. 264:11974, 1989). La proteína urinaria soluble que se une a TNF descrita por UK 2 218 101 A tiene una secuencia de aminoácidos N-terminal parcial de Asp-Ser-Val-Cys-Pro-, que corresponde a la secuencia parcial descrita más tarde por Engelmann y otros (1989). La relación de las anteriores proteínas urinarias solubles de unión se elucidó adicionalmente después de que se presentara la solicitud principal original (Nº de Serie de EE.UU: 403.241) de la presente solicitud, cuando Engelmann y otros dieron cuenta de la identificación y purificación de una segunda proteína urinaria soluble que se une a unión a TNF distinta que tenía una secuencia de aminoácidos N-terminal de Val-Ala-Phe-Thr-Pro- (J. Biol. Chem. 265:1531, 1990). Las dos proteínas urinarias descritas en UK 2 218 101 A y en las publicaciones de Engelmann y otros se mostraban inmunoquímicamente afines a dos proteínas de la superficie celular aparentemente distintas por la capacidad del antisuero contra las proteínas de unión para inhibir la unión de TNF a ciertas células.
Más recientemente, dos grupos separados daban cuenta de la clonación y expresión moleculares de un TNF-R humano de 55 kDa (Loetscher y otros, Cell 61:351, 1990; Schall y otros, Cell 61:361, 1990). El TNF-R de ambos grupos tiene una secuencia de aminoácidos N-terminal que corresponde a la secuencia de aminoácidos parcial de la proteína urinaria de unión descrita por UK 2 218 101 A, Engelmann y otros (1989) y Engelmann y otros (1990).
Para elucidar la relación de las múltiples formas de TNF-R y las proteínas urinarias solubles de unión a TNF, o para estudiar las características estructurales y biológicas de los TNF-Rs y el papel jugado por los TNF-Rs en las respuestas de diversas poblaciones de células a TNF o a otra estimulación por citoquinas, o para usar los TNF-Rs eficazmente en terapia, diagnóstico o ensayo, son necesarias composiciones purificadas de TNF-R. Tales composiciones, sin embargo, son obtenibles en rendimientos prácticos solamente clonando y expresando genes que codifican los receptores usando tecnología de DNA recombinante. Los esfuerzos para purificar la molécula de TNF-R para usar en análisis bioquímico o para clonar y expresar genes de mamífero que codifican TNF-R, sin embargo, han sido impedidos por la falta de una fuente adecuada de proteína o mRNA del receptor. Antes de la presente invención, no se conocían líneas de células para expresar niveles altos de TNF-R constitutivamente y continuamente, lo que impedía la purificación del receptor para la secuenciación o la construcción de bibliotecas genéticas para la clonación de cDNA.
Sumario de la invención
En una primera modalidad, la invención proporciona una secuencia de DNA aislada que codifica una proteína de receptor de TNF (TNF-R) de mamífero biológicamente activa seleccionada de:
(a) los aminoácidos 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 163-235; y
(b) los aminoácidos 1-233 de la Figura 3A.
Una segunda modalidad proporciona una secuencia de DNA aislada que codifica una proteína receptora de TNF (TNF-R) de mamífero biológicamente activa seleccionada de:
(a) secuencias de DNA seleccionadas de la región de codificación del gen de TNF-R natural de mamífero de la Fig. 2A-2B o la Fig. 3A-3B;
(b) secuencias de DNA capaces de hibridarse hasta las secuencias de (a) bajo condiciones moderadamente rigurosas, esto es a 50ºC en 2xSSC;
(c) secuencias de DNA que están degeneradas como resultado del código genético hasta la secuencia de (a) - (b).
En particular, la presente invención proporciona secuencias de DNA que codifican receptores de TNF solubles.
La presente invención también proporciona vectores de expresión recombinantes que comprenden las secuencias de DNA definidas anteriormente, moléculas de TNF-R recombinantes producidas usando los vectores de expresión recombinantes, y procesos para producir las moléculas de TNF-R recombinantes usando los vectores de expresión.
La presente invención también proporciona composiciones de proteína aislada o purificada que comprenden TNF-R, y, en particular, formas solubles de TNF-R.
La presente invención también proporciona composiciones para uso en terapia, diagnóstico, ensayo de TNF-R, o para originar anticuerpos para TNF-R, que comprenden cantidades efectivas de proteínas receptoras solubles naturales o recombinantes preparadas de acuerdo con los procesos precedentes.
Debido a la capacidad del TNF para unirse específicamente a receptores de TNF (TNF-Rs), las composiciones de TNF-R purificado serán útiles en ensayos de diagnóstico para TNF, así como para producir anticuerpos para el receptor de TNF para usar en diagnóstico y terapia. Además, las composiciones de receptores de TNF purificados pueden usarse directamente en terapia para unirse a o eliminar TNF, proporcionando de ese modo un medio para regular las actividades inmunitarias de esta citoquina.
Estos y otros aspectos de la presente invención serán evidentes en referencia a la siguiente descripción detallada.
Breve descripción de los dibujos
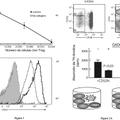
La Figura 1 es una representación esquemática de la región de codificación de diversos cDNAs que codifican TNF-Rs humanos y de ratón. La secuencia conductora es rayada y la región de transmembrana es sólida.
La Figura 2A-2B representa la secuencia de cDNA parcial y la secuencia de aminoácidos derivada del clon 1 de TNF-R humano. Los nucleótidos se enumeran desde el principio de la región no traducida 5'. Los aminoácidos se enumeran desde el principio de la secuencia del péptido de señal. La secuencia del péptido de señal putativa está representada por los aminoácidos -22 a -1. La leucina N-terminal de la proteína de TNF-R madura está subrayada en la posición 1. La región de transmembrana predicha desde los aminoácidos 236 a 265 también está subrayada. Los términos C de diversos TNF-Rs solubles están marcados con una... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para preparar una proteína de TNF-R de mamífero purificada, comprendiendo el proceso acoplar juntos residuos de aminoácidos sucesivos para formar una proteína de receptor (TNF-R) seleccionada de:
(a) los aminoácidos 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 163-235; y
(b) los aminoácidos 1-233 de la Figura 3A.
2. Un proceso de acuerdo con la reivindicación 1, en el que la secuencia de TNF-R comprende la secuencia de los residuos de aminoácido 1-235 de la Figura 2A.
3. Un proceso de acuerdo con la reivindicación 1, en el que la secuencia de TNF-R comprende la secuencia de los residuos de aminoácido 1-185 de la Figura 2A.
4. Un proceso de acuerdo con la reivindicación 1, en el que la secuencia de TNF-R comprende la secuencia de los residuos de aminoácido 1-163 de la Figura 2A.
5. El uso de una proteína de TNF-R de mamífero de acuerdo con la reivindicación 1, en la preparación de un medicamento para regular respuestas inmunitarias en mamíferos.
6. El uso de una proteína de TNF-R de mamífero de acuerdo con la reivindicación 1, en la preparación de una composición farmacéutica adecuada para administración parenteral a un paciente humano para regular respuestas inmunitarias.
7. Un proceso para preparar una secuencia de DNA que codifica una proteína de receptor de TNF (TNF-R) de mamífero seleccionada de los residuos de aminoácido 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 163-235; y los aminoácidos 1-233 de la Figura 3A, comprendiendo el proceso acoplar juntos residuos de nucleótido sucesivos.
8. Un proceso para preparar una secuencia de DNA de acuerdo con la reivindicación 7, en el que la secuencia de DNA codifica una proteína de TNF-R soluble que tiene una secuencia de aminoácidos que comprende la secuencia de residuos de aminoácido 1-235 de la Figura 2A.
9. Un proceso para preparar una secuencia de DNA de acuerdo con la reivindicación 7, en el que la secuencia de DNA codifica una proteína de TNF-R soluble que tiene una secuencia de aminoácidos que comprende la secuencia de residuos de aminoácido 1-185 de la Figura 2A.
10. Un proceso para preparar una secuencia de DNA de acuerdo con la reivindicación 7, en el que la secuencia de DNA codifica una proteína de TNF-R soluble que tiene una secuencia de aminoácidos que comprende la secuencia de residuos de aminoácido 1-163 de la Figura 2A.
11. Un proceso para preparar una secuencia de DNA de acuerdo con la reivindicación 7, seleccionándose dicho DNA de:
(a) clones de cDNA que tienen una secuencia de nucleótidos seleccionada de la región de codificación de un gen de TNF-R natural de mamífero de la Figura 2A-2B o la Figura 3A-3B;
(b) secuencias de DNA capaces de hibridarse hasta los clones de (a) bajo condiciones moderadamente rigurosas, (50ºC, 2 x SSC) y que codifican proteína de TNF-R biológicamente activa; y
(c) secuencias de DNA que están degeneradas como resultado del código genético hasta las secuencias DNA definidas en (a) y (b) y que codifican proteína de TNF-R biológicamente activa.
12. Un proceso para preparar una secuencia de DNA de acuerdo con la reivindicación 7, codificando dicho DNA una proteína de TNF-R que tiene la secuencia de aminoácidos de la proteína de TNF-R expresada por pCAV/NOT-TNF-R (ATCC 68088).
13. Un proceso para preparar un vector de expresión recombinante, que comprende ligar DNA de vector de expresión bacteriano, de levadura o de mamífero y una secuencia de DNA que codifica una secuencia de proteína de TNF-R humana seleccionada de los residuos de aminoácidos 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 163-235 y los aminoácidos 1-233 de la Figura 3A.
14. Un proceso para preparar un TNF-R de mamífero o un análogo del mismo, que comprende cultivar una célula huésped adecuada que comprende un vector preparado de acuerdo con la reivindicación 13 bajo condiciones que promueven la expresión.
15. Un proceso para detectar moléculas de TNF o TNF-R o la interacción de las mismas, que comprende el uso de una secuencia de proteína de receptor de TNF de mamífero seleccionada de los residuos de aminoácidos 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 1-163-235; y los aminoácidos 1-233 de la Figura 3A, o un análogo de TNF-R codificado por secuencias de DNA de acuerdo con la reivindicación 11.
16. Un proceso para la preparación de anticuerpos inmunorreactivos con una secuencia de proteína de receptor de TNF seleccionada de los residuos de aminoácidos 1-x de la Figura 2A, en donde x se selecciona de los aminoácidos 163-235; y los aminoácidos 1-233 de la Figura 3A, comprendiendo el proceso (a) cultivar una célula de hibridoma que expresa los anticuerpos y recoger los anticuerpos, o (b) recoger anticuerpos inmunorreactivos con tal receptor de TNF de un animal apropiadamente inmunizado.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]