CELULAS LOCALIZADAS EN TUMORES MODIFICADAS POR INGENIERIA GENETICA PARA PRODUCIR LIGANDO INDUCTOR DE APOPTOSIS RELACIONADO CON EL FACTOR DE NECROSIS TUMORAL (TRAIL).
Células hematopoyéticas CD34+ procedentes de la sangre periférica de pacientes con cáncer tratados con factor de crecimiento y transducidas con el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral,
con la condición de que dichas células no son células dendríticas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/007957.
Solicitante: DOMPE S.P.A..
Nacionalidad solicitante: Italia.
Dirección: LOCALITA CAMPO DI PILE SNE,67100 L'AQUILA.
Inventor/es: COLOTTA, FRANCESCO, GIANNI,ALESSANDRO,M, CARLO-STELLA,CARMELO.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07K14/47A33
Clasificación PCT:
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C12N15/28 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Factores de necrosis de tumores.
- C12N5/16 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células animales.
Clasificación antigua:
- C07K14/705 C07K 14/00 […] › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C12N5/06
Fragmento de la descripción:
Células localizadas en tumores modificadas por ingeniería genética para producir ligando inductor de apoptosis relacionado con el factor de necrosis tumorales (TRAIL).
Campo de la invención
La presente invención se refiere a células localizadas en tumores que expresan el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (TRAIL) y al uso de las mismas en una terapia antitumoral.
Antecedentes de la invención
Los mecanismos de apoptosis desregulados juegan papeles clave en la patogénesis y progresión de trastornos linfoproliferativos, al permitir que las células neoplásicas sobrevivan más allá de su vida normal, y finalmente adquieran quimiorresistencia [1]. De esta manera, las rutas apoptóticas representan dianas terapéuticas atractivas para restaurar la sensibilidad a la apoptosis de células malignas o activar agonistas de apoptosis [2]. Para modular genes y proteínas apoptóticas, puede preverse varias estrategias que se dirigen a la ruta intrínseca (Bcl-2, Bcl-XL), extrínseca (DR4, DR5, FLIP) o de convergencia (cIAP2) de apoptosis [3].
El ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (TRAIL) pertenece a la familia de ligandos de receptores de muerte del TNF [4].
En el documento WO 97/01633 se desvelan secuencias de ADN aisladas que codifican TRAIL, vectores de expresión que comprenden dichas secuencias de ADN y polipéptidos TRAIL recombinantes.
TRAIL se une al receptor de muerte 4 (DR4) y al receptor de muerte 5 (DR5), que se expresan en la superficie celular de muchas células cancerosas [5]. La unión de TRAIL soluble a DR4 o DR5 conduce a activación de caspasas y a la apoptosis [6].
Liu Zhongyu y col., J Clin Invest. Vol 112, nº 9, 9.11.2003, 1332-1341, desvelan células dendríticas transducidas con TRIAL por adenovirus recombinantes y su posible uso médico en el tratamiento de artritis. No se menciona el posible uso de dichas células para el tratamiento de tumores.
Ciertos estudios in vitro e in vivo sugieren que debido a su alta especificidad por células cancerosas así como a su potente actividad antitumoral, el TRAIL recombinante soluble podría jugar un papel clave en la terapia contra el cáncer [7]. De hecho, TRAIL induce selectivamente la apoptosis en muchas células transformadas, mientras que respeta a las células normales [4]. Además, la administración de TRAIL en ratones ejerce una notable eficacia contra xenoinjertos tumorales de carcinoma de colón [8, 9], cáncer de mama [10], mieloma múltiple [11] o glioma [12, 13].
Ciertos estudios de toxicidad en ratones y primates no humanos han demostrado que los hepatocitos y queratinocitos normales son resistentes a la versión trimerizada de TRAIL [14, 15], mientras que muestran una sensibilidad significativa a la inducción de apoptosis por preparaciones de TRAIL no optimizadas o variantes entrecruzadas con anticuerpos del ligando [16]. Sigue creando polémica si la toxicidad hepática podría representar o no un problema importante cuando se usa una versión trimerizada de TRAIL a altas dosis.
Una limitación adicional al uso de TRAIL soluble se representa por la respuesta apoptótica reducida observada en un número y diversidad sustancial de líneas de células tumorales que requieren un tiempo de incubación prolongado o una dosis muy elevada de TRAIL soluble para experimentar apoptosis [17, 18]. Dado el perfil farmacocinético de TRAIL después de la inyección intravenosa (semivida plasmática de 32 minutos y semivida de eliminación de 4,8 horas), las condiciones de un tiempo de exposición prolongado y altas concentraciones no son transferibles para ninguna estrategia de tratamiento in vivo [10]. Para superar las limitaciones relacionadas con TRAIL recombinante soluble y dirigirse específicamente a las células tumorales, actualmente se están explotando varias estrategias de transferencia génica de TRAIL mediada por adenovirus usando diferentes modelos animales [19, 20].
Sin embargo, las estrategias de transferencia génica dependen en gran medida de la infección eficaz del tumor y de la elusión de la eliminación inmune para ser eficaces [21]. Además, aún no se han abordado varias cuestiones de seguridad asociadas con la inyección sistémica de vectores adenovirales [22]. Por ejemplo, la transferencia de genes adenovirales de TRAIL soluciona una respuesta apoptótica reducida de células de hepatoma, pero produce una apoptosis severa en hepatocitos primarios humanos [19]. Actualmente, las estrategias de terapia génica basadas en adenovirus principalmente se basan en el suministro intratumoral de adenovirus que codifican TRAIL [23]. A pesar de una actividad antitumoral local, el suministro intratumoral de TRAIL no tiene actividad antitumoral sistémica, por lo que carece de valor clínico.
Se sabe que diversos tipos celulares se localizan preferentemente en tumores [24] y pueden cargarse con las construcciones necesarias para producir moléculas anticancerosas. Debido a sus características de localización, las células CD34+ [25] y las células destructoras naturales (NK) [26] pueden usarse como vehículos de suministro para moléculas anticancerosas.
Después de una infusión intravenosa, las células CD34+ presentan propiedades de localización específicas, incluyendo la capacidad de colonizar permanentemente la médula ósea, y colonizar transitoriamente el hígado y el bazo [27-30]. Estas propiedades de localización están relacionadas estrictamente con la expresión de receptores de adhesión (por ejemplo, CXCR-4, VLA-4, VLA-5, CD44, etc.) que interaccionan con ligandos específicos (por ejemplo, SDF-1, VCAM-1, etc.) que se expresan en células estromáticas que residen dentro del microentorno de la médula ósea así como en el microentorno del tumor [31-34].
Las células NK son una subserie de linfocitos que juegan un papel esencial en la defensa inmune basada en células contra células tumorales por medio de mecanismos no restringidos al complejo principal de histocompatibilidad [35]. Después de la infusión intravenosa, las células NK se localizan en la médula ósea y órganos linfoides y se extravasan a sitios tumorales bajo la influencia de señales de citocinas apropiadas. Hasta ahora muchos grupos han tratado de usar la localización de células NK en tumores con fines terapéuticos [36-38].
Aunque se conocen las propiedades de localización en tumores de las células NK, las células modificadas genéticamente experimentan un estrés que depende del tipo de gen transducido. Como consecuencia de dicho estrés, las células pueden perder las propiedades originales de localización en tumores cuando se transducen con el gen de TRAIL. Por lo tanto, no hay una expectativa razonable de éxito y se necesitan ensayos experimentales reales para confirmar si la estrategia considerada específica puede ser viable o no.
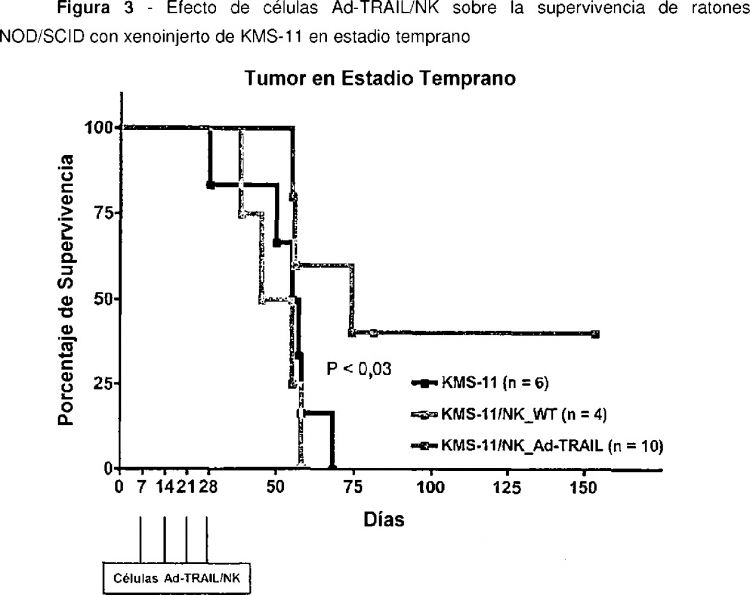
Ahora se ha descubierto que células CD34+ modificadas por ingeniería genética para expresar TRAIL pueden explotarse ventajosamente para conseguir una actividad antitumoral mediada por células in vivo.
Descripción de la invención
De acuerdo con la presente invención, se modifican por ingeniería genética células CD34+ de localización en tumores para producir ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (TRAIL) mediante transferencia génica mediada por adenovirus. Las células de acuerdo con la presente invención pueden administrarse sistémicamente para suministrar TRAIL en el sitio del tumor sin ocasionar los inconvenientes mencionados anteriormente.
Por consiguiente, la presente invención se refiere a células de localización tumoral que expresan TRAIL y a preparaciones celulares que las contienen. La invención también se refiere al uso de dichas células para la preparación de composiciones celulares para terapia anticancerosa, en particular para la terapia de linfomas humanos.
Las células de la invención pueden obtenerse por transducción de células de localización tumoral con un adenovirus deficiente en la replicación que codifica el gen de TRAIL humano (Ad- TRIAL) bajo el control de un promotor adecuado, por ejemplo, el promotor de CMV. La transducción puede realizarse de acuerdo con procedimientos bien conocidos para los biólogos moleculares, preferentemente después del procedimiento descrito en los ejemplos.
La expresión células "de localización tumoral" se usa de acuerdo con la invención para definir células que pueden: (1) localizarse en un tejido tumoral después de una inyección...
Reivindicaciones:
1. Células hematopoyéticas CD34+ procedentes de la sangre periférica de pacientes con cáncer tratados con factor de crecimiento y transducidas con el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral, con la condición de que dichas células no son células dendríticas.
2. Células de acuerdo con la reivindicación 1, que pueden obtenerse por transducción de células CD34+ con vectores adenovirales que codifican el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral.
3. Preparaciones celulares que contienen las células de las reivindicaciones 1-2 en mezcla con vehículos fisiológicamente aceptables.
4. Uso de las células de las reivindicaciones 1-2 para la preparación de un medicamento para el tratamiento de tumores.
5. Uso de acuerdo con la reivindicación 4, en el que el tumor es un linfoma.
6. Uso de acuerdo con la reivindicación 4, en el que el tumor es un carcinoma de mama.
7. Uso de acuerdo con la reivindicación 4, 5 ó 6 en el que el medicamento se administra por vía intravenosa.
Patentes similares o relacionadas:
PÉPTIDOS CON ACTIVIDAD APOPTÓTICA, del 7 de Diciembre de 2011, de CYTOTOOLS AG: Medicamento para el tratamiento de la arteriosclerosis, que comprende al menos una sustancia de actividad apoptótica o una sal farmacéuticamente […]
 ANTICUERPOS BAG3 PARA SU USO EN INVESTIGACIÓN , DIAGNÓSTICO Y TRATAMIENTO DE ENFERMEDADES RELACIONADAS CON LA MUERTE CELULAR, del 23 de Mayo de 2011, de BIOUNIVERSA S.r.l: Un anticuerpo AC-1 secretado por el clon madre de hibridoma nº PD02009 depositado el 17/12/2002 en el Centro Biotecnologie Avanzate, Génova, […]
ANTICUERPOS BAG3 PARA SU USO EN INVESTIGACIÓN , DIAGNÓSTICO Y TRATAMIENTO DE ENFERMEDADES RELACIONADAS CON LA MUERTE CELULAR, del 23 de Mayo de 2011, de BIOUNIVERSA S.r.l: Un anticuerpo AC-1 secretado por el clon madre de hibridoma nº PD02009 depositado el 17/12/2002 en el Centro Biotecnologie Avanzate, Génova, […]
METODO PARA LA IDENTIFICACION DE COMPUESTOS QUE INDUCEN O INHIBEN ESTRES DE RETICULO ENDOPLASMATICO O ESTRES OXIDATIVO, del 24 de Enero de 2011, de UNIVERSIDAD AUTONOMA DE MADRID: Método para la identificación de compuestos que inducen o inhiben estrés de retículo endoplasmático o estrés oxidativo.La presente invención […]
SUPRESION DE LA APOPTOSIS EN LINFOCITOS B EN ANIMALES TRANSGENICOS QUE EXPRESAN INMUNOGLOBULINA HUMANIZADA, del 26 de Noviembre de 2010, de THERAPEUTIC HUMAN POLYCLONALS, INC: Un animal transgénico no humano sometido a linfopoyesis a corto plazo que comprende al menos una construcción transgénica que comprende el inhibidor […]
 MARCADOR TUMORAL Y DE SENESCENCIA, del 26 de Agosto de 2010, de POLYMUN SCIENTIFIC IMMUNBIOLOGISCHE FORSCHUNG GMBH: Uso de un compuesto aislado o producido de manera sintética seleccionado entre el grupo constituido por
a) una secuencia de nucleótidos […]
MARCADOR TUMORAL Y DE SENESCENCIA, del 26 de Agosto de 2010, de POLYMUN SCIENTIFIC IMMUNBIOLOGISCHE FORSCHUNG GMBH: Uso de un compuesto aislado o producido de manera sintética seleccionado entre el grupo constituido por
a) una secuencia de nucleótidos […]
PEPTIDOS QUE SE UNEN A LA PROTEINA FOSFATASA 2A Y POLINUCLEOTIDOS QUE CODIFICAN PARA LOS MISMOS, del 2 de Julio de 2010, de INSTITUT PASTEUR: Péptido caracterizado porque se une in vitro, de manera específica, a una holoenzima proteína fosfatasa de tipo 2A o una de sus subunidades y porque se elige […]
NUEVAS PROTEINAS ASOCIADAS A LA MUERTE DE LA FAMILIA THAP Y RUTAS PAR4 RELACIONADAS IMPLICADAS EN EL CONTROL DE LA APOPTOSIS, del 3 de Mayo de 2010, de ENDOCUBE SAS CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS): Un método para identificar un compuesto de ensayo que modula las actividades mediadas por THAP ("THanatos-Associated Protein", proteína asociada […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]