ANALOGOS DE RNA PEQUEÑOS DE INTERFERENCIA (SIRNA).
Un compuesto bicatenario que comprende una hebra codificante y una hebra no codificante,
en el que cada hebra comprende 12-35 nucleótidos y en el que dicho compuesto comprende al menos un monómero de ácido nucleico cerrado (LNA) que tiene la estructura **(Ver fórmula)** en las que X se selecciona a partir del grupo constituido por O, S y NR H , donde R H es H o alquilo C 1-4; Y es CH2; B es una nucleobase; Z y Z* están independientemente ausentes o se seleccionan a partir del grupo constituido por un grupo de enlace internucleosídico, un grupo terminal y un grupo protector; de forma que cuando el monómero de LNA está localizado en el extremo 3'', Z es un grupo terminal y Z* es un grupo de enlace internucleosídico; cuando el monómero de LNA está localizado en el extremo 5'', Z está ausente y Z* es un grupo terminal; y cuando el monómero de LNA está localizado dentro de la secuencia de nucleótidos, Z está ausente y Z* es un grupo de enlace internucleosídico, y en el que ningún monómero de LNA está localizado en el extremo 5'' de la hebra no codificante
Tipo: Resumen de patente/invención. Número de Solicitud: W04000192DK.
Solicitante: SANTARIS PHARMA A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: KOGLE ALLE 6,2970 HØRSHOLM.
Inventor/es: KOCH, TROELS, DR., WAHLESTEDT,CLAES, ELMEN,JOACIM, LIANG,ZICAI, SØRENSEN,ANDERS,MALLING, ØRUM,HENRIK.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C12N15/113A
- C12N15/11M
Clasificación PCT:
- A61K31/713 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos nucleicos u oligonucleótidos con estructura en doble hélice.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12N15/11 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
Clasificación antigua:
- A61K31/713 A61K 31/00 […] › Acidos nucleicos u oligonucleótidos con estructura en doble hélice.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- C07H21/04 C07H 21/00 […] › con desoxirribosilo como radical sacárido.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
Fragmento de la descripción:
Análogos de RNA pequeños de interferencia (siRNA).
Campo de la invención
La presente invención se refiere a análogos pequeños de interferencia (siRNA) bicatenarios novedosos que comprenden monómeros de ácidos nucleicos cerrados (LNA). Dichos compuestos inducen la silenciación génica postranscripcional específica de secuencia en muchos organismos mediante un procedimiento conocido como interferencia de RNA (RNAi). Los compuestos descritos en el presente documento tienen propiedades mejoradas con respecto a los siRNA no modificados y pueden, en consecuencia, resultar útiles como agentes terapéuticos, por ejemplo, en el tratamiento de diversas formas de cáncer.
Antecedentes de la invención
Fire et al. descubrieron la interferencia de RNA (RNAi) en C. Elegans (Nature, 1998, 391, 806-811). Se encontró que largos tramos de RNA bicatenario (dsRNA) poseían un potente poder inactivador en la expresión génica que podía mantenerse durante generaciones en el gusano. La interferencia de RNA (RNAi) rápidamente se convirtió en una herramienta genómica funcional en C. Elegans (los inicios de la interferencia de RNA son revisados por Fire (TIG, 1999, 15, 358-363) y Bosher y Labouesse (Nature Cell Biology, 2000, 2, E31-E36)). Los primeros estudios en los que se demostró que la interferencia de RNA funcionaba en los vertebrados se realizaron en embriones de Danio rerio y en oocitos de ratón (Wargelius et al., Biochem. Biophys. Res. Com. 1999, 263, 156-161, Wianny y Zernicka-Goetz, Nature Cell Biology, 2000, 2, 70-75). Dado que el dsRNA induce efectos no específicos en las células de mamífero, se ha planteado la hipótesis de que estos mecanismos no estaban completamente desarrollados en el sistema embrionario murino (Alexopoulou et al., Nature, 2001, 413, 732-738, Reviews: Stark et al., Annu. Rev. Biochem., 1998, 67, 227-264 y Samuel, Clin. Micro. Rev., 2001, 14, 778-809).
En lo que respecta a C. Elegans y Drosophila, se ha demostrado que las hebras largas de RNAi se degradan a hebras bicatenarias cortas (21-23 nucleótidos) y que estas formas degradadas actúan de mediadoras de la interferencia (Zamore et al., Cell, 2000, 101, 25-33 y Elbashir et al., Gen. Dev., 2001, 15, 188-200). Elbashir et al. (Gen. Dev., 2001, 15, 188-200) demostraron que la escisión es igual en una diana codificante o no codificante y que ambas hebras del siRNA pueden guiar la escisión contra el RNA no codificante o codificante, respectivamente. Elbashir et al. mostraron de forma concluyente (Nature, 2001, 411, 494-498) que los siRNA actúan de mediadores de una inactivación potente en una variedad de líneas celulares de mamífero y probablemente eludían los efectos no específicos adversos de los dsRNA largos en las células de mamífero. Este descubrimiento supuso un hito en la biología moderna y la aplicación de los siRNA como agentes terapéuticos se convirtió rápidamente en un campo atractivo de investigación (revisado por McManus y Sharp, Nature Reviews Genetics, 2002, 3, 737-747 y Thompson, DDT, 2002, 7, 912-917).
Los dsRNA son bastante estables en medios biológicos. Sin embargo, en el momento en el que el dúplex se disocia formando las hebras individuales, estas, al ser de RNA, son degradadas inmediatamente. Una de las estrategias para conferir mayor estabilidad al siRNA ha sido introducir restos de RNA químicamente modificados en las hebras individuales del siRNA. Es bien sabido que los análogos de RNA sintéticos son mucho más estables en medios biológicos, y también se induce una mayor estabilidad en los restos de RNA naturales próximos. Por mayor estabilidad lo que se quiere decir principalmente es una mayor resistencia a las nucleasas pero también con dichas modificaciones se puede conferir una mejor captación celular y distribución tisular. Se han descrito diversos análogos de siRNA:
Pre-siRNA (Parrish et al. Mol. Cell, 2000, 6, 1077-1087) muestran tolerancia a ciertas modificaciones en el esqueleto para la RNAi en C. elegans. Mediante la transcripción in vitro de las dos hebras diferentes en presencia de nucleótidos modificados, fue posible demostrar que los fosforotioatos se toleran tanto en la hebra codificante como no codificante al igual que 2'-fluorouracilo en lugar de uracilo. 2'-Aminouracilo y 2'-aminocitidina reducen la actividad de RNAi cuando se incorporan a la hebra codificante y la actividad se pierde completamente cuando se incorporan a la hebra no codificante. Al cambiar uracilo a 2'-desoxitimidina en la hebra codificante, también se reduce el efecto, e incluso más cuando el cambio es en la hebra no codificante. Si una o ambas hebras están formadas completamente por monómeros de DNA, la actividad de RNAi se pierde totalmente. En el estudio mencionado anteriormente, también se investigaron modificaciones en las bases; se encontró que 4-tiouracilo y 5-bromouracilo se toleran en ambas hebras, mientras que 5-yodouracilo y 5-(3-aminoalil)uracilo reducen el efecto en la hebra codificante e incluso más en la hebra no codificante. Al sustituir la guanosina por inosina, se reduce mucho la actividad, independientemente de si la modificación se realiza en la hebra codificante o en la no codificante.
Sin embargo, las protuberancias de UU en 3' pueden intercambiarse por protuberancias de 2'desoxitimidina en 3' y son bien toleradas (Elbashir et al., Nature, 2001, 411, 494-498 y Boutla et al., Curr. Biol., 2001, 11, 1776-1780).
También se ha demostrado que pueden incorporarse monómeros de DNA en la hebra codificante sin poner en peligro la actividad.
Elbashir et al., (EMBO, 2001, 20, 6877-6888) demostraron que los siRNA modificados que contenían cuatro desoxinucleótidos en cada extremo 3' del siRNA mantenían toda la actividad. Además, se encontró que la actividad se eliminaba si el siRNA contenía sólo un emparejamiento de bases incorrecto en "mitad" de la molécula.
Sin embargo, también se reseñó que pueden tolerarse 1-2 emparejamientos incorrectos siempre que los emparejamientos incorrectos se introduzcan en la hebra codificante (Holen et al., NAR, 2002, 30, 1757-1766; Hohjoh, FEBS Lett., 2002, 26179, 1-5; Hamada et al., Antisense and Nucl. Acid Drug Dev., 2002, 12, 301-309; y Boutla et al., Curr. Biol., 2001, 11, 1776-1780)).
Nyk5nen et al. (Cell, 2001, 107, 309-321) demostraron la necesidad de ATP para producir siRNA de RNAi, pero también en las posteriores etapas para desarrollar la actividad de los siRNA. El ATP es necesario para desenrollar y mantener un 5'-fosfato para el reconocimiento por RISC. El 5'-fosfato es necesario para la actividad de siRNA. Martínez et al. (Cell, 2002, 110, 563-574) demostraron que una única hebra puede reconstituir el complejo silenciador inducido por RNA (RISC, Hammond et al., Nature, 2000, 404, 293-296) y que una única hebra no codificante tiene actividad especialmente cuando está 5'-fosforilada. La modificación en 5' de la hebra no codificante, inhibe la actividad aunque puede modificarse tanto el extremo 3' como el extremo 5' de la hebra codificante.
Amarzguioui et al. (NAR, 2003, 31, 589-595) confirmaron los hallazgos mencionados anteriormente, y se concluyó que se toleraba un emparejamiento incorrecto siempre que no estuviera demasiado cerca del extremo 5' de la hebra no codificante. Un emparejamiento incorrecto a 3-5 nucleótidos del extremo 5' de la hebra no codificante disminuye la actividad de forma notable. Sin embargo, se demostró que se toleran dos emparejamientos incorrectos si están en "medio" o hacia el extremo 3' de la hebra no codificante, aunque con una actividad ligeramente menor.
Se han introducido modificaciones, como por ejemplo fosforotioatos y 2'-O-metil RNA, en los extremos de siRNA (Amarzguioui et al., NAR, 2003, 31, 589-595) y se toleraban bien. La 2'-O-alilación reduce el efecto cuando está presente en el extremo 5' de la hebra no codificante.
El análogo nucleosídico bicíclico ENA (2'-0,4'-C-etilentimidina (ENA timidina, eT) también ha sido incorporado al siRNA (Hamada et al., Antisense and Nucl. Acid Drug Dev., 2002, 12, 301-309). Se demostró que dos ENA timidinas en el extremo 5' de la hebra codificante deterioraban el efecto. Hamada et al. (2002) concluyeron que: "al usar 2'-O,4'-C-etilen timidina, que es un componente de los ácidos nucleicos con puentes de etileno (ENA), se elimina completamente la RNAi".
Más recientemente, Braasch et al. (Biochemistry 2003, 42, 7967-7975) describieron un número de siRNA que contenían monómeros de LNA...
Reivindicaciones:
1. Un compuesto bicatenario que comprende una hebra codificante y una hebra no codificante,
en el que cada hebra comprende 12-35 nucleótidos y en el que dicho compuesto comprende al menos un monómero de ácido nucleico cerrado (LNA) que tiene la estructura
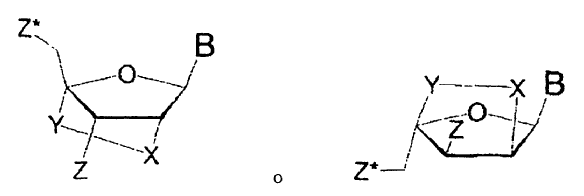
en las que
X se selecciona a partir del grupo constituido por O, S y NRH, donde RH es H o alquilo C1-4;
Y es CH2;
B es una nucleobase;
Z y Z* están independientemente ausentes o se seleccionan a partir del grupo constituido por un grupo de enlace internucleosídico, un grupo terminal y un grupo protector; de forma que cuando el monómero de LNA está localizado en el extremo 3', Z es un grupo terminal y Z* es un grupo de enlace internucleosídico; cuando el monómero de LNA está localizado en el extremo 5', Z está ausente y Z* es un grupo terminal; y cuando el monómero de LNA está localizado dentro de la secuencia de nucleótidos, Z está ausente y Z* es un grupo de enlace internucleosídico, y
en el que ningún monómero de LNA está localizado en el extremo 5' de la hebra no codificante.
2. El compuesto de acuerdo con la reivindicación 1, en el que la hebra codificante comprende 1-10 monómeros de LNA.
3. El compuesto de acuerdo con la reivindicación 1 ó 2, en el que al menos un monómero de LNA está localizado en el extremo 5' de la hebra codificante.
4. El compuesto de acuerdo con la reivindicación 3, en el que al menos dos monómeros de LNA están localizados en el extremo 5' de la hebra codificante.
5. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que al menos un monómero de LNA está localizado en el extremo 3' de la hebra codificante.
6. El compuesto de acuerdo con la reivindicación 5, en el que al menos dos monómeros de LNA están localizados en el extremo 3' de la hebra codificante.
7. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la hebra no codificante comprende al menos un monómero de LNA.
8. El compuesto de acuerdo con la reivindicación 7, en el que la hebra no codificante comprende 1-10 monómeros de LNA.
9. El compuesto de acuerdo con la reivindicación 7 u 8, en el que al menos un monómero de LNA está localizado en el extremo 3' de la hebra no codificante.
10. El compuesto de acuerdo con la reivindicación 9, en el que al menos dos monómeros de LNA están localizados en el extremo 3' de la hebra no codificante.
11. El compuesto de acuerdo con la reivindicación 10, en el que al menos tres monómeros de LNA están localizados en el extremo 3' de la hebra no codificante.
12. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la hebra codificante comprende al menos un LNA y la hebra no codificante comprende al menos un monómero de LNA.
13. El compuesto de acuerdo con la reivindicación 12, en el que la hebra codificante comprende 1-10 monómeros de LNA y la hebra no codificante comprende 1-10 monómeros de LNA.
14. El compuesto de acuerdo con la reivindicación 12 ó 13, en el que la hebra codificante comprende al menos un monómero de LNA en el extremo 5' y al menos un monómero de LNA en el extremo 3', y en el que la hebra no codificante comprende al menos un monómero de LNA en el extremo 3'.
15. El compuesto de acuerdo con la reivindicación 14, en el que la hebra codificante comprende al menos un monómero de LNA en el extremo 5' y al menos un monómero de LNA en el extremo 3', y en el que la hebra no codificante comprende al menos dos monómeros de LNA en el extremo 3'.
16. El compuesto de acuerdo con la reivindicación 15, en el que la hebra codificante comprende al menos dos monómeros de LNA en el extremo 5' y al menos dos monómeros de LNA en el extremo 3', y en el que la hebra no codificante comprende al menos dos monómeros de LNA en el extremo 3'.
17. El compuesto de acuerdo con la reivindicación 16, en el que la hebra codificante comprende al menos dos monómeros de LNA en el extremo 5' y al menos dos monómeros de LNA en el extremo 3', y en el que la hebra no codificante comprende al menos tres monómeros de LNA en el extremo 3'.
18. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la hebra codificante comprende al menos un monómero de LNA en al menos una de las posiciones 9-13 contadas a partir del extremo 5'.
19. El compuesto de acuerdo con la reivindicación 18, en el que la hebra codificante comprende un monómero de LNA en la posición 10.
20. El compuesto de acuerdo con la reivindicación 18 ó 19, en el que la hebra codificante comprende un monómero de LNA en la posición 11.
21. El compuesto de acuerdo con cualquiera de las reivindicaciones 18-20, en el que la hebra codificante comprende un monómero de LNA en la posición 12.
22. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que cada hebra comprende 17-25 nucleótidos.
23. El compuesto de acuerdo con la reivindicación 22, en el que cada hebra está formada por 20-22 nucleótidos.
24. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que al menos una de las hebras tiene una protuberancia en 3'.
25. El compuesto de acuerdo con la reivindicación 24, en el que la hebra codificante tiene una protuberancia en 3'.
26. El compuesto de acuerdo con la reivindicación 24 ó 25, en el que la hebra no codificante tiene una protuberancia en 3'.
27. El compuesto de acuerdo con una cualquiera de las reivindicaciones 24-26, en el que las protuberancias en 3' son de 1-3 nucleótidos.
28. El compuesto de acuerdo con la reivindicación 27, en el que tanto la hebra codificante como la no codificante comprenden dichas protuberancias en 3', en el que cada hebra comprende 17-25 nucleótidos; en el que la hebra codificante tiene uno o dos monómeros de LNA en el extremo 5' y uno o dos monómeros de LNA en el extremo 3'; y en el que la hebra no codificante tiene uno o dos monómeros de LNA en el extremo 3'.
29. El compuesto de acuerdo con una cualquiera de las reivindicaciones 1-28, en el que ningún monómero de LNA está localizado a 1, 2 ó 3 nucleótidos del extremo 5' de la hebra no codificante.
30. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que X se selecciona a partir del grupo constituido por O, S y NH.
31. El compuesto de acuerdo con la reivindicación 30, en el que X es O.
32. El compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, en el que dicho monómero de LNA está en la forma beta-D.
33. Un conjugado que comprende el compuesto de acuerdo con una cualquiera de las reivindicaciones 1-32 enlazado a uno o más ligandos.
34. Una composición farmacéutica que comprende el compuesto tal como se define en cualquiera de las reivindicaciones 1-32 o el conjugado de acuerdo con la reivindicación 33, y un diluyente, vehículo o adyuvante farmacéuticamente aceptable.
35. El compuesto de acuerdo con cualquiera de las reivindicaciones 1-32 o el conjugado de acuerdo con la reivindicación 33, para usar como medicamento.
Patentes similares o relacionadas:
USO DE RIBOZIMAS EN LA DETECCIÓN DE AGENTES ADVENTICIOS, del 13 de Diciembre de 2011, de ONCOLYTICS BIOTECH, INC.: Un método para detectar la presencia de un agente adventicio en una composición que comprende un reovirus, que comprende: (a) proporcionar una población de células indicadoras […]
ORIENTACIÓN A INTERMEDIOS DE REPLICACIÓN DE HEBRA NO CODIFICANTE DE VIRUS MONOCATENARIOS POR ARNI, del 11 de Julio de 2011, de ALNYLAM PHARMACEUTICALS, INC: Un procedimiento de producción de una molécula efectora de ARN bicatenaria adecuada para uso en la inhibición de la replicación de un virus de la hepatitis C (HCV), o una […]
PROCEDIMIENTO Y COMPOSICIONES PARA REDUCIR LAS CANTIDADES DE GENOMA VIRAL DE VHC EN UNA CÉLULA DIANA, del 17 de Junio de 2011, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente inhibidor de miR122, para uso en el tratamiento de un huésped que padece una afección patológica mediada por VHC, en el que dicho agente […]
PROCEDIMIENTO PARA LA INHIBICION DE LA EXPRESION DE UN GEN DIANA Y MEDICAMENTO PARA LA TERAPIA DE UNA ENFERMEDAD TUMORAL, del 6 de Julio de 2010, de ALNYLAM EUROPE AG: Procedimiento para la inhibición de una expresión de al menos un gen diana, que inhibe o que impide la apoptosis de una célula tumoral, insertándose al menos […]
VECTORES DE ALFAVIRUS RECOMBINANTES, del 12 de Noviembre de 2009, de CHIRON CORPORATION: LA PRESENTE INVENCION PROPORCIONA CASSETTES DE EXPRESION PARA LA EXPRESION DE PROTEINAS ESTRUCTURALES DE ALFAVIRUS EN CELULAS HOSPEDADORAS, […]
MÉTODOS Y COMPOSICIONES PARA INTERFERENCIA DE RNA, del 11 de Noviembre de 2011, de COLD SPRING HARBOR LABORATORY: Un método para atenuar la expresión de un gen diana en una célula de mamífero, comprendiendo el método introducir en la célula de mamífero in vitro, […]
NANOPARTÍCULAS PARA LA ADMINISTRACIÓN DE ÁCIDO NUCLEICO, del 4 de Julio de 2011, de AARHUS UNIVERSITET: Un procedimiento para preparar una nanopartícula de quitosana/ARNip que comprende las etapas de: a. Proporcionar una solución de quitosana b. Proporcionar […]
CONSTRUCCIONES PARA LA EXPRESIÓN INDUCIBLE DE ARN DE INTERFERENCIA PEQUEÑO (ARNS) PARA EL SILENCIAMIENTO GÉNICO SELECCIONADO, del 14 de Abril de 2011, de MAX-PLANCK-GESELLSCHAFT ZUR FORDERUNG DER WISSENSCHAFTEN E.V.: Un vector recombinante para la expresión regulable de una molécula de ARN monocatenaria o bicatenaria en una célula eucariota, que comprende al menos una secuencia que […]