SISTEMAS LIQUISÓLIDOS Y PROCEDIMIENTOS DE PREPARACIÓN DE LOS MISMOS.
LOS SISTEMAS LIQUISOLIDOS CONSISTEN EN FORMAS PULVERULENTAS DE UNA FLUIDEZ Y DE UNA COMPRESIBILIDAD ACEPTABLES DE MEDICAMENTOS LIQUIDOS.
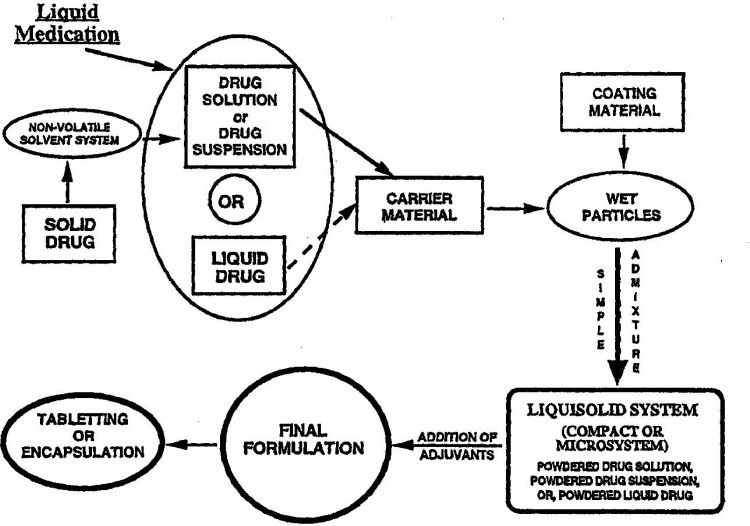
SEGUN EL CONCEPTO DE SISTEMAS LIQUISOLIDOS, SE PUEDEN CONVERTIR MEDICAMENTOS LIPOFILOS LIQUIDOS O MEDICAMENTOS HIDROINSOLUBLES, DISUELTOS EN DISOLVENTES NO VOLATILES ADECUADOS, EN POLVOS FACILMENTE COMPRESIBLES Y DE LIBRE FLUJO, MEDIANTE SIMPLE MEZCLA CON EXCIPIENTES EN POLVO SELECCIONADOS QUE SE LLAMAN MATERIAS DE SOPORTE Y MATERIAS DE REVESTIMIENTO. SE PUEDE HACER UN DIBUJO ESQUEMATICO DE LAS DISTINTAS ETAPAS DEL PROCEDIMIENTO. SE PUEDEN USAR VARIAS CATEGORIAS DE CELULOSA MICROCRISTALINA O AMORFA COMO MATERIAL DE SOPORTE, MIENTRAS QUE SE PUEDEN USAR POLVOS DE SILICIO DE PARTICULAS MUY FINAS COMO MATERIAL DE ENVOLTURA. BASANDOSE EN LA TEORIA SEGUN LA CUAL LAS MATERIAS DE SOPORTE Y DE ENVOLTURA NO PUEDEN RETENER MAS QUE CIERTA CANTIDAD DE LIQUIDO CONSERVANDO AL MISMO TIEMPO UNA COMPRESIBILIDAD Y UNA FLUIDEZ ACEPTABLES, SE HA ELABORADO UN NUEVO MODELO MATEMATICO DE FORMULACION QUE PERMITE CALCULAR LAS CANTIDADES MAXIMAS DE MATERIAS DE SOPORTE Y DE ENVOLTURA NECESARIAS PARA LA PRODUCCION DE LAS MEZCLAS DE LIQUIDO/POLVO CUYA FLUIDEZ Y COMPRESIBILIDAD SEAN ACEPTABLES
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US1997/010093.
Solicitante: Spireas, Spiridon
Bolton, Sanford M.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1536 Pebbletown Drive New Hope PA 18938.
Inventor/es: SPIREAS,SPIRIDON, Bolton,Sanford M.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Junio de 1997.
Clasificación Internacional de Patentes:
- A61K9/14H2
- A61K9/14H6
- A61K9/20P
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
Clasificación antigua:
- A61K9/64 A61K 9/00 […] › que contienen proteínas o sus derivados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Mónaco, Irlanda, Finlandia.
Fragmento de la descripción:
ANTECEDENTES DE LA INVENCIÓN
1. Campo de la invención 5
La presente invención se refiere a formas en polvo de medicamentos líquidos formulados para presentar características tanto de flujo aceptable como de compresión aceptable, y a los procedimientos de producción de los mismos.
10
DESCRIPCIÓN DE LA TÉCNICA RELACIONADA
Está bien establecido que el principio activo en una forma farmacéutica sólida debe experimentar disolución antes de que esté disponible para la absorción desde el tracto gastrointestinal. La velocidad de absorción de un fármaco moderadamente soluble en agua, formulado como una forma farmacéutica sólida administrada por 15 vía oral, está controlada por su velocidad de disolución en el fluido presente en el sitio de absorción, es decir, la velocidad de disolución es a menudo la etapa determinante de la velocidad en la absorción de fármacos. Puesto que muestran perfiles de disolución escasa y errática, la mayoría de los fármacos insolubles en agua ha sido incluida por la FDA en la lista de fármacos que presentan un alto riesgo de inequivalencia terapéutica debido a diferencias e inconsistencias en la biodisponibilidad. 20
Se han utilizado diversas técnicas para formular sistemas de administración de fármacos que potenciarían el perfil de disolución y, a su vez, la eficacia de absorción de fármacos sólidos insolubles en agua tales como digoxina, digitoxina, prednisolona, hidrocortisona, prednisona, espironolactona, hidroclorotiazida, politiazida, y/o medicamentos lipófilos líquidos tales como clofibrato, clorfeniramina, vitaminas insolubles en agua, aceite de 25 pescado, etc. La micronización de fármacos, dispersión en sólidos, coprecipitación, liofilización, microencapsulación e inclusión de disoluciones de fármacos o fármacos líquidos en cápsulas de gelatina blanda o cápsulas de cubierta dura especialmente sellada son algunas de las principales herramientas de formulación que han demostrado que potencian las características de disolución de fármacos insolubles en agua.
30
A pesar de su alto coste de producción y de ser preparaciones patentadas y avanzadas que exigen mucha tecnología, las cápsulas de gelatina blanda representan un enfoque único para la formulación de disoluciones de fármacos y/o medicamentos oleosas líquidas de fármacos sólidos insolubles en agua. En comparación con diversas formas farmacéuticas sólidas orales de digoxina, Ebert (1) ha notificado que los productos de cápsula de gelatina blanda demostraron la mayor y más constante biodisponibilidad, debido principalmente al hecho de que el fármaco 35 ya está en disolución. Nelson, en su revisión (2), señala que la disponibilidad del fármaco para su absorción a partir de diversos tipos de formulaciones orales habitualmente disminuye en el siguiente orden: disolución, suspensión, cápsula llena de polvo, comprimido comprimido, comprimido recubierto.
Una técnica más reciente, titulada "tecnología de disolución en polvo", se ha aplicado para preparar 40 fármacos insolubles en agua en formas farmacéuticas sólidas de liberación rápida. Se diseñan disoluciones en polvo para que contengan medicamentos líquidos en forma en polvo, presentado de ese modo mecanismos de administración del fármaco similares a los de preparaciones de cápsula de gelatina blanda que contienen líquidos. El concepto de disoluciones en polvo permite convertir disoluciones de fármacos o fármacos líquidos en polvos con un flujo aceptable mediante una mezcla sencilla con excipientes de polvo seleccionados (por ejemplo, celulosa y 45 sílice). Varios investigadores (3-8) han utilizado un enfoque similar para mejorar los perfiles de liberación de varios fármacos insolubles en agua.
Sin embargo, la aplicación industrial de esta técnica se ha visto dificultada por la compresibilidad y la fluidez erráticas y escasas de las mezclas de polvo/líquido producidas. Se abordaron los problemas de flujo de tales 50 sistemas mediante la introducción de un nuevo modelo teórico para los principios que subyacen a la formación de disoluciones en polvo (3, 4). Se demostró que las expresiones matemáticas desarrolladas permitían de manera satisfactoria el cálculo de las cantidades óptimas de los componentes requeridos para producir mezclas de líquido/polvo que presentan, hasta un grado deseable especificado previamente, características de flujo aceptables.
55
En los mismos estudios, se introdujo un concepto clave denominado potencial de retención de líquido fluido o valor Φ (phi) de un polvo y se definió como la cantidad máxima de líquido que la unidad de peso de un material de polvo puede retener dentro de su volumen mientras que mantiene al mismo tiempo una fluidez aceptable. Además, se determinaron los valores Φ de varios excipientes de polvo utilizando la prueba de "ángulo de deslizamiento" para evaluar las propiedades de flujo de mezclas de líquido/polvo que contienen aceite mineral ligero 60 como líquido incorporado. Se fijó el límite de fluidez aceptable a un ángulo de deslizamiento igual a 33º. Las críticas a ese trabajo se basaron en el hecho de que la prueba de "ángulo de deslizamiento" no representa necesariamente una evaluación realista de las características de flujo y que deben haberse utilizado también líquidos distintos de aceite mineral ligero para someter a prueba los polvos.
65
En proyectos posteriores (5), las formulaciones para comprimidos con un flujo aceptable de clofibrato (fármaco líquido) y prednisolona (disuelta en un sistema de disolvente no volátil), preparadas según el nuevo
modelo matemático de fluidez, presentaban de manera sistemática buenas propiedades de flujo y perfiles de disolución significativamente superiores que los de productos comerciales, incluyendo preparaciones de cápsula de gelatina blanda. Sin embargo, al evaluar los perfiles de disolución de comprimidos liquisólidos de clofibrato, se revelaron problemas de compresibilidad. Específicamente, tales formulaciones liquisólidas de clofibrato no podían comprimirse para proporcionar comprimidos de dureza satisfactoria. Mientras que se obtenían perfiles de disolución 5 superiores de tales comprimidos liquisólidos de clofibrato "blandos" en comparación con los de cápsulas de gelatina blanda comerciales, se observó también una meseta evidente de sus curvas de disolución al nivel del 80% (porcentaje acumulativo de fármaco liberado frente al tiempo). Se ha concluido que este fenómeno se producía debido a las cantidades respectivas de fármaco líquido que salían del comprimido liquisólido durante la compresión. Por tanto, aún cuando el modelo de fluidez y el concepto de valor Φ pueden garantizar características de flujo 10 aceptable de preparaciones liquisólidas, se ha comprobado que son inadecuados para producir productos que presenten, hasta un grado especificado previamente, propiedades de compresión aceptables.
Por este motivo, existe una necesidad de un procedimiento de producción a una escala industrial de mezclas de líquido/polvo de flujo aceptable y, simultáneamente, compresibles de medicamentos líquidos. 15
OBJETIVOS Y SUMARIO DE LA INVENCIÓN
Por tanto un objetivo de la presente invención consiste en proporcionar un procedimiento para garantizar la producción sistemática de mezclas de líquido/polvo compresibles y de flujo aceptable de medicamentos líquidos. 20
Un objetivo de la presente invención consiste asimismo en proporcionar un medio de optimización de las cantidades de excipientes requeridas para producir tales mezclas de líquido/polvo compresibles y de flujo libre.
La presente invención se refiere por tanto a un procedimiento de conversión de un medicamento líquido en 25 un sistema liquisólido, en el que el medicamento líquido se incorpora en una cantidad específica de material de portador, y la mezcla húmeda resultante se combina con una cantidad calculada de material de recubrimiento para producir una mezcla de líquido/polvo "seca" (es decir, de aspecto seco), no adherente, que presenta características de flujo aceptable y, simultáneamente, de compresión aceptable.
30
Se proporciona un nuevo modelo matemático de...
Reivindicaciones:
1. Procedimiento de producción de una mezcla de líquido/polvo que puede fluir y fácilmente compresible de un medicamento líquido, que implica convertir el medicamento líquido en un sistema liquisólido, que comprende las etapas siguientes
5
(a) seleccionar un peso (W) del medicamento líquido que va a incluirse en un único producto compacto liquisólido;
(b) seleccionar un material de portador y un material de recubrimiento que van a incluirse en el sistema liquisólido; 10
(c) determinar la razón portador:recubrimiento mínima característica, Rmin y potenciales de retención de líquido fluido de los materiales de portador (Φ) y de revestimiento (ø) utilizando una prueba de fluidez de liquisólido;
15
(d) determinar los potenciales de retención de líquido compresible característicos de los materiales de portador (Ψ) y de recubrimiento (ψ) utilizando una prueba de compresibilidad de liquisólido,
(e) seleccionar una razón de portador:recubrimiento, R, en la que R > Rmin de los materiales de portador y de recubrimiento que van a incluirse en el sistema liquisólido, en la que R = Q/q, Q = el peso del 20 material de portador, y q = el peso del material de recubrimiento;
(f) calcular el factor de carga de líquido óptimo (Lo) del sistema según las ecuaciones:
Lo = ΦL£ cuando ΦL£ < ΨL£ o 25
Lo = ΨL£ cuando ΦL£ > ΨL£
en las que
ΦL£ = Φ + ø (1/R) 30
y
ΨL£ = ψ + Ψ (1/R);
35
(g) calcular las cantidades óptimas de los materiales de portador (Qo) y de recubrimiento (qo) según las ecuaciones:
Qo = W/Lo
qo = Qo/R 40
(h) mezclar el medicamento líquido con la cantidad calculada de material de portador (Qo); y
(i) combinar la mezcla húmeda resultante con la cantidad calculada de material de recubrimiento (qo) para producir una mezcla de líquido/polvo compresible, que puede fluir, no adherente, de aspecto 45 seco, en el que la prueba de fluidez de liquisólido de las etapas (c) comprende:
(a1) preparar varios sistemas de polvo conteniendo cada uno un material de portador y un material de recubrimiento y seleccionar para cada sistema una razón portador:recubrimiento,
R1···x, 50
en la que 1···x corresponde a los sistemas de polvo preparados,
R1···x = Q1....x/q1....x
55
Q1....x = el peso del material de portador, y
q1....x = el peso del material de recubrimiento,
(b1) preparar varias mezclas de líquido/polvo uniformes de diferentes composiciones en peso de 60 líquido/sólido (Cw) combinando uno de los sistemas de polvo preparados en la etapa (a) con cantidades crecientes del disolvente no volátil incluido en el medicamento líquido, que es una disolución de fármaco o una suspensión de fármaco, comprendiendo cada una un fármaco insoluble en agua en un disolvente no volátil, o un fármaco líquido que es un medicamento lipófilo líquido; 65
(c1) evaluar la velocidad de flujo y la consistencia de las mezclas así obtenidas utilizando un medidor de flujo de polvo, de registro, y determinar a partir de esta evaluación el factor de carga de líquido fluido (ΦL£) del sistema de polvo que se ajusta a un límite preseleccionado de fluidez aceptable, en el que ΦL£ = W/Q, W = el peso del líquido y Q = el peso del material de portador; 5
(d1) repetir las etapas (b) y (c) para los sistemas de polvo restantes de la etapa (a) para determinar los factores de carga de líquido fluido de estos sistemas; y
(e1) representar gráficamente los factores de carga de líquido fluido (øL£) así obtenidos frente a la 10 inversa de las razones de portador:recubrimiento correspondientes (1/R) de los sistemas de polvo,
obteniendo así un gráfico lineal que presenta una ordenada en el origen Y igual al potencial de retención de líquido fluido del material de portador (Φ) y una pendiente igual al potencial de 15 retención de líquido fluido del material de recubrimiento (ø), y la prueba de compresibilidad de liquisólido (d) comprende:
(a2) preparar varios sistemas de polvo conteniendo cada uno un material de portador y un material de recubrimiento y seleccionar para cada sistema una razón de portador:recubrimiento, R1....x, 20
en la que 1....x corresponde a los sistemas de polvo preparados,
R1···x = Q1....x/q1....x
Q1....x = el peso del material de portador, y 25
q1....x = el peso del material de recubrimiento,
(b2) preparar varias mezclas de líquido/polvo uniformes de diferentes composiciones en peso de líquido/sólido combinando uno de los sistemas de polvo preparados en la etapa (a2) con cantidades crecientes del disolvente no volátil incluido en el medicamento líquido, que es una 30 disolución de fármaco o una suspensión de fármaco, comprendiendo cada una un fármaco insoluble en agua en un disolvente no volátil, o un fármaco líquido que es un medicamento lipófilo líquido;
(c2) comprimir cada mezcla de líquido/polvo así obtenida en comprimidos de cierto peso utilizando 35 una fuerza de compresión meseta para conseguir una resistencia al aplastamiento de comprimido máxima;
(d2) evaluar la resistencia al aplastamiento de comprimido promedio, Sc, de los comprimidos producidos y calcular su plasticidad, Ω, en el que Ω= Sc/Wt y Wt = el peso de comprimido 40 promedio en gramos;
(e2) determinar el contenido en líquido promedio de los comprimidos aplastados y calcular la composición en peso de líquido/sólido neta (Cw) de la mezcla de líquido/polvo aplastada;
45
(f2) determinar la plasticidad intrínseca característica, Ωo, y el índice de esponjosidad 1, del sistema de polvo representando gráficamente los datos obtenidos como log frente a Cw en el que log Ω= log Ωo - 1- Cw;
(g2) determinar el Ψmix del sistema de polvo, en el que Ψmix = (log Ωo - log 20)/1; 50
(h2) determinar el factor de carga de líquido compresible (ΨL£) del sistema de polvo, en el que ΨL£ = Ψmix (1 + 1/R);
(i2) repetir las etapas (b) a (h) para los sistemas de polvo restantes de la etapa (a) para determinar 55 sus factores de carga de líquido compresible; y
(j2) representar gráficamente los factores de carga de líquido compresible así obtenidos frente a la inversa de las razones de portador:recubrimiento correspondientes (1/R) de los sistemas de polvo, obteniendo así un gráfico lineal que presenta una ordenada en el origen Y igual al 60 potencial de retención de líquido compresible del material de portador (ψ) y una pendiente igual al potencial de retención de líquido compresible del material de recubrimiento (Ψ).
2. Procedimiento según la reivindicación 1, en el que se incluye un aditivo en el medicamento líquido dando como resultado un microsistema liquisólido. 65
3. Procedimiento según la reivindicación 1, que comprende además la etapa que consiste en mezclar la mezcla de líquido/polvo con una cantidad de lubricante eficaz para la compresión o la encapsulación de la mezcla de líquido/polvo.
4. Procedimiento según la reivindicación 3, que comprende además la etapa que consiste en añadir a la 5 mezcla de líquido/polvo una cantidad de disgregante eficaz para producir productos compactos o microsistemas liquisólidos que presentan unas propiedades de liberación de fármaco rápida.
5. Procedimiento según la reivindicación 3, que comprende además la etapa que consiste en añadir a la mezcla de líquido/polvo una cantidad de aglutinante eficaz para producir productos compactos o microsistemas 10 liquisólidos que presentan unas propiedades de liberación de fármaco sostenida.
6. Procedimiento según la reivindicación 2, en el que el medicamento líquido es una disolución de fármaco, una suspensión de fármaco o un fármaco líquido en combinación con polivinilpirrolidona.
15
7. Procedimiento según la reivindicación 4 ó 5, en el que los productos compactos liquisólidos son comprimidos o cápsulas.
8. Procedimiento según la reivindicación 1, en el que el material de portador comprende un material poroso que presenta unas propiedades de absorción suficientes para permitir la absorción del medicamento líquido 20 en el material de portador.
9. Procedimiento según la reivindicación 8, en el que el material de portador es la celulosa microcristalina o la celulosa amorfa.
25
10. Procedimiento según la reivindicación 1, en el que el material de recubrimiento comprende un material que presenta un tamaño de partícula fino en el intervalo de aproximadamente 10 nm a 5.000 nm y que presenta unas propiedades de adsorción suficientes para permitir la adsorción del material de recubrimiento en la mezcla húmeda, convirtiendo así la mezcla húmeda en la mezcla de líquido/polvo compresible, fluida, no adherente y de aspecto seco. 30
11. Procedimiento según la reivindicación 10, en el que el material de recubrimiento es un dióxido de silicio amorfo.
Patentes similares o relacionadas:
PROTEÍNAS DEPOSITADAS SOBRE PARTÍCULAS BIOCOMPATIBLES POCO SOLUBLES PARA LA LIBERACIÓN CONTROLADA DE PROTEÍNAS HACIA UN ENTORNO BIOLÓGICO DESDE UNA MATRIZ POLIMÉRICA, del 14 de Febrero de 2012, de PROTHERICS SALT LAKE CITY, INC: Un sistema de transporte de fármacos para la liberación controlada de proteínas hacia un entorno biológico, que comprende: a) una partícula […]
COMPOSICIONES, MÉTODOS Y KITS ÚTILES PARA ALIVIAR LOS EFECTOS SECUNDARIOS GASTROINTESTINALES DE LOS INHIBIDORES DE LIPASA, del 9 de Febrero de 2012, de THE PROCTER & GAMBLE COMPANY: Una composición que comprende: a) estearato cálcico; y b)un inhibidor de lipasa; en donde la relación de estearato cálcico a inhibidor de […]
COMPOSICIÓN PULVERULENTA CAPAZ DE FLUIR, QUE CONTIENE (DERIVADOS DE) ÁCIDO A-LIPÓNICO, del 26 de Mayo de 2011, de ALZCHEM TROSTBERG GMBH: Composición pulverulenta, capaz de fluir, caracterizada porque ella se compone de ácido α-lipónico racémico, ácido dihidrolipónico, […]
FORMULACIÓN DE SOLUBILIZACIÓN RÁPIDA DE FÁRMACOS ANTIINFLAMATORIOS NO ESTEROIDEOS, del 8 de Marzo de 2011, de LOSAN PHARMA GMBH: Un procedimiento para producir una forma soluble en agua de un fármaco antiinflamatorio no esteroideo (AINE) que contiene al menos un grupo carboxílico y que comprende […]
 MICROEMULSIONES COMO FORMAS FARMACEUTICAS SOLIDAS PARA LA ADMINISTRACION ORAL, del 21 de Junio de 2010, de CIMA LABS INC.: Una composición en microemulsión en forma de un polvo compresible que fluye libremente, que comprende:
una mezcla de una microemulsión que contiene fármaco y […]
MICROEMULSIONES COMO FORMAS FARMACEUTICAS SOLIDAS PARA LA ADMINISTRACION ORAL, del 21 de Junio de 2010, de CIMA LABS INC.: Una composición en microemulsión en forma de un polvo compresible que fluye libremente, que comprende:
una mezcla de una microemulsión que contiene fármaco y […]
FORMULACIONES PARA ETERES DE BENCIMIDAZOLIL PIRIDILO, del 7 de Junio de 2010, de NOVARTIS AG: Una formulación, que comprende: un compuesto de la Fórmula I, una sal farmacéuticamente aceptable del mismo, o una mezcla de cualquiera de dos o más de los mismos; y un ingrediente […]
DISOLUCIONES SOLIDAS SOBRESATURADAS ESTABILIZADAS DE FARMACOS ESTEROIDEOS, del 29 de Enero de 2010, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: Una composición en polvo que comprende una molécula esteroidea y sílice amorfa que tiene una superficie específica de al menos 250 m 2 /g; en la que la molécula esteroidea […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE UNA FORMA DE DOSIFICACIÓN SÓLIDA A PRUEBA DE ABUSO, del 10 de Noviembre de 2011, de GRUNENTHAL GMBH: Procedimiento para la preparación de una forma de dosificación sólida a prueba de abuso que contiene al menos un principio activo susceptible de abuso […]