VARIANTES DE LA MOLECULA GP130 SOLUBLES UTILES COMO MEDICAMENTO.
Polipéptido-dímero de dos fragmentos monoméricos, en el que los fragmentos monoméricos comprenden (a) los dominios 1 a 3 (D1 a D3) de la parte extracelular de la glicoproteína (gp) 130 pero no contienen dominios adicionales (D4 a D6) de sgp130 y (b) en sus extremos C-terminal un espaciador polipéptido que posee una longitud de 5 a 30 aminoácidos,
en el que ambos fragmentos monoméricos están unidos covalentemente entre sí, en el que la longitud del espaciador determina la unión óptima de la proteína dimérica resultante al complejo IL-6/receptor de IL-6 soluble y en el que dicho polipéptido-dímero muestra un potencial significativamente reducido de formar agregados homoméricos y fragmentos de moléculas y en el que se obtiene una productividad significativamente incrementada en células huésped
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/012515.
Solicitante: CONARIS RESEARCH INSTITUTE AG.
Nacionalidad solicitante: Alemania.
Dirección: SCHAUENBURGERSTRASSE 116, 24118 KIEL.
Inventor/es: WATZIG,GEORG,H, SEEGERT,DIRK.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K14/715F
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K14/715 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para citoquinas; para linfoquinas; para interferones.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N1/15 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/10 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
Fragmento de la descripción:
Se describe un polipéptido-dímero formado por dos fragmentos monoméricos idénticos que comprende los dominios 1 a 3 de la parte extracelular (soluble) de la glicoproteína (gp) 130 y un espaciador polipéptido concreto, unidos covalentemente entre sí, y que supone ventajas significativas respecto a su tasa de producción en células huésped, su purificación mejorada y su potencial para unirse a complejos IL-6/receptor IL-6 soluble. Además, se describe
una composición farmacéutica que contiene dicha molécula dimérica y diversos usos médicos. La citoquina pleiotrópica interleuquina-6 (IL-6)muestra un amplio espectro de funciones biológicas entre las cuales las más notables son la estimulación de las células B y T, el control de los procesos inmunitarios adquiridos e innatos y la inducción de la síntesis de proteínas de fase aguda en el hígado. La IL-6 ejerce su actividad a través de un receptor IL-6 unido a membrana o soluble (“IL-6R” o “gp80”) el cual tras la unión induce la dimerización de la gp130 para desencadenar respuestas celulares.
Dado que el domino citoplasmático de IL-6R carece de actividad quinasa, la señalización por el homodímero gp130 puede ser inducida por la IL-6 unida al IL-6R unido a membrana o soluble. Mientras que gp130 puede hallarse en prácticamente todos los tipos celulares, la expresión de
IL-6R está restringida a los hepatocitos y leucocitos. Sin embargo, las células pueden ser activadas por IL-6 a través de sIL-6R el cual es liberado desde las células que expresan IL-6R ya sea mediante escisión proteolítica o mediante corte y empalme (splicing) alternativo. Este mecanismo se denomina trans-señalización. De hecho, se ha demostrado que diversas
actividades celulares son dependientes del complejo de sIL-6R más IL-6 y no son inducibles por la IL-6 sola. La trans-señalización juega un papel clave en la transición de las respuestas inmunitarias innatas a las adquiridas y es crucial para el aclaramiento de losinfiltrados neutrofílicos y el reclutamiento y activación de células T y B para una respuesta inmunitaria mantenida. La alteración de la regulación de este mecanismo conlleva el desarrollo y persistencia de enfermedades alérgicas inflamatorias y/o crónicas tales como la enfermedad de Crohn, la artritis reumatoide, el asma y otras.
Para el tratamiento de estas enfermedades, se ha demostrado que el bloqueo específico de los procesos mediados por IL-6 es terapéuticamente efectivo. Desafortunadamente, todos los compuestos disponibles en la actualidad para este fin hasta el momento tienen el problema de provocar efectos secundarios graves en parte (por ejemplo infecciones secundarias, tuberculosis, sepsis), toxicidad o inmunogenicidad. Adicionalmente, también se han observado dificultades indisolubles durante el desarrollo de un procedimiento de purificación útil y económico.
La solución de estos problemas técnicos se consigue
mediante las realizaciones caracterizadas en las
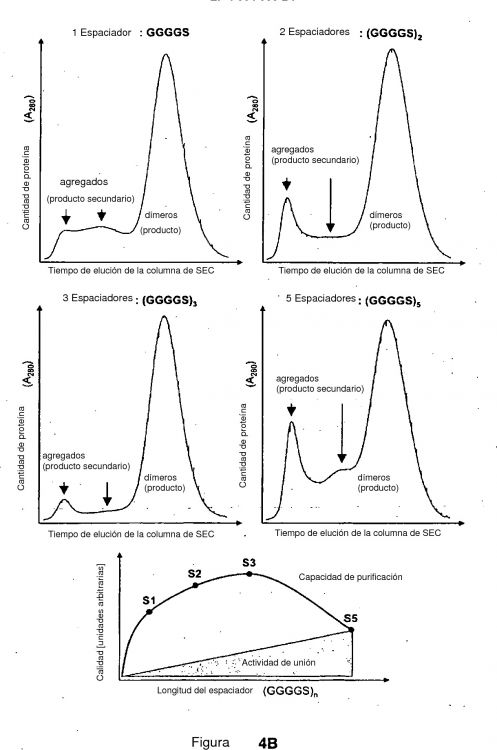
reivindicaciones. En el transcurso de los experimentos que han dado lugar a la presente invención, se observó que la purificación del compuesto original sgp130F que comprende dos moléculas de la parte extracelular completa de gp130 era insatisfactoria. Esta proteína de fusión, si se expresa en células eucariotas CHO tiende a formar productos secundarios indeseables tales como ciertos fragmentos más pequeños, oligómeros y agregados en combinaciones diversas. No fue posible hallar ningún tipo de método de purificación que fuera adecuado para separar el compuesto diana de estas impurezas en cantidades adecuadas debido a las propiedades físicas y químicas muy similares entre las impurezas y el
producto de interés. Entre los métodos analizados se incluyeron diferentes cromatografías de afinidad, de exclusión de tamaño y de intercambio iónico, estrategiaspara cambiar la solubilidad de la proteína mediante suplementación iónica o cambios en el pH y otros. Ninguno de estos métodos dio resultados satisfactorios o fue adecuado para ser realizado a mayor escala para desarrollar un proceso de purificación que cumpliera con las buenas prácticas de fabricación (GMP). Por el contrario, se observó que una variante más corta de la molécula original sgp130Fc, denominada sgp130(D1-3)Fc, que carece de los dominios extracelulares 4 a 6 era separable de los productos secundarios contaminantes. Ello indicaba que los elementos formadores de agregados con los dominios de fibronectina III (dominios 4 a 6) de la molécula original sgp130Fc se habían eliminado con éxito. Además, esta molécula se expresó por
células eucariotas a niveles considerablemente más elevados.
En la siguiente etapa se optimizó la eficiencia de unión a IL-6/sIL-6R de la nueva molécula sgp130(D1-3)Fc mediante la fusión de espaciadores polipéptidos de diferente longitud entre sgp130(D1-3) y la parte IgG-Fc. La capacidad de unión de las moléculas resultantes se determinó mediante ensayos de enzimoinmunoanálisis (ELISA) específicos y se comparó con la molécula original sgp130Fc (Figura 5).
Se ha demostrado que la unión de los complejos IL-6/sIL-6R inhibe el efecto anti-apoptótico de IL-6 sobre los monolitos en pacientes con enfermedad de Crohn indicando que dicho compuesto es útil para el tratamiento de dicha enfermedad y de enfermedades relacionadas tales como la colitis, la artritis reumatoide, la psoriasis, la peritonitis y otras.
La enfermedad de Crohn es una enfermedad inflamatoria crónica de todo el tracto gastrointestinal caracterizada por recidivas frecuentes de inflamación aguda. La inflamación asociada con infección, lesión y otros factores induce rápidamente una reacción de fase aguda (APR) acompañada de la expresión de proteínas de fase aguda (APPs). La APR provoca principalmente un aumento de la permeabilidad vascular y fiebre. Los miembros de la familia de la IL-6 incrementan la expresión de los genes APP de tipo II que está mediada por la (STAT3). La potente activación de STAT3 (es decir fosforilación de tirosina) se ha descrito en tejido de colon de pacientes con enfermedades intestinales inflamatorias (IBD). Además, se ha observado una disminución
- /
de la actividad STAT3 en ratones IL-6 asociada a una
disminución del desarrollo de colitis de ratón experimental
(Suzuki y otros, J. Exp. Med 2001, 193:471). Esto experimentos indican que la activación de STAT3 mediada por IL-6/sIL-6R juega un papel clave en el desarrollo y perpetuación de la colitis. En otro modelo inflamatorio, la artritis reumatoide (RA), se ha demostrado que STAT3 es importante para la supervivencia de los fibroblastos sinoviales de la RA (Krause y otros, J. Immunol, 2002, 169:6610). Por ello se ha sugerido que STAT3 puede ser una buena diana para la terapia génica. También se conoce que la activación constitucional de STAT3 es un factor “causante de cáncer” y se acompaña de un incremento de proteínas anti-apoptóticas como Bcl-2 y Bcl-XL (Turkson y otros, Oncogene, 2000, 19:6613).
Se ha observado que la activación de STAT3 mediada por IL-6/sIL-6R es reducida significativamente por sgp130(D1-3)Fc con un nivel de eficacia comparable al del compuesto original sgp130Fc. Además, sgp130(D1-3)Fc (sgp130Var) se expresa en células eucariotas en cantidades más elevadas que sgp130Fc, genera menos productos secundarios no deseados y es separable de las impurezas residuales mediante cromatografía en columna estándar. Estas ventajas mejoran de forma significativa el desarrollo de procedimientos de producción acordes con las GMP y disminuye el coste de los productos.
Breve descripción de los dibujos
Figura 1: Dibujo esquemático de las moléculas
sgp130(D1-D3)Sn
Las variantes sgp130(D1-D3)Sn se generaron mediante deleción de los dominios D4 a D6 de la molécula original
sgp130Fc y su substitución por un espaciador polipéptido de longitud diversa (Sn). La “n” indica el número de repeticiones dentro de la región del espaciador. A continuación la molécula se dimeriza covalentemente ya sea mediante un fragmento IgG-Fc (panel superior) para construir sgp130(D1-D3)Sn-Fc o (panel inferior) mediante fusión adicional con un elemento conector artificial o natural que confiere uniones covalentes, por ejemplo mediante la formación de puentes disulfuro, interacciones químicas u otros (sgp130(D1-D3)Sn-L). Además, estas moléculas pueden contener etiquetas para la purificación...
Reivindicaciones:
1. Polipéptido-dímero de dos fragmentos monoméricos, en el que los fragmentos monoméricos comprenden (a) los dominios 1 a 3 (D1 a D3) de la parte extracelular de la glicoproteína (gp) 130 pero no contienen dominios adicionales (D4 a D6) de sgp130 y (b) en sus extremos C-terminal un espaciador polipéptido que posee una longitud de 5 a 30 aminoácidos, en el que ambos fragmentos monoméricos están unidos covalentemente entre sí, en el que la longitud del espaciador determina la unión óptima de la proteína dimérica resultante al complejo IL-6/receptor de IL-6 soluble y en el que dicho polipéptido-dímero muestra un potencial significativamente reducido de formar agregados homoméricos y fragmentos de moléculas y en el que se obtiene una productividad significativamente incrementada en células huésped.
2. Polipéptido-dímero, según la reivindicación 1, en el que los dos fragmentos monoméricos son idénticos.
3. Polipéptido-dímero, según la reivindicación 1 o 2, en el que la dimerización covalente de ambos monómeros se obtiene mediante uno o más puentes disulfuro.
4. Polipéptido-dímero, según la reivindicación 3, en el que el o los puentes disulfuro se generan mediante la fusión de los fragmentos monoméricos a una molécula IgG-Fc.
5. Polipéptido-dímero, según la reivindicación 3, en el que el o los puentes disulfuro se generan mediante la
- 41 –
6. Polipéptido-dímero, según la reivindicación 1 o 2, en el que la dimerización covalente de ambos monómeros se obtiene mediante cualquier otro tipo de unión química o física.
7. Polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 6, en el que el espaciador polipéptido está glicosilado selectivamente para proteger la molécula de la escisión proteolítica.
8. Polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 7, en el que el espaciador polipéptido posee una longitud de 10 a 25 aminoácidos.
9. Polipéptido-dímero, según la reivindicación 8, en el que el espaciador polipéptido posee una longitud de 15 a 25 aminoácidos.
10. Polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 9, en el que el espaciador posee la secuencia de aminoácidos (GGGGS)n siendo n 1, 2, 3, 4, 5 o fusión de los fragmentos monoméricos a un polipéptido natural o artificial, que comprende uno o más residuos cisteína libremente accesibles.
6.
11. Polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 10, que forma menos de un 50% de agregados homoméricos y fragmentos de moléculas.
12. Polipéptido-dímero, según la reivindicación 11, que forma menos de un 25% de agregados homoméricos y fragmentos de moléculas.
13. Polipéptido-dímero, según la reivindicación 12, que forma menos de un 10% de agregados homoméricos y fragmentos de moléculas.
- 42 –
14. Polipéptido-dímero, según la reivindicación 13, que forma menos de un 5% de agregados homoméricos y fragmentos de moléculas.
15. Polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 14, en el que los monómeros comprenden la secuencia de aminoácidos mostrada en la figura 8.
16. Polinucleótido que codifica un polipéptido, según cualquiera de las reivindicaciones 1 a 15.
17. Polinucleótido, según la reivindicación 16, en el que la secuencia del polinucleótido está optimizada en codones para la producción de la proteína codifica en células huésped eucariotas, bacterias, levaduras o células de insecto.
18. Polinucleótido, según las reivindicaciones 16 o 17, que comprende la secuencia de ácidos nucleicos mostrada en la figura 7.
19. Vector de expresión que contiene un polinucleótido, según cualquiera de las reivindicaciones 16 a 18.
20. Célula huésped que contiene un vector de expresión, según la reivindicación 19.
21. Método para la producción de un polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 15, que comprende cultivar una célula huésped según la reivindicación 20, recuperar el polipéptido-monómero o dímero de dicha célula huésped o del medio de cultivo y su purificación.
22. Composición farmacéutica que contiene un polipéptido-dímero, según cualquiera de las reivindicaciones
1 a 15 o un polinucleótido, según cualquiera de las reivindicaciones 16 a 18.
23. Utilización de un polipéptido-dímero, según cualquiera de las reivindicaciones 1 a 15 o de un 5 polinucleótido, según cualquiera de las reivindicaciones 16 a 18, para la preparación de una composición farmacéutica para el tratamiento o prevención de la resorción ósea, la hipercalcemia, la caquexia, un tumor, el cáncer, una enfermedad autoinmune, una enfermedad inflamatoria, o una
10 infección bacteriana o viral.
Patentes similares o relacionadas:
DOMINIOS SUSHI DE IL-15RALFA COMO POTENCIADORES SELECTIVOS Y EFICACES DE LA ACCIÓN DE IL-15 A TRAVÉS DE IL-15RBETA/GAMMA, EN LAS PROTEÍNAS DE FUSIÓN HIPERAGONISTAS IL15RALFA SUSHI-IL 15, del 14 de Febrero de 2012, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Compuesto, para estimular la via de senalización de IL-15Rbeta/gamma, para inducir con ello y/o estimular la activación y/o la proliferación […]
RECEPTOR DE CITOQUINA HUMANA, del 24 de Agosto de 2011, de ZYMOGENETICS, INC.: Uso de un polipéptido Zcytor14 soluble para la fabricación de un medicamento para el tratamiento de la inflamación; en el que dicho polipéptido soluble comprende una secuencia […]
PROCEDIMIENTOS PARA DETECTAR O MODULAR LA INTERACCIÓN DE UN RECEPTOR DE CITOCINA CON SU LIGANDO, del 6 de Abril de 2011, de ZYMOGENETICS, L.L.C. BRISTOL-MYERS SQUIBB COMPANY: Un procedimiento in vitro para detectar un ligando en una muestra, en el que el ligando comprende un polipéptido seleccionado del grupo que consiste en: (a) los restos de aminoácidos […]
 ANTICUERPO ANTI-INTERLEUCINA-9 O ANTICUERPO DEL RECEPTOR ANTI-INTERLEUCINA-9 PARA EL TRATAMIENTO DE LA HIPERREACTIVIDAD BRONQUIAL, del 14 de Marzo de 2011, de LIGAND PHARMACEUTICALS INCORPORATED: Utilización de un anticuerpo que es un anticuerpo anti-interleucina-9 o un anticuerpo del receptor de anti-interleucina-9 que bloquea la unión de la interleucina-9 al receptor […]
ANTICUERPO ANTI-INTERLEUCINA-9 O ANTICUERPO DEL RECEPTOR ANTI-INTERLEUCINA-9 PARA EL TRATAMIENTO DE LA HIPERREACTIVIDAD BRONQUIAL, del 14 de Marzo de 2011, de LIGAND PHARMACEUTICALS INCORPORATED: Utilización de un anticuerpo que es un anticuerpo anti-interleucina-9 o un anticuerpo del receptor de anti-interleucina-9 que bloquea la unión de la interleucina-9 al receptor […]
DÍMEROS DE SGP 130FC MEJORADOS, del 21 de Febrero de 2011, de CONARIS RESEARCH INSTITUTE AG: Un dímero polipeptídico capaz de inhibir la actividad del complejo agonista IL-6/sIL-6R y que comprende dos monómeros, en el cada uno de dichos monómeros […]
 Biological variability of asthma associated factor, AAF2 (IL-9 receptor), useful in treating and diagnosing atopic allergies including asthma and related disorders, del 26 de Noviembre de 2010, de LIGAND PHARMACEUTICALS INCORPORATED: Ácido nucleico aislado que codifica el receptor de la interleucina-9 (IL-9) humana seleccionado de entre el grupo consistente en ácido nucleico aislado […]
Biological variability of asthma associated factor, AAF2 (IL-9 receptor), useful in treating and diagnosing atopic allergies including asthma and related disorders, del 26 de Noviembre de 2010, de LIGAND PHARMACEUTICALS INCORPORATED: Ácido nucleico aislado que codifica el receptor de la interleucina-9 (IL-9) humana seleccionado de entre el grupo consistente en ácido nucleico aislado […]
IL-17RCX4 SOLUBLE Y PROCEDIMIENTO DE UTILIZACION EN LA INFLAMACION, del 4 de Noviembre de 2010, de ZYMOGENETICS, INC.: Un polipéptido receptor soluble aislado que comprende una secuencia de aminoácidos como la mostrada en los restos 21 a 467 de la SEC ID Nº […]
ANTICUERPOS DIRIGIDOS CONTRA IL-22RA Y ASOCIADOS DE UNION Y PROCEDIMIENTO DE USO EN INFLAMACION, del 3 de Noviembre de 2010, de ZYMOGENETICS, INC.: Un procedimiento de producción de un anticuerpo de un polipéptido en un animal no humano, en el que el polipéptido inoculado se selecciona del grupo […]