MÉTODOS PARA ANALIZAR ISÓMEROS DE DISULFURO DE ANTICUERPOS.
Un método de análisis para la caracterización y la cuantificación de isómeros de disulfuro de fragmentos de anticuerpo que comprenden las etapas de:
(a) pretratar el fragmento de anticuerpo con un disolvente orgánico, (b) digerir el fragmento de anticuerpo pretratado con una proteasa en presencia de un disolvente orgánico y (c) analizar los fragmentos de la digestión con proteasa
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/008608.
Solicitante: UCB PHARMA, S.A..
Nacionalidad solicitante: Bélgica.
Dirección: ALLÉE DE LA RECHERCHE 60 1070 BRUSSELS BELGICA.
Inventor/es: BILD, GARY, S., MOZIER,Ned,M, DUFIELD,Robert,L, MO,Jianming.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Marzo de 2003.
Clasificación Internacional de Patentes:
- C07K16/24B
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
- C12P21/08 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/24 C07K 16/00 […] › contra citoquinas, linfoquinas o interferones.
- C12P21/08 C12P 21/00 […] › Anticuerpos monoclonales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358505_T3.pdf




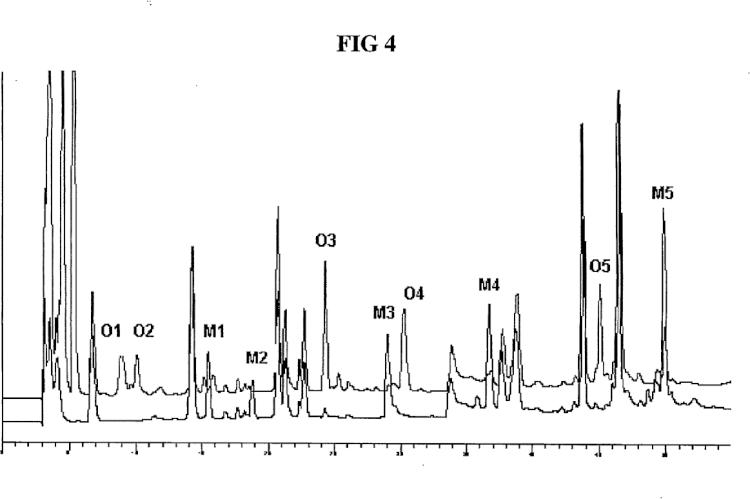
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a isómeros de disulfuro de proteínas recombinantes y a métodos analíticos para detectar los isómeros de disulfuro y formas oxidadas de metionilo de los anticuerpos. Más específicamente, se refiere a isómeros de disulfuro de un anticuerpo que tiene especificidad hacia determinantes antigénicos del factor de necrosis tumoral alfa humano (TNFα). La presente invención también se refiere a métodos analíticos para detectar los isómeros de disulfuro del anticuerpo de TNFα y formas oxidadas de metionilo de los anticuerpos de TNFα. La presente invención también se refiere a composiciones que comprenden los isómeros y a usos terapéuticos del anticuerpo.
Antecedentes de la invención
En una molécula de anticuerpo, hay dos cadenas pesadas y dos cadenas ligeras. Cada cadena pesada y cada cadena ligera tienen en su extremo N-terminal un dominio variable. Cada dominio variable está compuesto por cuatro regiones estructurales (FRs) que se alternan con tres regiones determinantes de la complementariedad (CDRs). Los residuos en los dominios variables están numerados convencionalmente según un sistema ideado por Kabat y otros. Este sistema se describe en Kabat y otros, 1987, en “Sequences of Proteins of Immunological Interest”, Departamento de Salud y de Servicios Humanos de EE.UU., NIH, EE.UU. (de aquí en adelante, “Kabat y otros (supra)”). Este sistema de numeración se emplea en la presente memoria descriptiva, a no ser que se indique de otro modo.
Las designaciones de los residuos según Kabat no se corresponden siempre directamente con la numeración lineal de los residuos de aminoácidos. La secuencia de aminoácidos lineal real puede contener menos aminoácidos o aminoácidos adicionales que, en la numeración estricta de Kabat, se corresponden con un acortamiento o a una inserción de un componente estructural, tanto estructural como CDR, de la estructura básica del dominio variable. La numeración correcta de Kabat de los residuos se puede determinar para un anticuerpo dado, mediante la alineación de residuos de homología en la secuencia del anticuerpo, con una secuencia numerada de Kabat “convencional”.
Las CDRs del dominio variable de la cadena pesada están localizadas en los residuos 31-35 (CDRH1), los residuos 50-65 (CDRH2) y los residuos 95-102 (CDRH3), según la numeración de Kabat.
Las CDRs del dominio variable de la cadena ligera están localizadas en los residuos 24-34 (CDRL1), los residuos 50-56 (CDRL2) y los residuos 89-97 (CDRL3), según la numeración de Kabat.
La construcción de anticuerpos injertados con CDR se describe en el documento de solicitud de patente europea EP-A-0239400, que describe un procedimiento en el cual las CDRs de un anticuerpo monoclonal de ratón se injertan en las regiones estructurales de los dominios variables de una inmunoglobulina humana, mediante mutagénesis dirigida al sitio, usando oligonucleótidos largos. Las CDRs determinan la especificidad de la unión con el antígeno de los anticuerpos y son secuencias peptídicas relativamente cortas que se encuentran en las regiones estructurales de los dominios variables.
El primer trabajo sobre anticuerpos monoclonales humanizados mediante el injerto de CDRs, se realizó con anticuerpos monoclonales que reconocían antígenos sintéticos, tales como NP.
Sin embargo, ejemplos en los cuales un anticuerpo monoclonal de ratón que reconoce la lisozima y un anticuerpo monoclonal de rata que reconoce un antígeno en los linfocitos T humanos, que se humanizaron mediante el injerto de CDRs, han sido descritos por Verhoeyen y otros (Science, 239,1534-1536, 1988) y Riechmann y otros (Nature, 332, 323-324, 1988), respectivamente.
Riechmann y otros observaron que la transferencia solo de las CDRs (tal y como las definió Kabat (Kabat y otros (supra) y Wu y otros, J. Exp. Med., 132, 211-250, 1970)) no era suficiente para proporcionar una actividad satisfactoria de unión al antígeno en el producto injertado con CDR. Se observó que una cantidad de residuos estructurales se tienen que alterar de modo que se correspondan a los de la región estructural del donante. Los criterios propuestos para seleccionar qué residuos estructurales se tienen que alterar, se describen en el documento de Solicitud de Patente Internacional WO 90/07861.
Se ha publicado una variedad de revisiones que tratan sobre anticuerpos con injertos de CDRs, que incluyen a Vaughan y otros (Nature Biotechnology, 16, 535-539, 1998).
El TNFα es una citocina proinflamatoria que se libera e interacciona con células del sistema inmunitario. Así, el TNFα es liberado por macrófagos que se han activado con lipopolisacáridos (LPS) de bacterias gran negativas. Como tal, el TNFα parece ser un mediador endógeno de gran importancia, implicado en el desarrollo y la patogénesis del choque endotóxico asociado con septicemia bacteriana. El TNFα también se ha observado que tiene una expresión incrementada en una variedad de enfermedades humanas, que incluyen enfermedades crónicas, tales como artritis reumatoide, enfermedad de Crohn, colitis ulcerativa y esclerosis múltiple. Ratones transgénicos para TNFα humano producen niveles elevados de TNFα de forma constitutiva y desarrollan una poliartritis destructiva espontánea que se asemeja a la artritis reumatoide (Kaffer y otros, EMBO J., 10, 4025-4031,1991). Por lo tanto, se hace referencia al TNFα como una citocina proinflamatoria.
Los anticuerpos monoclonales contra TNFα se han descrito en la técnica anterior. Meager y otros, (Hybridoma, 6,305-311, 1987) describen anticuerpos monoclonales de múrido contra TNFα recombinante. Fendly y otros, (Hybridoma, 6, 359-370,1987) describen el uso de anticuerpos monoclonales de múrido contra TNFα recombinante, para definir epítopos neutralizantes sobre TNF. Shimamoto y otros, (Immunology Letters, 17, 311-318, 1988) describen el uso de anticuerpos monoclonales de múrido contra TNF7 y su uso en la prevención del choque endotóxico en ratones. Además, en el documento de Solicitud de Patente Internacional WO 92/11383, se describen anticuerpos recombinantes, que incluyen anticuerpos injertados con CDR, específicos para TNFα. Rankin y otros, (British J. Rheumatology, 34, 334-342,1995) describen el uso de tales anticuerpos injertados con CDR, en el tratamiento de la artritis reumatoide. El documento US-A-5 919 452 describe anticuerpos quiméricos anti-TNF y su uso para tratar patologías asociadas con la presencia de 5 TNF.
Los anticuerpos para TNFα se han propuesto para la profilaxis y el tratamiento del choque endotóxico (Beutler y otros, Science, 234, 470-474,1985). Bodmer y otros, (Critical Care Medicine, 21, págs. 441-446, 1993) y Wherry y otros, (Critical Care Medicine, 21, págs. 436-440, 1993) describen el potencial terapéutico de anticuerpos anti-TNFα en el tratamiento del choque séptico. El uso de anticuerpos anti-TNFα en el tratamiento del choque séptico, también está descrito por Kirschenbaum y otros, (Critical Care Medicine, 26, 1625-1626, 1998). La artritis inducida con colágeno se puede tratar con eficacia usando un anticuerpo monoclonal anti-TNFα (Williams y otros (PNAS-USA, 89, 9784-9788, 1992)).
Niveles incrementados de TNFα se han encontrado en el líquido sinovial y en la sangre periférica de pacientes que sufren artritis reumatoide. Cuando se administran agentes que bloquean TNFα a pacientes que padecen artritis reumatoide, se reduce la inflamación, mejoran los síntomas y se retarda la lesión de las articulaciones (McKown y otros (Artritis Rheum., 42,1204-1208, 1999).
El uso de anticuerpos anti-TNFα en el tratamiento de la artritis reumatoide y de la enfermedad de Crohn, se describe en Feldman y otros, (Transplantation Proceedings, 30, 4126-4127, 1998), Adorini y otros, (Trends in Immunology Today, 18, 209-211, 1997) y en Feldman y otros, (Advances in Immunology, 64, 283-350, 1997). Los anticuerpos para TNFα utilizados en tales tratamientos son generalmente anticuerpos quiméricos, tales como los descritos en el documento US-A5919452.
Dos productos que bloquean el TNFα están autorizados actualmente para el tratamiento de la artritis reumatoide. El primero, llamado etanercept, está comercializado por Immunex Corporation como Enbrel®. Es una proteína de fusión recombinante que comprende dos dominios del receptor soluble p75 de TNF, ligados a la porción Fc de una inmunoglobulina humana. El segundo,... [Seguir leyendo]
Reivindicaciones:
1. Un método de análisis para la caracterización y la cuantificación de isómeros de disulfuro de fragmentos de anticuerpo que comprenden las etapas de: (a) pretratar el fragmento de anticuerpo con un disolvente orgánico, (b) digerir el fragmento de anticuerpo pretratado con una proteasa en presencia de un disolvente orgánico y (c) analizar los fragmentos de la digestión con proteasa.
2. El método de acuerdo con la reivindicación 1, en el que dicho disolvente orgánico es acetonitrilo.
3. El método de acuerdo con la reivindicación 2, en donde dicha concentración de acetonitrilo en la etapa de pretratamiento (a) está entre aproximadamente 40% y 80%.
4. El método de acuerdo con la reivindicación 3, en donde dicha concentración de acetonitrilo en la etapa de pretratamiento (a) es de aproximadamente 67%.
5. El método de acuerdo con la reivindicación 2, en donde dicha concentración de acetonitrilo en la etapa de digestión con proteasa (b) está entre aproximadamente 20% y 50%.
6. El método de acuerdo con la reivindicación 3, en donde dicha concentración de acetonitrilo en la etapa de digestión con proteasa (b) es de aproximadamente 20%.
7. El método de acuerdo con la reivindicación 1, en donde dicha proteasa es Lys-C o tripsina.
8. El método de acuerdo con la reivindicación 1, en donde dichos fragmentos de la digestión con proteasa se analizan empleando HPLC de fase inversa.
9. El método de acuerdo con una cualquiera de las reivindicaciones 1 a 8, en donde dicho fragmento de anticuerpo se selecciona entre el grupo consistente en: un fragmento Fab, Fab modificado, Fab', F(ab')2 o Fv; un monómero
o un dímero de cadena ligera o de cadena pesada; y un anticuerpo de cadena sencilla.
10. El método de acuerdo con la reivindicación 9, en donde dicho fragmento de anticuerpo es un Fab.
11. El método de acuerdo con la reivindicación 10, en donde dicho Fab es CDP870.
12. Un método de análisis para la caracterización y la cuantificación de productos de la degradación de fragmentos de anticuerpo y de impurezas de fragmentos de anticuerpo en proteínas recombinantes seleccionadas entre el grupo consistente en oxidaciones de metionilo, truncamientos, desamidación de asparaginas, incorporaciones indebidas, extensiones u otras degradaciones comunes de las proteínas o impurezas proteicas que comprenden las etapas de:
(a) pretratar la proteína con un disolvente orgánico, (b) digerir la proteína pretratada con una proteasa en presencia del disolvente orgánico y (c) analizar los fragmentos de la digestión con proteasa.
13. El método de acuerdo con la reivindicación 12, en donde dicha concentración de acetonitrilo en la etapa de pretratamiento (a) es de aproximadamente 50%.
14. El método de acuerdo con la reivindicación 13, en donde dicha concentración de acetonitrilo en la etapa de digestión con proteasa (b) es de aproximadamente 20%.
Patentes similares o relacionadas:
TERAPIAS CON DOSIS BAJAS PARA EL TRATAMIENTO DE TRASTORNOS EN LOS QUE LA ACTIVIDAD DEL TNF-ALFA ES PERJUDICIAL, del 14 de Diciembre de 2011, de ABBOTT BIOTECHNOLOGY LTD: Un anticuerpo anti-TNFα humano que es D2E77, o un anticuerpo anti-TNFα humano con propiedades equivalentes al D2E7, que se disocia del TNFα humano con una Kd […]
PROTEÍNAS DE UNIÓN TRIMÉRICAS PARA CITOCINAS TRIMÉRICAS, del 8 de Noviembre de 2011, de ANAPHORE, INC: Un polipéptido trimérico que comprende tres monómeros, comprendiendo cada uno de dichos monómeros un miembro de unión específico que puede unirse […]
PROCEDIMIENTOS PARA LA INGENIERÍA DE ANTICUERPOS, del 13 de Julio de 2011, de EPITOMICS, INC: Un procedimiento para diseñar un anticuerpo que comprende: identificar una posición tolerante a una variación en un anticuerpo parental: i) comparando […]
ANTICUERPO HUMANIZADO ESPECÍFICO PARA EL FACTOR DE NECROSIS TUMORAL-ALFA, del 24 de Mayo de 2011, de YUHAN CORPORATION: Un anticuerpo humanizado específico para el factor de necrosis tumoral-α humano (hTNF-α) que comprende: a) una región variable de […]
PROCEDIMIENTO PARA LA OBTENCIÓN DE ANTICUERPOS HUMANOS QUE NEUTRALIZAN LA ACTIVIDAD BIOLÓGICA DE UNA CITOQUINA HUMANA, del 5 de Mayo de 2011, de NEOVACS: Composición vacunal caracterizada porque comprende, a título de principio activo, un producto inmunógeno estable que comprende unos heterocomplejos […]
SECUENCIA LIDER UNIVERSAL DE GAS1, del 7 de Febrero de 2011, de DOMANTIS LIMITED: Un bacteriófago que comprende una molécula polinucleotídica que comprenden un promotor unido operablemente a una secuencia de ácido nucleico […]
ANTICUERPOS DIRIGIDOS AL FACTOR DE NECROSIS TUMORAL Y USOS DE LOS MISMOS, del 27 de Octubre de 2010, de AMGEN FREMONT INC.: Anticuerpo monoclonal humano que se une de manera específica al factor de necrosis tumoral a (TNFa) y comprende un polipéptido de cadena pesada que tiene una secuencia […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]