EXPRESION DEL FACTOR IX HUMANO ACTIVO EN TEJIDO MAMARIO DE ANIMALES TRANSGENICOS.
Un mamífero transgénico no humano que contiene una molécula de ADN exógena establemente integrada en su genoma,
en el que dicha molécula de ADN exógena comprende: (a) secuencias reguladoras de 5'' de un gen específico de la glándula mamaria que incluye un promotor; (b) una secuencia de ADN que codifica el Factor IX que codifica una secuencia señal, una prosecuencia del Factor IX y una secuencia del Factor IX en una dirección de 5'' a 3'', en el que dicha secuencia señal es eficaz en la dirección de la secreción de dicho Factor IX en la leche de dicho mamífero transgénico y en el que dicha secuencia del Factor IX carece de las regiones completas no traducida de 5'' y no traducida de 3'' del gen del Factor IX; y (c) secuencias reguladoras de 3'' de un gen específico de glándula mamaria o secuencias reguladoras de 3'' activas en una glándula mamaria; en el que las secuencias reguladoras de dicho 5'' y dicho 3'' están operativamente unidas a dicha secuencia de ADN que codifica el Factor IX
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US98/02638.
Solicitante: AMERICAN RED CROSS.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 15601 CRABBS BRANCH WAY,ROCKVILLE, MD 20855.
Inventor/es: DROHAN, WILLIAM, N., VELANDER, WILLIAM, H., LUBON, HENRYK, JOHNSON,JOHN,L.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- A01K67/027M
- A01K67/027M4
- C12N15/85A1
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- A61K38/00 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- C12P21/04 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Péptidos o polipéptidos cíclicos o puenteados, p. ej. bacitracina.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- C12P21/04 C12P 21/00 […] › Péptidos o polipéptidos cíclicos o puenteados, p. ej. bacitracina.
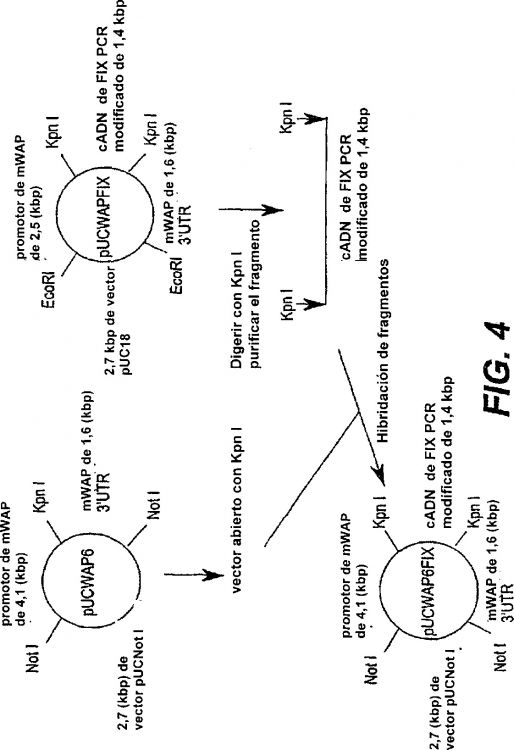
Fragmento de la descripción:
Expresión del Factor IX humano activo en tejido mamario de animales transgénicos.
Antecedentes de la invención
La presente invención se refiere a la producción de formas naturales y modificadas del Factor IX. En particular, la invención se refiere a un animal transgénico que contiene, establemente incorporado en su ADN genómico, un gen del Factor IX exógeno que se expresa específicamente en el tejido mamario, tal que el Factor IX es secretado en la leche producida por el animal. En particular, la invención se refiere a la producción del Factor IX humano en la leche de un mamífero no humano transgénico usando una molécula de ADN que comprende un promotor del gen del suero ácido, secuencias reguladoras de 5' que contienen al promotor, cADN del Factor IX humano que carece de la región no traducida de 5' completa o las regiones no traducidas de 3' del gen del Factor IX humano natural, pero contiene la región no traducida 5' y no traducida 3' del gen de la proteína ácida de suero.
El Factor IX humano, o "factor de Christmas", es codificado por un gen de una sola copia que reside en el cromosoma X en q27.1. Para una revisión de la estructura y de la expresión del gen del Factor IX, véase High et al., "Factor IX", en MOLECULAR BASIS OF THROMBOSIS AND HEMOSTASIS, High (editor), páginas 215-237 (Dekker 1995); Kurachi et al., Thromb. Haemost. 73:333 (1995). El gen del Factor IX tiene un tamaño de al menos 34 pares de kilobases (kb), y está formado por ocho exones. El sitio de inicio de la transcripción principal del gen del Factor IX en el hígado humano está localizado aproximadamente en el nucleótido - 176. El mARN del Factor IX humano está formado por 205 bases para la región no traducida de 5', 1383 bases para el prepro Factor IX, un códon de parada y 1392 bases para la región no traducida de 3'.
El factor IX se sintetiza como una cadena prepropolipeptídica formada por tres dominios: un péptido señal de 29 aminoácidos, un propéptido de 17 aminoácidos, que es requerido para la ?-carboxilación de residuos de ácido glutámico y una proteína del Factor IX madura de 415 residuos de aminoácidos. El zimogén del Factor IX sufre tres tipos de modificaciones post-translacionales antes de que sea secretado en la sangre: una conversión dependiente de la vitamina K de residuos de ácido glutámico a ácidos carboxiglutámicos, adición de cadenas de hidrocarburo y ß-hidroxilación de un ácido aspártico. La proteína del Factor IX madura contiene 12 residuos de ácido glutámico ?-carboxilado (Gla). Debido al requerimiento de la vitamina K por la ?-carboxilasa, el Factor IX es uno de los diversos factores de coagulación de la sangre dependientes de la vitamina K.
La activación del Factor IX se logra por una eliminación de dos pasos del péptido de activación (Ala146-Arg180) de la molécula. Bajaj et al., "Human factor IX and factor IXa", en METHODS IN ENZYMOLOGY (1993). La primera división se hace en el sitio Arg145-Ala146 por Factor XIa o por Factor VIIa/factor de tejido. La segunda, y la división limitante de la velocidad se hace en Arg180-Val181. Las rutas de activación que implican al Factor XIa y Factor VIIa/factor de tejido son ambas dependientes del calcio. Sin embargo, la ruta del Factor VIIa/factor de tejido requiere que el factor de tejido sea liberado de las células endoteliales dañadas. El Factor IX humano activado existe así como un heterodímero unido a disulfuro de la cadena pesada y la cadena ligera. Para una completa actividad biológica, el Factor IX humano también debe haber eliminado al propéptido y debe estar totalmente ?-carboxilado. Kurachi et al., Blood Coagulation and Fibrinolysis 4:953 (1993).
El factor IX es el precursor de una serina proteasa requerida para la coagulación de la sangre por la ruta de coagulación intrínseca. Defectos en la síntesis del Factor IX causan la hemofilia B (o la enfermedad de Christmas), un trastorno ligado al cromosoma X que ocurre en aproximadamente uno de cada 30.000 varones. Los pacientes con hemofilia B son tratados con el Factor IX obtenido del plasma recogido de individuos normales. Martinowitz et al., Acta Haematol 94 (Supl. 1):35 (1995). Tales preparaciones del Factor IX, sin embargo, pueden ser pirogénicas y pueden estar contaminadas con agentes patógenos o virus. En consecuencia, sería ventajoso desarrollar un medio para preparar el Factor IX purificado que no requiriera su extracción del plasma humano.
En el pasado, se han producido proteínas terapéuticas en E. coli. Sin embargo, las limitaciones en la secreción y modificación post-translacional que ocurren en todas las células vivas han hecho de la producción de proteína recombinante un fenómeno específico del tejido y de la célula y altamente específico de la especie. En un ejemplo de la expresión de FIX recombinante en células mamíferas, las poblaciones de FIX recombinante producidas en células de riñón de cría de hámster no son los mismos productos proteicos que los FIX producidos en células de ovario de hámster chino (Busby et al., Nature 316:684-686 (1985); Kaufman et al., J. Biol. Chem. 261: 9622-9628 (1986)). Estas proteínas presentan grandes diferencias en la ?-carboxilación y en la eliminación del propéptido y estas diferencias se han establecido como muy importantes en la determinación de la actividad biológica. Lo más importante, sólo fueron detectadas menos de aproximadamente 40 miliunidades/h/ml del rFIX activo en células CHO incluso después de la co-expresión de la enzima de división del propéptido PACE, la co-expresión de la enzima carboxilasa y la extensa amplificación de genes con metotrexato en una tentativa de aumentar el nivel de expresión y la actividad (Wasley et al. J. Biol. Chem. 268: 8458-8465 (1993); Rehemtulla et al., Proc. Natl. Acad. Sci. (USA), 90: 4611-4615 (1993)). Los investigadores concluyeron que existen múltiples limitaciones en la secreción de rFIX activo en células mamíferas (Rehemtulla et al., 1993) y que el problema de la transcripción de genes era secundario y, de hecho, trivial con respecto al procesamiento post-translacional de rFIX biológicamente activo en células mamíferas. Así, el empalme del mRNA de FIX es un efecto específico de la especie que ocurre en ratones y quizás en ovejas, pero no en cerdos. Aunque se pudiera suponer que FIX pudiera ser expresado, no se podría predecir con ninguna certeza si tal producto sería un producto de FIX terapéutico recombinante, práctico y clínicamente aceptable para una indicación hemofílica dada.
La producción del Factor IX recombinante en el cultivo de células de mamífero (células HepG2, fibroblasto de ratón, hepatoma de ratón, hepatoma de rata, BHK, CHO) se ha demostrado repetidamente que es recalcitrante y específica del sistema celular con respecto a restricciones intracelulares de secreción y procesamiento proteolítico, modificación post-translacional, niveles de expresión, actividad biológica, recuperación corriente abajo de medios de producción y justificación del período de semivida de circulación (Busby et al., (1985); de la Salle et al. Nature 316: 268-270 (1985); Anson et al., Nature 315: 684-686 (1985); Rehemtulla et al., 1993; Wasley, et al., (1993); Kaufman et al., (1986); Jallat et al., EMBO J. 9: 3295-3301 (1990)). De forma notable, los trabajos anteriormente mencionados concluyeron que son necesarias mejoras no triviales de estos criterios combinados si se quiere poner a disposición un práctico producto terapéutico de FIX profiláctico a partir de cualquier fuente de producción de células mamíferas recombinantes. Por ejemplo, los intentos de aumentar la actividad específica de rFIX producido por células CHO rectificando problemas con baja carboxilación por co-expresión de la enzima carboxilasa dependiente de la vitamina K no causaron ninguna mejora en la ?-carboxilación o en la actividad biológica (Rehemtulla et al., (1993), lo que implica que existen múltiples limitaciones de velocidad en esta modificación post-translacional).
También se han documentado en la bibliografía dificultades similares en la producción de cantidades significativas de rFIX biológicamente activo en células epiteliales mamarias de animales transgénicos. Aunque los documentos WO-A-90/05188 y WO-A-91-08216 predigan que...
Reivindicaciones:
1. Un mamífero transgénico no humano que contiene una molécula de ADN exógena establemente integrada en su genoma, en el que dicha molécula de ADN exógena comprende:
en el que las secuencias reguladoras de dicho 5' y dicho 3' están operativamente unidas a dicha secuencia de ADN que codifica el Factor IX.
2. El mamífero transgénico no humano de la reivindicación 1, en el que dicho promotor se selecciona del grupo que consiste en el promotor (WAP) corto de la proteína ácida de suero, el promotor (WAP) largo, el promotor corto de la caseína a, el promotor corto de la caseína ß, el promotor corto de la caseína ?, el promotor largo de la caseína a, el promotor largo de la caseína ß, el promotor largo de la caseína ?, el promotor de la lactalbúmina a y el promotor de la lactoglobulina ß.
3. El mamífero transgénico no humano de la reivindicación 2, en el que dicho promotor WAP corto es el promotor EcoRI-KpnI de 2,6 kb del gen WAP de ratón.
4. El mamífero transgénico no humano de la reivindicación 2, en el que dicho promotor WAP largo es el promotor NotI-KpnI de 4,1 kb o el promotor Sau3A-KpnI de 4,2 kb del gen WAP de ratón.
5. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 4, en el que dicha secuencia de ADN que codifica el Factor IX comprende además una región 5' no traducida que no es la región 5' no traducida del gen del Factor IX.
6. El mamífero transgénico no humano de la reivindicación 5, en el que dicha región 5' no traducida es la región 5' no traducida del gen WAP de ratón.
7. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 6, en el que dicha secuencia de ADN que codifica el Factor IX comprende además una región 3' no traducida que no es la región 3' no traducida del gen del Factor IX.
8. El mamífero transgénico no humano de la reivindicación 7, en el que dicha región 3' no traducida es la región 3' no traducida del gen WAP de ratón.
9. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 8, en el que dicha secuencia de ADN que codifica el Factor IX comprende además una región 5' no traducida localizada 5' de dicho ADN de secuencia señal, y una región 3' no traducida localizada 3' de dicha secuencia del Factor IX.
10. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 9, en el que dicho mamífero transgénico se selecciona del grupo que consiste en ratones, ratas, conejos, cerdos, ovejas, cabras y vacas.
11. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 10, en el que dicho Factor IX es el Factor IX humano biológicamente activo.
12. El mamífero transgénico no humano de la reivindicación 11, en el que dicho mamífero transgénico secreta aproximadamente de 100 a aproximadamente 220 µg del Factor IX humano activo por mililitro de leche.
13. El mamífero transgénico no humano de la reivindicación 12, en el que dicho mamífero transgénico secreta de aproximadamente 100 a aproximadamente 185 µg del Factor IX humano activo por mililitro de leche.
14. El mamífero transgénico no humano de la reivindicación 13, en el que dicho mamífero transgénico secreta de aproximadamente 100 a aproximadamente 170 µg del Factor IX humano activo por mililitro de leche.
15. El mamífero transgénico no humano de la reivindicación 12, en el que dicho mamífero transgénico secreta de aproximadamente 135 a aproximadamente 220 µg del Factor IX humano activo por mililitro de leche.
16. El mamífero transgénico no humano de la reivindicación 15, en el que dicho mamífero transgénico secreta de aproximadamente 145 a aproximadamente 220 µg del Factor IX humano activo por mililitro de leche.
17. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 16, en el que dicho mamífero transgénico es un cerdo.
18. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 17, en el que dicho Factor IX humano activo, cuando se purifica de la leche de dicho mamífero transgénico, tiene una actividad específica que es al menos aproximadamente un 5-200% mayor que la actividad específica del Factor IX humano aislado del plasma humano, según se determina mediante un ensayo de tiempo de coagulación de tromboplastina parcial activada.
19. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 18, en el que dicho Factor IX humano activo purificado de la leche de dicho mamífero transgénico tiene una actividad específica que es al menos aproximadamente un 10-100% mayor que la actividad específica del Factor IX humano aislado del plasma humano.
20. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 19, en el que dicho Factor IX humano activo purificado de la leche de dicho mamífero transgénico tiene una actividad específica que es al menos aproximadamente un 15-50% mayor que la actividad específica del Factor IX humano aislado del plasma humano.
21. El mamífero transgénico no humano de cualquiera de las reivindicaciones 1 a 20, en el que dicho Factor IX humano activo purificado de la leche de dicho mamífero transgénico tiene una actividad específica que es al menos aproximadamente un 15-46% mayor que la actividad específica del Factor IX humano aislado del plasma humano.
22. Un procedimiento para producir el Factor IX, que comprende proporcionar un mamífero transgénico no humano según cualquiera de las reivindicaciones 1 a 21, recoger dicha leche de dicho mamífero y aislar dicho Factor IX de dicha leche.
23. El uso del Factor IX producido por el mamífero transgénico no humano de la reivindicación 17 para la fabricación de un medicamento para tratar la hemofilia B o impedir o mejorar sus síntomas.
24. Las células de glándula mamaria obtenidas del mamífero transgénico no humano de la reivindicación 17, en el que dichas células producen dicho Factor IX.
25. Un cultivo in vitro de las células de glándula mamaria de la reivindicación 24.
26. Un método para producir el Factor IX, comprendiendo dicho método la etapa de aislar dicho Factor IX de las células de glándula mamaria cultivadas de la reivindicación 25.
27. El uso de las células de glándula mamaria de la reivindicación 24 para la fabricación de un medicamento para tratar la hemofilia B o mejorar o prevenir sus síntomas.
28. El Factor IX producido por el mamífero no humano transgénico de la reivindicación 17 para uso en el tratamiento de la hemofilia B o la prevención o mejora de sus síntomas.
29. Las células de glándula mamaria de la reivindicación 24 para uso en el tratamiento de la hemofilia B o la mejora o prevención de sus síntomas.
Patentes similares o relacionadas:
MODELOS DE SELECCIÓN IN VIVO PARA EL TRATAMIENTO DE LA ENFERMEDAD DE ALZHEIMER Y OTROS TRASTORNOS RELACIONADOS CON QPCT, del 17 de Enero de 2012, de PROBIODRUG AG: Animal transgénico no humano que sobreexpresa glutaminil ciclasa que comprende células que contienen un transgén de ADN que codifica para glutaminil ciclasa.
ANIMAL TRANSGÉNICO IL-18, del 13 de Enero de 2012, de Taiho Pharmaceutical Co., Ltd. Nakanishi, Kenji Mizutani, Hitoshi: Un ratón transgénico que secreta de forma continua IL-18 madura en sangre y que desarrolla de forma continua dermatitis atópica, que comprende un ADN en el que una secuencia […]
COMPOSICIONES Y PROCEDIMIENTOS PARA EL TRATAMIENTO Y DIAGNÓSTICO DE TRASTORNOS INMUNITARIOS, del 15 de Diciembre de 2011, de MILLENNIUM PHARMACEUTICALS, INC.: Un anticuerpo que se une específicamente a un péptido codificado por la secuencia de nucleótidos de la SEC ID N.º: 2 o un péptido codificado por el gen […]
MODELO TRANSGÉNICO DE LA ENFERMEDAD DE ALZHEIMER, del 2 de Noviembre de 2011, de BioArctic Neuroscience AB: Un ratón transgénico que expresa un transgén que comprende una secuencia de ADN que codifica una Proteína Precursora Amiloide (APP) heteróloga que comprende la mutación […]
COMPOSICIONES PARA LA DERIVACIÓN CULTIVO IN VITRO DE LÍNEAS DE CÉLULAS MADRE EMBRIONARIAS (ES) CON CAPACIDAD DE TRANSMISIÓN DE LA LÍNEA GERMINAL Y PARA EL CULTIVO DE CÉLULAS MADRE ADULTAS, del 4 de Julio de 2011, de THROMBOGENICS N.V.: Un método para obtener, mantener o hacer crecer células madre embrionarias pluripotentes de roedor que comprenden la etapa de cultivar las células durante al menos […]
CONSTRUCCION GENICA QUE COMPRENDE EL GEN QUE CODIFICA LA PROTEINA KAPY ANIMAL NO HUMANO MODIFICADO GENETICAMENTE CON LA MISMA, del 30 de Junio de 2011, de FUNDACIO INSTITUT DE RECERCA HOSPITAL UNIVERSITARI VALL D'HEBRON, FUNDACIO PRIVADA: La presente invención se refiere a una construcción génica que comprende el gen de la proteína renal regulada por andrógenos (KAP) de ratón bajo el control […]
MEDIO DE CULTIVO DE CÉLULAS EMBRIONARIAS TOTIPOTENTES AVIARES, del 7 de Junio de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Procedimiento de cultivo de células embrionarias totipotentes aviares (o células ES aviares), caracterizado porque: 1) Se suspenden unas células que proceden de discos […]
 CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]
CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]