ANIMALES TRANSGENICOS QUE PRESENTAN TRANSTORNOS SERIOS ASOCIADOS A LA ENFERMEDAD DE ALZHEIMER.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2004/002436.
Solicitante: AVENTIS PHARMA S.A..
Nacionalidad solicitante: Francia.
Dirección: 20, AVENUE RAYMOND ARON 92160 ANTONY FRANCIA.
Inventor/es: BENOIT, PATRICK, BLANCHARD-BREGEON,VERONIQUE, ITIER,JEAN-MICHEL, PRADIER,LAURENT, TREMP,GUNTER, CASAS LOUZAO,CATY.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Septiembre de 2004.
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- A01K67/027M4
- C07K14/47A3
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/90 C12N 15/00 […] › Introducción estable de ADN extraño en el cromosoma.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12Q1/02 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen microorganismos vivos.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Clasificación antigua:
- A01K67/027 A01K 67/00 […] › Nuevas razas de vertebrados.
- C07K14/47 C07K 14/00 […] › de mamíferos.
- C12N15/12 C12N 15/00 […] › Genes que codifican proteínas animales.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/90 C12N 15/00 […] › Introducción estable de ADN extraño en el cromosoma.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12Q1/02 C12Q 1/00 […] › en los que intervienen microorganismos vivos.
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
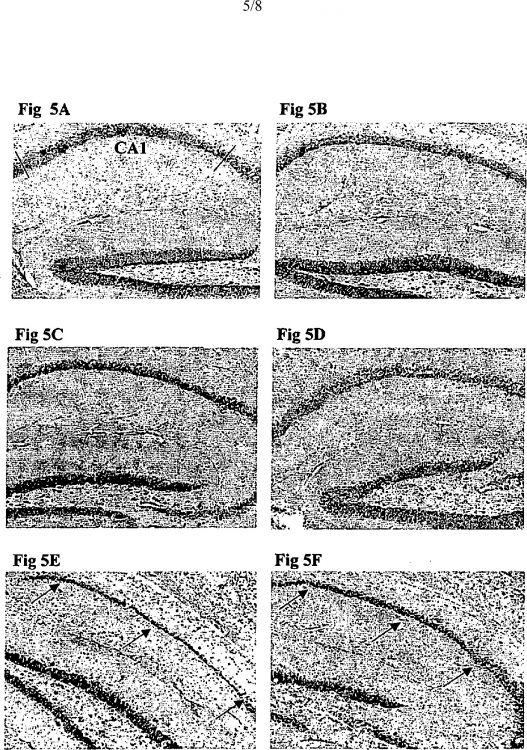
Fragmento de la descripción:
La presente solicitud se refiere a los animales transgénicos modelos de la enfermedad de Alzheimer (AD). Además tiene por objeto la utilización de estos animales.
La enfermedad de Alzheimer es una enfermedad neurodegenerativa progresiva que afecta a una gran proporción de la población de edad avanzada. Esta enfermedad se caracteriza en el plano clínico por una pérdida de la memoria y un declive de las funciones cognitivas, y en el plano neuropatológico por una pérdida neuronal pronunciada y la presencia en el cerebro de depósitos neurofibrilares intracelulares y depósitos extracelulares del péptido º-amiloide (Aº) que forma placas amiloides.
Las placas amiloides están compuestas mayoritariamente por los péptidos Aº con 40 ó 42 restos que son generados en el proceso proteolítico del precursor del péptido Aº (APP). Los depósitos extracelulares de Aº son muy específicos de los trastornos asociados con la enfermedad de Alzheimer. Representan la característica precoz e invariable de todas las formas de la enfermedad de Alzheimer, incluyendo las formas familiares (FAD). Las formas familiares aparecen de manera relativamente precoz (entre los 30 y 60 años) y son debidas a mutaciones en el gen del APP en el 5% de los casos de FAD con ocho mutaciones antisentido simples o dobles identificadas, en el gen de la presenilina 1 (PS1) en 50 a 70% de los casos de FAD con más de 100 mutaciones diferentes identificadas hasta ahora, y en el gen de la presenilina 2 en los casos más raros de FAD con dos mutaciones antisentido descritas. Se ha mostrado que las mutaciones en estos tres genes inducen cambios en la proteolisis del APP, que llevan a una sobreproducción de Aº, especialmente de la forma larga Aº42, y a la aparición precoz de la patología y síntomas similares a los de las formas esporádicas de la enfermedad de Alzheimer.
Los modelos animales destinados a representar ciertas características de la patología de la enfermedad de Alzheimer ya han sido descritos en la bibliografía.
Se trata por una parte de ratones transgénicos que llevan mutaciones en el gen APP. Desarrollan patologías similares a la enfermedad de Alzheimer a partir de un año. Así el ratón PDAPP, que sobreexpresa el APP humano y que lleva la mutación V717F, desarrolla con la edad depósitos de Aº en el cerebro pero no presenta pérdida neuronal más allá del emplazamiento de las propias placas (Irizarry et al., 1997,
J. Neurosc. 17(18): 7053-7059). Este fenómeno se denomina aquí « efecto placa ».
Igualmente, el ratón Tg(HuAPP695. K670N-M671L)2576, que expresa la isoforma humana APP K670N-M67IL (APPSw para la mutación tipo Swedish), presenta depósitos de tipo amiloide pero no presenta pérdida neuronal (Irizarry et al.,
1997, J. Neuropathol. Exp. Neurol 56: 695-973).
En un estudio de Calhoun et al. (1998, Nature 395 : 755-756), se ha mostrado una pérdida neuronal en ciertas regiones cerebrales en la proximidad de las placas amiloides, en los ratones transgénicos APP23 de 14-18 meses de edad que expresan una isoforma mutada de APP humano. Esta observación es controvertida puesto que la pérdida es débil y se produce en los animales relativamente viejos y sobre todo en la proximidad de las placas, lo que podría corresponder al « efecto placa » observado precedentemente. Además, dicha observación no se menciona o se menciona apenas en un comentario reciente que señala que los modelos animales actuales no presentan una completa similitud con todas las características conocidas de las patologías de la enfermedad de Alzheimer, entre otras la pérdida neuronal (Trojanowski, 2002, Am. J. Pathol.160: 409-411).
Por otra parte, se conocen ratones transgénicos que llevan mutaciones en el gen PS1. Estos no parecen desarrollar una patología tipo enfermedad de Alzheimer pero presentan una cantidad elevada de péptido Aº42 (aumento de 2 veces en relación con las PS1 salvajes) que es reconocida como altamente patógena.
Además, en los modelos animales transgénicos descritos que llevan mutaciones FAD P264L o M146L en el gen PS1 de ratón (« knock-in »), la proteína PS1 mutada no se expresa de forma estable (Siman et al., 2000, J. Neurosci., 20: 8717-8726; Flood et al., 2002, Neurobiol. Aging 23 : 335-348; Rozmahel et al., 2002, 23 :187-194). Estos ratones presentan también una cantidad elevada de péptido Aº42.
La solicitud WO 02/0008407 describe dichos ratones transgénicos en los que el gen que codifica la presenilina 1 se ha mutado por introducción de una mutación P264L.
Huang et al. (Exp.Neurol., vol. 183, No2, Oct 2003, p 673-681) describe ratones transgénicos, aparentemente heterocigotos que expresan la proteína PS 1 humana con la mutación L235P.
Un vínculo posible entre las mutaciones respectivas M233T y L235P de PS1 y las formas precoces de la enfermedad de Alzheimer se evoca por la bibliografía (Kwok et al., Neuroreport 14 abril 1997, vol 8, No 6, p1537-1542, y Campion et al., Neuroreport 1996 UK, vol 7, No 10, 1996, p1582-1584).
Debido al papel de la proteína PS1 en la formación de las formas Aº42, se han fabricado también ratones dobles transgénicos que llevan mutaciones en los genes APP y PS1. Como los simples transgénicos descritos antes, estos ratones presentan depósitos de Aº pero no presentan pérdida neuronal (Takeuchi et al., 2000, Am. J.
Pathol. 157: 331-339).
Así, los modelos animales de la enfermedad de Alzheimer que existen no son satisfactorios porque fallan en reproducir una pérdida neuronal que sin embargo es una característica importante de las enfermedades neurodegenerativas, entre ellas la enfermedad de Alzheimer.
La solicitante se refiere por tanto a la fabricación de animales que presentan las características importantes de la enfermedad de Alzheimer, entre ellas la pérdida neuronal.
Ha mostrado que es posible obtener dichos animales introduciendo mutaciones específicas en el gen que codifica la proteína PS1 en ratones y cruzando estos ratones con ratones que sobreexpresan el gen humano del APP.
Un primer aspecto de la invención se refiere por tanto a un animal no humano que presenta, ventajosamente en su genoma, al menos una secuencia de ácido nucleico que codifica la presenilina 1 que lleva las dos mutaciones que corresponden a las mutaciones M233T y L235P sobre la proteína PS1 de ratón, en estado homocigoto.
De forma preferente, la proteína PS1 que lleva las mutaciones M233T y L235P es de origen murino.
De manera particularmente preferida la proteína presenilina 1 mutada es endógena.
Así un animal según la presente invención produce ventajosamente una proteína que comprende la secuencia SEQ ID N°2. Produce preferentemente una proteína que presenta la secuencia SEQ ID N°3. Comprende ventajosamente en su genoma la secuencia de ácidos nucleicos SEQ ID N°1 o la secuencia SEQ ID N°8.
Las secuencias SEQ ID N°1, SEQ ID N°2 y SEQ ID N°8 resultan respectivamente de las mutaciones introducidas en las secuencias salvajes SEQ ID N°4, SEQ ID N°5 y SEQ ID N°9. La secuencia SEQ ID N°5 es la de los restos 229 a 237 de la proteína presenilina 1 salvaje de ratón. La secuencia SEQ ID N°9 es la del exón 7 salvaje del gen del ratón que codifica la proteína presenilina 1, es decir, no mutada.
Ventajosamente, un animal según la presente invención coexpresa el APP, preferentemente el APP humano. Dicho gen puede comprender una o varias mutaciones FAD. Así, las mutaciones en el gen del APP pueden ser una de las diferentes mutaciones descritas hasta ahora en la bibliografía. Las mutaciones en el gen del APP se pueden elegir entre las mutaciones "Swedish" (S), "London" (L) y "Dutch" (D) solas o en combinación.
Estas mutaciones están bien descritas en la bibliografía y se caracterizan de una manera general por las modificaciones siguientes :
Naturaleza y posición Mutación Swedish Mutación Dutch Mutación London con relación al APP770 K 670 N y M 671 L E 693 Q y/o A 692 G V 717 I con relación al APP751 K 651 N y M 652 L E 674 Q y/o A 673 G V 698 I con relación al APP695 K 595 N y M596L E 618 Q y/o A 617 G V 642 I con relación al péptido A-º (A42) E 22 Q y/o A 21 G V 46 IEstán igualmente comprendidas en la mutación London todas las sustituciones que no sean de isoleucina que están situadas en la posición 717 con referencia al APP770, tales como por ejemplo las mutaciones V 717 G y V 717 F.
...
Reivindicaciones:
1. Animal no humano que presenta una secuencia de ácidos nucleicos que codifica una proteína presenilina 1 que lleva en el estado homocigoto las mutaciones que corresponden a las mutaciones M233T y L235P sobre la proteína PS1 de ratón.
2. Animal según la reivindicación 1 que comprende además una secuencia de ácidos nucleicos que codifica todo o una parte del gen que codifica el APP.
3. Animal según una de las reivindicaciones 1 y 2 caracterizado porque expresa una cantidad de PS1 mutada comparable a la cantidad de la PS1 endógena de un animal que expresa una PS1 no mutada.
4. Animal según una de las reivindicaciones 1 a 3 caracterizado porque la proteína presenilina 1 que lleva las mutaciones M233T y L235P es de origen murino.
5. Animal según una de las reivindicaciones 2 a 4 caracterizado porque la proteína APP es la APP751 y es de origen humano.
6. Animal según una de las reivindicaciones 2 a 5 caracterizado porque la proteína APP751 es de origen humano y presenta las mutaciones Swedish y London.
7. Animal según una de las reivindicaciones 1 a 6 caracterizado porque es un roedor.
8. Animal según una de las reivindicaciones 1 a 7 caracterizado porque es un ratón, una rata o un conejo.
9. Animal según una de las reivindicaciones 1 a 8 caracterizado porque produce una proteína que comprende la secuencia SEQ ID N°2.
10. Animal según una de las reivindicaciones 1 a 9 caracterizado porque presenta en su genoma la secuencia de ácidos nucleicos SEQ ID N°1.
11. Animal según una de las reivindicaciones 2 a 10 caracterizado porque la expresión del gen que codifica el APP está bajo el control de un promotor exógeno.
12. Animal según una de las reivindicaciones 1 a 11 caracterizado porque presenta una pérdida neuronal.
13. Animal según una de las reivindicaciones 1 a 10 caracterizado porque presenta una relación Abeta42/Abeta total superior a aproximadamente 0,9.
14. Animal según una de las reivindicaciones 1 a 13 caracterizado porque la proteína presenilina 1 mutada es endógena.
15. Célula o línea celular obtenida de un animal según una de las reivindicaciones 1 a 14.
16. Célula o línea celular que comprende una secuencia de ácidos nucleicos que codifica el gen murino de la presenilina 1 bajo una forma mutada en M233T y L235P.
17. Célula madre embrionaria obtenida de un animal según una de las reivindicaciones 1 a 14.
18. Proteína PS1 de ratón que lleva las mutaciones de los aminoácidos M en T, y L en P respectivamente en las posiciones 233 y 235.
19. Proteína según la reivindicación 18 caracterizada porque comprende la secuencia SEQ ID N°2.
20. Ácido nucleico que codifica la proteína PS1 de ratón que lleva las mutaciones de los aminoácidos M en T, y L en P respectivamente en las posiciones 233 y
235.
21. Ácido nucleico según la reivindicación 20 caracterizado porque comprende la secuencia SEQ ID N°1.
22. Vector que comprende un ácido nucleico según la reivindicación 21.
23. Utilización de un animal según una de las reivindicaciones 1 a 14, para la identificación de compuestos destinados al tratamiento de la enfermedad de Alzheimer.
24. Procedimiento de identificación de compuestos destinados al tratamiento de las enfermedades neurodegenerativas que comprende las etapas siguientes :
- administración del compuesto o de una mezcla de compuestos a ensayar a un animal según una de las reivindicaciones 1 a 14, y
- observación de la evolución de uno o varios marcadores característicos que reproducen la neuropatología observada en el ser humano.
25. Procedimiento de identificación de compuestos destinados al tratamiento de las enfermedades neurodegenerativas que comprende las etapas siguientes :
- poner en contacto las células extraídas de un animal según una de las reivindicaciones 1 a 14 con un compuesto o una mezcla de compuestos y
- medir el efecto o efectos de los compuestos a nivel de las células enteras, en los homogenatos de células o sobre una fracción subcelular.
26. Utilización de una proteína según una de las reivindicaciones 18 y 19 para la identificación de compuestos destinados al tratamiento de la enfermedad de Alzheimer.
Patentes similares o relacionadas:
PROCEDIMIENTOS Y COMPOSICIONES INMUNOLÓGICAS PARA EL TRATAMIENTO DE LA ENFERMEDAD DE ALZHEIMER, del 23 de Noviembre de 2011, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un péptido representado por la fórmula (A)n -- (Th)m -- (B)o -- Abeta -- (C)p en la que cada A, B y C son un resto de aminoácido o una secuencia de restos […]
MÉTODO DE DIAGNÓSTICO IN VITRO DE LA ENFERMEDAD DE ALZHEIMER MEDIANTE UN ANTICUERPO MONOCLONAL, del 8 de Noviembre de 2011, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Método de diagnóstico in vitro de la enfermedad de Alzheimer medante un anticuerpo monoclonal. Dicho anticuerpo es capaz de unire al menos a los aminoácidos 12-16 del […]
MODELO TRANSGÉNICO DE LA ENFERMEDAD DE ALZHEIMER, del 2 de Noviembre de 2011, de BioArctic Neuroscience AB: Un ratón transgénico que expresa un transgén que comprende una secuencia de ADN que codifica una Proteína Precursora Amiloide (APP) heteróloga que comprende la mutación […]
COMPOSICIÓN DE PÉPTIDO INMUNOGÉNICO PARA LA PREVENCIÓN Y EL TRATAMIENTO DE LA ENFERMEDAD DE ALZHEIMER, del 6 de Junio de 2011, de UNITED BIOMEDICAL, INC.: Un inmnunógeno del péptido representado por una de las siguientes fórmulas: (A)n-(fragmento N-terminal del péptido Aß1-42)-(B)o-(Th)m-X; o […]
POLIPÉPTIDOS DERIVADOS DE PROTEÍNA PRECURSORA AMILOIDE (APP) Y SUS USOS, del 31 de Marzo de 2011, de THE OPEN UNIVERSITY: Una composición farmacéutica que comprende: (a) un compuesto con la fórmula: X1 es un grupo acilo representado por la fórmula: X2 es H o un grupo acilo representado […]
COMPOSICION DE PÈPTIDO INMUNOGENO PARA LA PREVENCION Y TRATAMIENTO DE LA ENFERMEDAD DE ALZEHIMER, del 20 de Diciembre de 2010, de UNITED BIOMEDICAL, INC.: Un péptido inmunógeno representado por una de las siguientes fórmulas: en donde cada A es independientemente un aminoácido; (A)n-(fragmento N-terminal […]
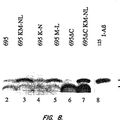 METODOS PARA LA IDENTIFICACION DE LOS COMPUESTOS INHIBIDORES DE LA LIBERACION DEL PEPTIDO BETA-AMILOIDE (BETAAP), del 21 de Octubre de 2010, de ELAN PHARMACEUTICALS, INC.
THE BRIGHAM AND WOMEN'S HOSPITAL, INC.
ELI LILLY AND COMPANY: Método in vitro para identificar inhibidores de la producción del péptido ß-amiloide (ßAP), comprendiendo dicho método cultivar células de mamífero en un […]
METODOS PARA LA IDENTIFICACION DE LOS COMPUESTOS INHIBIDORES DE LA LIBERACION DEL PEPTIDO BETA-AMILOIDE (BETAAP), del 21 de Octubre de 2010, de ELAN PHARMACEUTICALS, INC.
THE BRIGHAM AND WOMEN'S HOSPITAL, INC.
ELI LILLY AND COMPANY: Método in vitro para identificar inhibidores de la producción del péptido ß-amiloide (ßAP), comprendiendo dicho método cultivar células de mamífero en un […]
PROCEDIMIENTOS DE ESTUDIO DE LA TOLERANCIA EN ANIMALES TRANSGÉNICOS MHC-II, del 25 de Mayo de 2011, de ANTITOPE LIMITED: Un procedimiento para probar la inmunogenicidad de un antígeno variante que se deriva de un antígeno de un primer mamífero, en un segundo mamífero no […]