5-CNAC COMO AGENTE PARA SUMINISTRO ORAL PARA FRAGMENTOS DE HORMONA PARATIROIDE.
Una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento de una hormona paratiroide (PTH) y ácido N-(5-clorosaliciloil)-8-aminocaprílico (5-CNAC),
dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41), con la condición que una composición tampoco comprende calcitonina y con la condición que una cápsula comprende 800 µg de PTH (1-34) y 400 mg de sal disodio de 5-CNAC se excluya específicamente
Tipo: Resumen de patente/invención. Número de Solicitud: W0209181EP.
Solicitante: NOVARTIS AG
NOVARTIS PHARMA GMBH.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: BATEMAN, SIMON, DAVID, AZRIA, MOISE.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/198 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Alfa-amino-ácidos, p. ej. alanina, ácido etilendiamino tetraacético (EDTA) (betaína A61K 31/205; prolina A61K 31/401; triptófano A61K 31/405; histidina A61K 31/4172; péptidos no degradados en aminoácidos individuales A61K 38/00).
- A61K38/29 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K47/18B
- A61K9/48H4
Clasificación PCT:
- A61K38/29 A61K 38/00 […] › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K47/18 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61P19/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para las enfermedades óseas, p.ej. raquitismo, enfermedad de Paget.
- A61P19/10 A61P 19/00 […] › para la osteoporosis.
Clasificación antigua:
- A61K38/29 A61K 38/00 […] › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K47/18 A61K 47/00 […] › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61P19/08 A61P 19/00 […] › para las enfermedades óseas, p.ej. raquitismo, enfermedad de Paget.
- A61P19/10 A61P 19/00 […] › para la osteoporosis.
Fragmento de la descripción:
5-CNAC como agente para suministro oral para fragmentos de hormona paratiroide.
Antecedente de la invención
La presente invención se relaciona con el suministro oral de hormona paratiroide (PTH). Las hormonas paratiroides de mamíferos, por ejemplo humano (hPTH), bovino (bPTH) y porcino (pPTH), son cadenas de polipéptidos únicas de 84 residuos de aminoácidos que tienen pesos moleculares de aproximadamente 9500. Específicamente, la presente invención se relaciona con fragmentos PTH que incorporan por lo menos los primeros 28 residuos de aminoácidos del terminal N (PTH (1-28)) hasta y que incluye los primeros 41 residuos de aminoácido del terminal N (PTH (1-41)). Más particularmente, la invención se dirige a composiciones farmacéuticas para el suministro oral de PTH, dichas composiciones comprenden PTH (1-28) a (1-41) y ácido N-(5-clorosaliciloil)-8-aminocaprílico (5-CNAC).
Los estudios PTH hechos en animales y humanos con PTH, Péptidos relacionados con PTH, y análogos de PTH han demostrado su utilidad en incrementar la formación ósea y resorción ósea y han prometido interés en su uso para el tratamiento de osteoporosis y trastornos óseos relacionados. Sin embargo, el suministro oral de PTH en mamíferos han probado ser difíciles debido a, por lo menos en parte, la inestabilidad suficiente del PTH en el tubo gastrointestinal así como también la incapacidad del PTH para ser transportado fácilmente a través de las paredes intestinales en el torrente sanguíneo.
La Patente Estadounidense No. 5,773,647 (la patente '647) describe 193 compuestos portadores útiles para el suministro de agentes activos, que incluyen PTH. Uno de los compuestos portadores descritos expresamente aquí es ácido N-(5-clorosaliciloil)-8-aminocaprílico (5-CNAC) que tiene la Fórmula
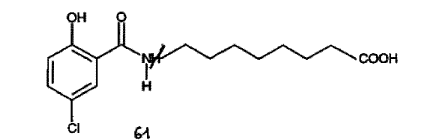
El ejemplo 2 en la columna 61 de la patente '647 describe la preparación de 1 diferentes composiciones de dosificación algunas intracolónicas (IC) y algunas por alimentación forzada (PO) cada una contiene hormona paratiroide y un portador, el portador es diferente para cada composicón. Una composición de dosificación IC se prepara utilizando 5-CNAC como el portador. El ejemplo 3 aquí describe pruebas de dosificación llevadas a cabo in vivo en ratas macho Sprague-Dawley con las soluciones de dosificación preparadas en el Ejemplo 2. Se recolectan muestras sanguíneas y se cuantifica la concentración de suero PTH para cada rata.
Se ha encontrado ahora sorprendentemente, que el 5-CNAC en combinación con fragmentos PTH específicos, es decir fragmentos PTH que incorporan por lo menos los primeros 28 residuos de aminoácido del terminal N (PTH (1-28)) hasta y que incluye los primeros 41 residuos de aminoácido del terminal N (PTH (1-41)) cuando se administra oralmente da altos niveles de suero PTH inesperados a otros PTH y otros portadores y proporciona un Cmax nítido que permite un efecto en la formación ósea.
Resumen de la invención
De acuerdo con lo anterior, la presente invención se dirige a
Una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento PTH y 5-CNAC, dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41) con la condición que una composición tampoco comprenda calcitonina y con la condición que una cápsula comprende 800 µg de PTH(1-34) y 400 mg sal disodio de 5-CNAC se excluye específicamente. Preferiblemente, el PTH es hormona paratiroide humana, hPTH.
En otra realización, la invención se dirige a una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento PTH y 5-CNAC, dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41) con la condición que una composición tampoco comprende calcitonina y con la condición que una cápsula comprende 800 µg de PTH(1-34) y 400 mg de sal disodio de 5-CNAC se excluye específicamente, para uso en tratar o evitar una afección ósea asociada con eliminación o resorción de calcio incrementada.
La invención también se dirige a composiciones farmacéuticas para suministro oral que comprenden una cantidad terapéuticamente efectiva de un fragmento PTH y 5-CNAC, dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41) con la condición que una composición tampoco comprende calcitonina y con la condición que una cápsula comprende 800 µg de PTH(1-34) y 400 mg de sal disodio de 5-CNAC se excluye específicamente, para uso en la estimulación de la nueva formación ósea.
En una realización adicional, la invención se dirige a una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento PTH y 5-CNAC, dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41), con la condición que una composición tampoco comprende calcitonina y con la condición que una cápsula comprende 800 µg de PTH(1-34) y 400 mg de sal disodio de 5-CNAC se excluye específicamente, para uso en tratar o evitar osteoporosis.
Las características y ventajas adicionales de la invención serán evidentes de la siguiente descripción detallada de la invención.
Descripción detallada de la invención
Los Fragmentos PTH pueden ser de cualquier hormona paratiroide, particularmente hormona paratiroide de mamífero, por ejemplo humano (hPTH), bovino (bPTH), y porcino (pPTH) y particularmente hPTH e incorporará por lo menos los primeros 28 residuos de terminal N (PTH (1-28)) hasta y que incluye los primeros 41 residuos de terminal N (PTH (1-41)) e incluye sin limitación PTH (1-28), PTH (1-31), PTH (1-34), PTH (1-37), PTH (1-38) y PTH (1-41). Se prefiere particularmente la hormona paratiroide humana (1-34). Estos fragmentos de hormona paratiroide están disponibles comercialmente o se pueden obtener recombinantemente o mediante la síntesis de péptido.
Para propósitos de la actual invención, el 5-CNAC, es decir ácido N-(5-clorosaliciloil)-8-aminocaprílico, puede ser el ácido libre, análogos del mismo, sus sales de monosodio y disodio, solvatos de etanol de las sales de sodio y los monohidratos de las sales de sodio y cualesquier combinaciones de los mismos. El ácido libre, la sal disodio de 5-CNAC y el monohidrato del mismo son particularmente útiles. Se describe ácido N-(5-clorosaliciloil)-8-aminocaprílico en la patente 647 mencionada anteriormente, y se puede hacer por métodos descritos aquí. Las sales de sodio y los solvatos de alcohol e hidratos de los mismos se describe en la WO 00/059863, junto con métodos para prepararlos.
La sal disodio se puede preparar del solvato de etanol al evaporar o secar el solvato de etanol por métodos conocidos en la técnica para formar la sal disodio anhidra. El secado se lleva a cabo generalmente en una temperatura de aproximadamente 80 a aproximadamente 120ºC, preferiblemente de aproximadamente 85 a aproximadamente 90ºC, y más preferiblemente a aproximadamente 85ºC. La etapa de secado se desarrolla generalmente a una presión de 26'' Hg o más. La sal disodio anhidra contiene generalmente menos de aproximadamente 5% en peso de etanol y preferiblemente menos de aproximadamente 2% en peso de etanol, con base en 100% del peso total de sal disodio anhidra.
La sal disodio de ácido N-(5-clorosaliciloil)-8-aminocaprílico también se puede preparar al hacer una suspensión de ácido N-(5-clorosaliciloil)-8-aminocaprílico en agua y agregar dos equivalentes molares de hidróxido de sodio acuoso, alcóxido de sodio o similares. Los alcóxidos de sodio adecuados incluyen, pero no se limitan a, metóxido de sodio, etóxido de sodio, y combinaciones de los mismos.
Todavía un método adicional para preparar la sal disodio es al hacer reaccionar ácido N-(5-clorosaliciloil)-8-aminocaprílico con un equivalente molar de hidróxido de sodio para formar una sal monosodio y luego se agrega un equivalente molar adicional de hidróxido de sodio para producir la sal disodio.
La sal disodio se puede aislar como un sólido al concentrar la solución que contiene la sal disodio en una pasta espesa mediante destilación por vacío. Esta pasta se puede secar en horno de vacío para obtener la sal disodio de ácido N-(5-clorosaliciloil)-8-aminocaprílico como un sólido. El sólido también se puede aislar al secar por rociado una solución acuosa de la sal disodio.
Los solvatos de etanol, como se describe...
Reivindicaciones:
1. Una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento de una hormona paratiroide (PTH) y ácido N-(5-clorosaliciloil)-8-aminocaprílico (5-CNAC), dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41), con la condición que una composición tampoco comprende calcitonina y con la condición que una cápsula comprende 800 µg de PTH (1-34) y 400 mg de sal disodio de 5-CNAC se excluya específicamente.
2. Una composición farmacéutica para suministro oral que comprende una cantidad terapéuticamente efectiva de un fragmento de una hormona paratiroide (PTH) y ácido N-(5-clorosaliciloil)-8-aminocaprílico (5-CNAC), dicho fragmento PTH se selecciona de PTH (1-28) a PTH (1-41), en donde la composición farmacéutica está en la forma de un comprimido, capsuleta, polvo o gránulos, con la condición que una composición tampoco comprende calcitonina.
3. Una composición farmacéutica de acuerdo con la reivindicación 1 o la reivindicación 2 en donde el PTH se selecciona de PTH (1-28), PTH (1-31), PTH (1-34), PTH (1-37), PTH (1-38) y PTH (1-41).
4. Una composición farmacéutica de acuerdo con la reivindicación 1 o la reivindicación 2 en donde el PTH es PTH (1-34).
5. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 3 en donde el PTH es hormona paratiroide humana.
6. Una composición farmacéutica de acuerdo con la reivindicación 5 en donde la hormona paratiroide humana es hPTH (1-34).
7. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones precedentes en donde el PTH es recombinante.
8. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones precedentes en donde el 5-CNAC se selecciona del ácido libre, la sal disodio de ácido N-(5-clorosaliciloil)-8-aminocaprílico y el monohidrato del mismo.
9. Una composición farmacéutica de acuerdo con la reivindicación 8 en donde el 5-CNAC es la sal disodio de ácido N-(5-cloro-salicioil)-8-aminocaprílico.
10. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 9 para uso en tratar o evitar una afección ósea asociada con eliminación o resorción de calcio incrementada.
11. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 9 para uso en estimular la nueva formación ósea.
12. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 9 para uso en tratar o evitar la osteoporosis.
Patentes similares o relacionadas:
Derivados de amida de aminoácidos N-urea sustituidos como moduladores del receptor análogo al receptor 1 de péptido formilado (FPRL-1), del 1 de Julio de 2020, de ALLERGAN, INC.: Compuesto para usar en el tratamiento de un trastorno asociado con la modulación del receptor análogo al receptor 1 de péptido N-formilado representado por la fórmula […]
Formulaciones líquidas de levotiroxina, del 17 de Junio de 2020, de TAP Pharmaceuticals AG: Una disolución farmacéutica que comprende: - de 0,001 % p/v a 0,01 % p/v de una levotiroxina; - al menos 70 % p/p de glicerol; - menos del 30 % p/p […]
Composiciones dietéticas y métodos de protección contra la quimioterapia o radioterapia, del 17 de Junio de 2020, de University Of Southern California, USC Stevens: Una composición dietética para su uso en un método de protección de un animal o humano contra la quimioterapia o radioterapia, incluida la administración […]
Composiciones de polifenol, del 3 de Junio de 2020, de Nugerontix Limited: Enoteína B para uso en terapia para tratar, prevenir o retrasar la aparición de disfunción endotelial donde el tratamiento, prevención o retraso comprende […]
Derivados de celastrol para el tratamiento de la obesidad, del 3 de Junio de 2020, de THE CHILDREN'S MEDICAL CENTER CORPORATION: Una formulación farmacéutica para su uso en inducir pérdida de peso o reducir la grasa corporal, o una combinación de las mismas, en un paciente pre-obeso, obeso […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Formulaciones farmacéuticas que incluyen un compuesto de amina, del 13 de Mayo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un comprimido revestido que comprende: (a) un núcleo de comprimido en donde el núcleo de comprimido comprende (i) opcionalmente al menos un agente antidiabético […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]