MICROPARTICULAS QUE COMPRENDEN ANALOGOS DE SOMATOSTATINA.
Micropartículas que comprenden ciclo[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] en forma libre,
en forma de sal o en forma protegida, embebido en una matriz de polímero en donde la matriz de polímero comprende un poliláctido-co-glicólido lineal y uno ramificado
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/012870.
Solicitante: NOVARTIS AG
NOVARTIS PHARMA GMBH.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: AHLHEIM,MARKUS, AUSBORN,MICHAEL, LAMBERT,OLIVIER, RIEMENSCHNITTER,MARC.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K38/31 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Somatostatinas.
- A61K9/16H6D4
Clasificación PCT:
Clasificación antigua:
Fragmento de la descripción:
Micropartículas que comprenden análogos de somatostatina.
La presente invención se refiere a micropartículas que comprenden el análogo de somatostatina ciclo[{4-(NH2-C2H4-NHCO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] (denominado en la presente memoria Compuesto A o compuesto de la invención) y a composiciones farmacéuticas que comprenden el mismo.
La somatostatina es un tetradecapéptido que tiene la estructura

Análogos de somatostatina de particular interés se han descrito, p. ej., en WO 97/01579 y WO 02/10192. Dichos análogos de somatostatina comprenden la secuencia de aminoácidos de fórmula
en la que X1 es un radical de fórmula (a) o (b)

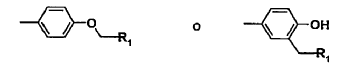
Por análogo de somatostatina, según se usa en la presente memoria, se entiende un péptido de cadena lineal o cíclico derivado del de la somatostatina-14 presente en la naturaleza, que comprende la secuencia de fórmula I y en el que adicionalmente una o más unidades de aminoácido se han omitido y/o reemplazado por uno o más de otro u otros radicales aminoácido y/o en el que uno o más grupos funcionales se han reemplazado por uno o más de otros grupos funcionales y/o uno o más grupos se han reemplazado por uno o varios otros grupos isósteros. En general, el término cubre todos los derivados modificados de la somatostatina-14 natural que comprende la secuencia anterior de fórmula I que tienen afinidad de unión en el intervalo nM a al menos un subtipo de receptor de somatostatina como el definido anteriormente en la presente memoria.
El compuesto de la invención en forma protegida corresponde al Compuesto A en el que al menos uno de los grupos amino está protegido y que mediante desprotección conduce a un compuesto de fórmula II o III, preferiblemente fisiológicamente retirable. Grupos protectores de amino adecuados se divulgan, p. ej., en "Protective Groups in Organic Synthesis", T. W. Greene, J. Wiley & Sons NY (1981), 219-287. Un ejemplo de tal grupo protector de amino es acetilo.
El Compuesto A puede existir, p. ej., en forma libre o de sal. Las sales incluyen sales de adición de ácidos con, p. ej., ácidos inorgánicos, ácidos polímeros o ácidos orgánicos, por ejemplo con ácido clorhídrico, ácido acético, ácido láctico, ácido aspártico, ácido benzoico, ácido succínico o ácido pamoico. Las sales de adición de ácidos pueden existir como sales mono- o divalentes, p. ej., dependiendo de si se añaden 1 ó 2 equivalentes de ácido. Sales preferidas, p. ej. para el Compuesto A, son el lactato, aspartato, benzoato, succinato y pamoato, incluyendo mono- y di-sales, más preferiblemente la disal de aspartato y la monosal de pamoato.
Los compuestos de la invención pueden prepararse de acuerdo con métodos convencionales.
Típicamente, los compuestos de la invención se aportan sistémicamente, p. ej. parenteralmente. Sin embargo, la administración parenteral puede ser muy dolorosa, especialmente en la administración repetida. Para minimizar el número de inyecciones a un paciente, debe administrarse una formulación de depósito adecuada.
Se ha encontrado que la administración de micropartículas que comprenden un Compuesto A, p. ej. embebido en un polímero farmacológicamente aceptable biocompatible, suspendido en un vehículo adecuado da una liberación de la totalidad o de sustancialmente la totalidad del agente activo durante un período de tiempo prolongado, p. ej. de varias semanas hasta 6 meses, preferiblemente durante al menos 4 semanas.
De acuerdo con esto, la presente invención proporciona micropartículas que comprenden un compuesto de la invención, p. ej. embebido en un polímero farmacológicamente aceptable biocompatible, y una formulación farmacéutica de depósito que comprende dichas micropartículas.
El compuesto de la invención puede estar presente en una cantidad de aproximadamente 1 a aproximadamente 60%, más habitualmente de aproximadamente 10 a aproximadamente 50%, preferiblemente de aproximadamente 20 a aproximadamente 40%, aún más preferiblemente de aproximadamente 25% a aproximadamente 35%, en peso del peso seco de las micropartículas.
Preferiblemente, el compuesto de la invención usado para preparar las micropartículas es un polvo amorfo que tiene una partícula de un tamaño de aproximadamente 0,1 micras a aproximadamente 15 micras, preferiblemente menos de aproximadamente 5 micras, aún más preferiblemente menos de aproximadamente 3 micras.
La distribución de tamaños de partícula del compuesto de la invención puede influir en el perfil de liberación del fármaco desde las micropartículas. Típicamente, cuanto más pequeño es el tamaño de partícula, menor es la descarga inicial y la liberación durante la primera fase de difusión, p. ej. los 20 primeros días. Preferiblemente, la distribución de tamaños de partícula es, p. ej. x10 < 0,8 micras, es decir 10% de las partículas son menores de 0,8 micras; x50 < 1,5 micras, es decir 50% de las partículas son menores de 1,5 micras; o x90 < 3,0 micras, es decir 90% de las partículas son menores de 3,0 micras.
La matriz de polímero de las micropartículas puede ser un polímero sintético o natural. El polímero puede ser uno biodegradable o no biodegradable o una combinación de polímeros biodegradables y no biodegradables, preferiblemente biodegradables.
Por "polímero" se entiende un homopolímero o un copolímero.
La matriz de polímero está diseñada para degradarse suficientemente para ser transportada desde la zona de administración en de uno a 6 meses después de la liberación de todo o sustancialmente todo el agente activo.
Polímeros adecuados incluyen
Reivindicaciones:
1. Micropartículas que comprenden ciclo[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] en forma libre, en forma de sal o en forma protegida, embebido en una matriz de polímero en donde la matriz de polímero comprende un poliláctido-co-glicólido lineal y uno ramificado.
2. Micropartículas de acuerdo con la reivindicación 1, en las que el ciclo[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] está en forma de sal de pamoato.
3. Micropartículas de acuerdo con la reivindicación 3, en las que la matriz de polímero comprende un polímero Resomer® RG y un polímero de estrella de poliláctido-co-glicólido que tiene un peso molecular promedio ponderado de aproximadamente 50.000 Da.
4. Micropartículas de acuerdo con la reivindicación 4, en las que la relación de poliláctido-co-glicólido lineal a ramificado es 50:50.
5. Micropartículas de acuerdo con cualquier reivindicación precedente, en las que el ciclo[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] es un polvo amorfo que tiene un tamaño de partícula menor de aproximadamente 5 micras.
6. Micropartículas de acuerdo con cualquier reivindicación precedente, que comprenden además un tensioactivo, un agente que influye en la porosidad y/o una sal básica.
7. Una composición farmacéutica que comprende micropartículas de acuerdo con cualquier reivindicación precedente y un vehículo basado en agua que comprende un agente humectante.
8. Una composición de acuerdo con la reivindicación 7, en la que el agente humectante comprende un poloxámero y/o un éster de ácido graso de polioxietilen-sorbitán.
9. Una composición de acuerdo con una cualquiera de las reivindicaciones 7 u 8, en la que el vehículo comprende un agente de tonicidad.
10. Una composición de acuerdo con una cualquiera de las reivindicaciones 7 u 8, en la que el vehículo comprende un agente que incrementa la viscosidad.
11. Un estuche que comprende micropartículas de acuerdo con una cualquiera de las reivindicaciones 1 a 8 y un vehículo basado en agua.
12. Uso de micropartículas de acuerdo con una cualquiera de las reivindicaciones 1 a 8 o de una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 7 a 10 para la preparación de un medicamento para el tratamiento de una enfermedad o trastorno con una etiología que comprende o está asociada con la secreción de GH y/o IGF-1 en exceso.
Patentes similares o relacionadas:
Procedimientos de tratamiento de encefalopatía hepática, del 11 de Diciembre de 2019, de Salix Pharmaceuticals, Ltd: Rifaximina para su uso en la disminución del riesgo de un sujeto de episodios importantes de encefalopatía hepática (EH) en un sujeto que padece EH o en un sujeto con […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Formulación de liberación sostenida que comprende octreótido y dos o más polímeros de poliláctido-co-glicólido, del 14 de Agosto de 2019, de NOVARTIS AG: Una composición farmacéutica de liberación sostenida en forma de micropartículas que comprenden como principio activo octreótido o una sal farmacéuticamente […]
Composiciones de liberación controlada, del 5 de Junio de 2019, de Evonik Corporation: Una composición que comprende un agente bioactivo y un polímero en una fase orgánica que contiene uno o más disolventes; y un ion orgánico en una fase acuosa, en […]
Terapia de combinación para el tratamiento del cáncer, del 27 de Marzo de 2019, de Tyme, Inc: Una terapia de combinación que comprende: un inhibidor de la tirosina hidroxilasa que es α-metil-DL-tirosina; un promotor de melanina que es melanotan […]
Proceso para la preparación de composiciones farmacéuticas para la liberación sostenida de análogos de somatostatina, del 11 de Abril de 2018, de IPSEN PHARMA S.A.S: Un proceso para la preparación de una composición farmacéutica de liberación sostenida inyectable, que comprende las etapas de: * combinar una sal de análogo […]
Fármaco para prevenir y/o tratar enfermedad renal poliquística, del 22 de Noviembre de 2017, de OTSUKA PHARMACEUTICAL CO., LTD.: Un fármaco para prevenir y/o tratar enfermedad renal poliquística que comprende una combinación de tolvaptán o un profármaco del mismo con un derivado de somatostatina, en el […]
Inyección de octreótido, del 8 de Noviembre de 2017, de Sun Pharmaceutical Industries LTD: Un dispositivo de inyección de pluma de múltiples dosis que comprende un depósito de una solución estéril que comprende de 2 mg a 20 mg de acetato de octreótido por […]