Procedimiento sintético de alta pureza para la preparación de intermediarios de éster de ácido dodecahidro-nafto-furanil carbámico.
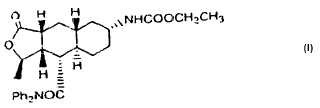
Un procedimiento para proporcionar una forma purificada, precipitada del compuesto de Fórmula I,
comprendiendo el procedimiento:
a. proporcionar una solución saturada que comprende el compuesto de Fórmula I en un disolvente quecomprende sustancialmente acetona o 2-metil-tetrahidrofurano (2-Me-THF), a una primera temperatura, en elque la primera temperatura se encuentra por encima de temperatura ambiente y está seleccionada para que seencuentre dentro del intervalo apropiado para formar una suspensión que comprende cristales del compuesto deFórmula I y mantener la solución en dicha primera temperatura durante un período de tiempo suficiente paraformar una suspensión del compuesto de Fórmula I, al tiempo que, de manera opcional, se agita la mezcla;
b. de manera opcional reducir la temperatura de la suspensión formada en la Etapa "a" hasta una segundatemperatura, en la que dicha segunda temperatura se encuentra por debajo de temperatura ambiente;
c. de manera opcional agitar la suspensión a partir de la etapa "b" al tiempo que se mantiene a dicha segundatemperatura durante un período de tiempo suficiente para precipitar un producto cristalino que presenta menosde 3,0 % en moles de impurezas y que comprende al menos 80% del compuesto de Fórmula I inicialmentepresente en la solución proporcionada en la Etapa "a"; y
d. de manera opcional, aislar el producto cristalino precipitado en la Etapa "c".
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/080699.
Solicitante: MERCK SHARP & DOHME CORP.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 126 EAST LINCOLN AVENUE RAHWAY, NJ 07065-0907 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WANG, TAO, LIAO,JING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D307/92 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › Naftofuranos; Naftofuranos hidrogenados.
PDF original: ES-2398502_T3.pdf
Fragmento de la descripción:
Procedimiento sintético de alta pureza para la preparación de intermediarios de éster de ácido dodecahidro-naftofuranil carbámico Campo de la Invención La presente aplicación describe un nuevo procedimiento para preparar compuestos de éster furanil carbámico de Fórmula Ia con alta pureza, que presentan utilidad, por ejemplo, como intermediarios en la preparación de compuestos análogos de himbacina activos farmacéuticamente.
Antecedentes de la Invención La identificación de cualquier publicación en la presente sección o cualquier sección de la presente solicitud no es una admisión de que dicha publicación pertenezca a la técnica anterior de la presente invención La patente de Estados Unidos Nº. 6.063.847 describe análogos de himbacina conocidos por actuar como antagonistas del receptor de trombina que presentan actividad farmacéutica útil, por ejemplo, el compuesto de Fórmula II.
En algunos esquemas de preparación un compuesto de Fórmula Ia, por ejemplo, el compuesto de Fórmula I,
es un intermedio crítico en la preparación de compuestos análogos de himbacina que presentan propiedades farmacéuticas deseables, por ejemplo, el compuesto de Fórmula II. La Solicitud de Patente de Nº. de Serie 20 11/331.324, presentada el 2 de Enero de 2006 y publicada bajo la Publicación Nº. 2006/0247450 (la publicación 450) , describe en el Ejemplo 7 la preparación del compuesto de Fórmula II a partir del compuesto de Fórmula I. La preparación de los compuestos de intermedio de Fórmula Ia a partir de materiales de partida disponibles comercialmente se ha conseguido usando síntesis de multi-etapa, por ejemplo, como se describe en la publicación 450, página 13, párrafo [0074] a página 16, párrafo [0078]. Por ejemplo, la publicación 450 describe en la página 8,
la preparación de compuestos de Fórmula Ia de acuerdo con el Esquema I, La pureza de los compuestos de Fórmula Ia proporcionados por medio del procedimiento descrito en la publicación 450 es altamente sensible a la pureza del compuesto precursor de Fórmula Ic (Esquema de referencia I) usado en el procedimiento preparativo. Para un ejemplo, véase la publicación 450 del Ejemplo 7, que comienza en el párrafo [0098]. Cuando se sintetiza de acuerdo con la publicación 450, el producto que comprende el compuesto de Fórmula I requiere un número de recristalizaciones hasta proporcionar de manera consistente el compuesto de Fórmula I que tenía una pureza de estable usada en la síntesis de los compuestos de Fórmula II. Sin purificación, el rendimiento y las propiedades de manipulación del compuesto objetivo también se ven reducidos en gran medida.
El documento 2006/076452 también divulga un procedimiento para la preparación de análogos de himbacina. De manera más particular, el compuesto de Fórmula I se obtiene por medio de hidrogenación del doble enlace de un ácido carbámico seguido de purificación por medio de cromatografía en columna.
Objetivos y Sumario de la Invención A la vista de lo anterior, lo que se necesita es un procedimiento para preparar de manera consistente cantidades de alta pureza de los compuestos intermediarios de Fórmula Ia, por ejemplo, el compuesto de Fórmula I. Además, lo 15 que se necesita es un procedimiento para proporcionar compuestos de Fórmula Ia en los que la pureza del producto sea menos sensible a la pureza de los materiales de precursor y que se minimice la necesidad de las etapas de recristalización para proporcionar de manera consistente compuestos de Fórmula Ia con alta pureza. Lo que se necesita es un procedimiento para proporcionar el compuesto de Fórmula I que se pueda adaptar al tamaño del lote apropiado para la preparación a escala comercial. La presente invención proporciona estos y otros objetivos y/o ventajas.
Un aspecto preferido de la presente invención es un procedimiento para proporcionar una forma purificada del compuesto de Fórmula Ia,
comprendiendo el procedimiento,
a) proporcionar una solución saturada que comprende el compuesto de Fórmula I en un disolvente que comprende sustancialmente acetona o 2-metil-tetrahidrofurano (2-Me-THF) , a una primera temperatura, en la que la primera temperatura se encuentra por encima de temperatura ambiente y está seleccionada para que se encuentre dentro del intervalo apropiado para formar una suspensión que comprende cristales del compuesto de Fórmula I y mantener la solución en dicha primera temperatura durante un período de tiempo suficiente para formar una suspensión del compuesto de Fórmula I, al tiempo que, de manera opcional, se agita la mezcla;
(b) de manera opcional reducir la temperatura de la suspensión formada en la Etapa "a" hasta una segunda
temperatura, en la que dicha segunda temperatura se encuentra por debajo de temperatura ambiente;
(c) de manera opcional agitar la suspensión a partir de la etapa "b" al tiempo que se mantiene a dicha segunda temperatura durante un período de tiempo suficiente para precipitar un producto cristalino que presenta menos de 3, 0 % en moles, preferentemente menos de 2, 0% en moles de impurezas y que comprende al menos 80% del
compuesto de Fórmula I inicialmente presente en la solución proporcionada en la Etapa "a"; y
(d) de manera opcional, aislar el producto cristalino precipitado en la Etapa "c"
En algunas realizaciones, es preferible proporcionar el compuesto purificado de Fórmula Ia, en forma de solvato. En algunas realizaciones, es preferible seleccionar en la etapa "b" una segunda temperatura desde -5º C hasta +10 ºC. En algunas realizaciones, es preferible reducir la temperatura de la suspensión en la etapa "b" desde dicha primera temperatura hasta dicha segunda temperatura durante un período de hasta 3 horas, preferentemente desde 1 a 3 horas. En algunas realizaciones que emplean la etapa opcional "c", es preferible llevar a cabo agitación durante un período de 1 a 2 horas. En algunas realizaciones, es preferible proporcionar el precipitado aislado en forma de solvato.
En algunas realizaciones, es preferible llevar a cabo el presente procedimiento para proporcionar una forma purificada del compuesto de Fórmula I usando acetona como disolvente de purificación, proporcionando de este modo una forma de monosolvato de acetona cristalino del compuesto de Fórmula I en el que el producto de monosolvato cristalino proporciona un espectro de RMN en cloroformo deuterado que presenta las siguientes características, RMN1H (CDCl3) ! 7 25-7 55 (m, 10H) , 4, 89 (m, 1H) , 4, 51 (sa, 1H) , 4, 09 (d, J= 6, 98 Hz, 2H) , 3, 49 (sa, 1H) , 2, 41 (m 2H) , 2, 25 (m, 1H) , 2 19 (s, 6H acetona) , 2 06 (d, J = 10, 8 Hz, 2H) , 1, 96 (d J = 10, 9 Hz, 1H) , 1 83 (ddd, J
= 13, 5 6, 09, 2 51 Hz, 1H) 1 63 (m, 1H) , 1, 52 (d, J = 5, 8 Hz, 3H) , 1 23 (m, 5H) , 1 17 (q J = 11, 5Hz, 2H) , 0 92 (q J= 11, 5 Hz 1H) .
En algunas realizaciones es preferible llevar a cabo el presente procedimiento para proporcionar una forma purificada del compuesto de Fórmula I, usando 2-metil-tetrahidrofurano (2-Me-THF) como agente de purificación, proporcionando de este modo una forma de monosolvato de 2-Me-THF cristalino del compuesto de Fórmula I, en el 25 que el producto de monosolvato cristalino proporciona un espectro de RMN en cloroformo deuterado que presenta la siguientes características RMN1H (CDCl3) ! 7, 25-7, 55 (m, 10H) , 4, 89 (m, 1H) , 4, 51 (sa, 1H) , 4, 09 (d, J= 6, 98 Hz, 2H) , 3, 98-3, 86 (m, 2H, 2-Me-THF) , 3, 73-3, 68 (m, 1H, 2-Me-THF) , 3, 49 (sa, 1H) , 2, 41 (m, 2H) , 2, 25 (m, 1H) , 2, 06 (d, J= 10, 8 Hz, 2H) , 1, 96 (d, J= 10, 9 Hz, 1H) , 1, 92-1, 79 (m, 3H, 2-Me-THF) , 1, 83 (ddd, J=13, 5, 6, 09, 2, 51 Hz, 1H) , 1, 63 (m, 1H) , 1, 52 (d, J=5, 8 Hz, 3H) , 1, 45-1, 36 (m, 1H, 2-metil-THF) , 1, 23 (m, 5H) , 1, 22 (d, 3H, 2-Me-THF) , 1, 17 (q, J=11, 5
Hz, 2H) , 0, 92 (q, J= 11, 5 Hz, 1H) .
En una realización, el procedimiento de precipitación se incorpora a un procedimiento de síntesis del compuesto de Fórmula Ia de acuerdo con el Esquema II,
comprendiendo el procedimiento
(i) proporcionar una solución de THF del compuesto de Fórmula Ib;
(ii) formar la amida de Fórmula Ia en una mezcla de reacción proporcionada por medio de tratamiento de la solución de THF de la etapa (i) primero con etilcloroformiato y añadiendo posteriormente trietil amina;
(iii) tratar la mezcla de reacción de la etapa (ii) añadiendo volúmenes iguales de agua y éter de metilo y tbutilo (MTBE) y posteriormente separando las fases orgánica y acuosa resultantes;
(iv) mezclar la fase orgánica separada procedente de la etapa "iii" con un volumen igual de agua y una alícuota de una solución de base de carbonato;
(v) ajustar el pH de la mezcla proporcionada... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para proporcionar una forma purificada, precipitada del compuesto de Fórmula I,
comprendiendo el procedimiento:
a. proporcionar una solución saturada que comprende el compuesto de Fórmula I en un disolvente que comprende sustancialmente acetona o 2-metil-tetrahidrofurano (2-Me-THF) , a una primera temperatura, en el que la primera temperatura se encuentra por encima de temperatura ambiente y está seleccionada para que se encuentre dentro del intervalo apropiado para formar una suspensión que comprende cristales del compuesto de Fórmula I y mantener la solución en dicha primera temperatura durante un período de tiempo suficiente para formar una suspensión del compuesto de Fórmula I, al tiempo que, de manera opcional, se agita la mezcla;
b. de manera opcional reducir la temperatura de la suspensión formada en la Etapa "a" hasta una segunda temperatura, en la que dicha segunda temperatura se encuentra por debajo de temperatura ambiente;
c. de manera opcional agitar la suspensión a partir de la etapa "b" al tiempo que se mantiene a dicha segunda temperatura durante un período de tiempo suficiente para precipitar un producto cristalino que presenta menos
de 3, 0 % en moles de impurezas y que comprende al menos 80% del compuesto de Fórmula I inicialmente presente en la solución proporcionada en la Etapa "a"; y
d. de manera opcional, aislar el producto cristalino precipitado en la Etapa "c".
2. El procedimiento de la reivindicación 1 en el que, cuando la etapa "c" se lleva a cabo, se pone en práctica a una segunda temperatura y durante un período de tiempo suficiente para precipitar un producto cristalino que tiene 20 menos de 2, 0% en moles de impurezas.
3. El procedimiento de la reivindicación 2 en el que, dicha primera temperatura es una temperatura entre 45 ºC y 60 ºC.
4. El procedimiento de la reivindicación 3, en el que dicha segunda temperatura es una temperatura de -5 ºC a + 10 ºC.
5. El procedimiento de la reivindicación 4, en el que la solución de la Etapa "a" se mantiene a dicha primera temperatura durante 1 hora.
6. El procedimiento de la reivindicación 5, en el que el período de tiempo durante el cual la temperatura se reduce desde dicha primera temperatura hasta dicha segunda temperatura de la Etapa "b" es un período de 3 horas.
7. El procedimiento de la reivindicación 6 en el que, la solución de la Etapa "a" se proporciona por medio de adición
de un disolvente de purificación que es acetona o 2-metil-tetrahidrofurano a una solución que comprende: el compuesto de Fórmula I; metil butil éter terciario; y tetrahidrofurano, y destilar los volátiles hasta que el disolvente restante sea sustancialmente el disolvente de purificación.
8. Un procedimiento de síntesis del compuesto de Fórmula Ia comprendiendo el procedimiento (a) proporcionar una solución de THF del compuesto de Fórmula Ib;
(b) formar la amida de Fórmula Ia en una mezcla de reacción proporcionada por medio de tratamiento de la solución de THF de la Etapa "a" primero con etilcloroformiato y añadiendo posteriormente trietil amina;
(c) tratar la mezcla de reacción de la Etapa "b" añadiendo volúmenes iguales de agua y éter de metilo y t5 butilo (MTBE) y posteriormente separando las fases orgánica y acuosa resultantes;
(d) mezclar la fase orgánica separada procedente de la Etapa "c" con un volumen igual de agua y un alícuota de una solución de base de carbonato;
(e) ajustar el pH de la mezcla proporcionada en la Etapa "d" con un ácido acuoso hasta un pH desde pH 6 hasta pH 7, 5 y separar las partes acuosa y orgánica de la mezcla;
(f) modificar el disolvente en la fase orgánica separada obtenida en la Etapa "e" por medio de un procedimiento que comprende:
(i) mezclar un disolvente de purificación con la fase orgánica separada obtenida en la Etapa "e", en la que el disolvente de purificación es acetona o 2-Me-THF,
(ii) destilar azeotrópicamente la mezcla de la etapa "f (i) " hasta que se concentra; y
c) repetir las etapas "f (i) " y "f (ii) " hasta que el disolvente de la mezcla de la etapa "f (ii) " comprenda sustancialmente el disolvente de purificación; y
(g) enfriar la fase proporcionada en la Etapa "f (iii) " precipitando de este modo una forma de solvato sustancialmente puro del compuesto de Fórmula Ia.
9. El procedimiento de la reivindicación 8, en el que el compuesto de Fórmula Ib se proporciona por medio de 20 hidrogenación del compuesto de Fórmula Ic,
usando un catalizador de paladio y un medio de reacción mixto de agua/THF.
10. El procedimiento de la reivindicación 9, en el que R1 y R2 son en cada aparición fenilo, y por tanto el compuesto de Fórmula Ia formado es el compuesto de Fórmula I,
11. El procedimiento de la reivindicación 10, en el que, en la Etapa "d", la solución de base de carbonato es una solución acuosa de bicarbonato de sodio al 5%.
12. El procedimiento de la reivindicación 11 en el que, en la Etapa "e", el ácido acuoso usado para ajustar el pH de la solución es una solución acuosa de ácido sulfúrico.
13. El procedimiento de la reivindicación 12 en el que, dicha parte orgánica separada formada en la etapa "e" se concentra por medio de destilación del disolvente antes de añadir el disolvente de purificación en la Etapa "f".
14. El procedimiento de la reivindicación 13 en el que la Etapa "g", etapa de enfriamiento, comprende: (i) ajustar la temperatura de dicha fase orgánica preparada en la etapa "f" hasta una primera temperatura, en el que la primera temperatura es una temperatura por encima de temperatura ambiente y está seleccionada para permitir la formación de una suspensión que comprende el compuesto de Fórmula Ia, y mantener dicha fase orgánica modificada a dicha primera temperatura durante un período de tiempo suficientemente largo para formar una suspensión que comprenda el compuesto de Fórmula Ia; y (ii) ajustar la temperatura de la suspensión formada en la etapa "i" hasta una segunda temperatura, en la que dicha segunda temperatura se encuentra por debajo de temperatura ambiente, y mantener la suspensión a una temperatura durante un período de tiempo suficiente para producir un producto cristalino que tiene menos de 2, 0% en moles de impurezas y que comprende al menos 80% del compuesto de Fórmula Ia inicialmente presente en dicha fase orgánica modificada preparada en la etapa "f".
15. El procedimiento de la reivindicación 14 en el que, dicha primera temperatura es una temperatura de 45 ºC a 60 ºC.
16. El procedimiento de la reivindicación 15 en el que, durante la etapa "g (i) ", se agita la suspensión.
17. El procedimiento de la reivindicación 16 que además comprende aislar los sólidos precipitados de la etapa "g (ii) ".
18. El procedimiento de la reivindicación 16, en la que dicha segunda temperatura es de (-5 ºC) a (+10) ºC.
19. El procedimiento de la reivindicación 18 en el que, la temperatura de la suspensión se ajusta en la etapa "g (ii) " desde dicha primera temperatura hasta dicha segunda temperatura durante un período de tres horas.
Patentes similares o relacionadas:
Derivados de naftofurano para uso como agentes antineoplásicos, del 18 de Marzo de 2020, de KYOTO PHARMACEUTICAL INDUSTRIES, LTD.: Un compuesto representado por la fórmula (IA): **(Ver fórmula)** en donde R1 en el número de n son cada uno en forma independiente […]
Compuestos de ácido 2-(alcoxi o ariloxi carbonil)-4- metil- 6-(2,6,6 -trimetilciclohex-1-enil)hex -2-enoico, su preparación y su utilización, del 18 de Abril de 2018, de GIVAUDAN SA: Compuesto de fórmula 1**Fórmula** en el que R es hidrógeno, alquilo o arilo, y en el que el doble enlace en la cadena lateral del compuesto 1 está en la posición α,β, […]
PROCESO DE SÍNTESIS DE AMBROX A PARTIR DE 13,14,15,16-TETRANOR-8¿,12-LABDANODIOL, del 27 de Abril de 2017, de UNIVERSIDAD MICHOACANA DE SAN NICOLÁS DE HIDALGO: La presente invención se refiere a un proceso de síntesis del compuesto (±)-ambrox a partir del compuesto (±) 13,14,15,16- tetranor-8a,12-labdanodiol, […]
PROCESO DE SÍNTESIS DE AMBROX A PARTIR DE AGERATINA JOCOTEPECANA, del 27 de Abril de 2017, de UNIVERSIDAD MICHOACANA DE SAN NICOLÁS DE HIDALGO: La presente invención se refiere a un proceso de obtención del compuesto (¿)- 13,14,15,16-tetranor-8¿,12-labdanodiol a partir de la planta Ageratina jocotepecana, […]
Procedimiento para la preparación de (3E, 7E)-homofarnesol, del 10 de Agosto de 2016, de BASF SE: Procedimiento para la producción de compuestos de la fórmula general I**Fórmula** en la que R1 representa un radical hidrocarburo con 1 a 50 átomos de carbono, […]
Ésteres beta-gamma insaturados y su proceso de producción, del 6 de Mayo de 2015, de GIVAUDAN SA: Procedimiento para la preparación de ésteres b,g-insaturados-g,g-disustituidos 1,**Fórmula** comprendiendo dicho procedimiento la etapa […]
Compuestos regioespecíficos de furano y su uso en perfumes, del 11 de Marzo de 2015, de INTERNATIONAL FLAVORS & FRAGRANCES INC.: Proceso para preparar una mezcla diastereoisómera de la siguiente fórmula:**Fórmula** que comprende las siguientes etapas: someter un compuesto de la […]
Procedimiento de preparación de derivados de tetranorlabdano, del 25 de Febrero de 2015, de FIRMENICH S.A.: Un procedimiento de preparación de un furano de fórmula (I), o (I')**Fórmula** en la forma de un diastereoisómero racémico u ópticamente activo, […]