Derivados de pirrolopirimidina sustituidos, procedimiento para su preparación y su uso como inhibidores de quinasas.
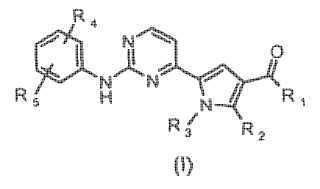
Un compuesto de fórmula (I): **Fórmula**
donde:
R1 es -OR' o NR'R",
donde R' y R" son, cada uno independientemente, hidrógeno o un grupo sustituidoopcionalmente seleccionado entre alquilo C1-C6 lineal o ramificado, alquenilo C2-C6, alquinilo C2-C6,cicloalquilo C3-C6 y heterociclilo;
R2 es hidrógeno, o
R1 y R2 tomados juntos son una cadena de -NH-CH2-CH2- y forman una lactama de 6 miembrosfusionada con el anillo de pirrol;
R3 es un alquilo C1-C6 lineal o ramificado sustituido opcionalmente;
R4 y R5 son, cada uno independientemente halógeno, un grupo -O-R3, o un grupo sustituidoopcionalmente seleccionado entre alcoxi polifluorado y heterociclilo, donde R3 se define como antes;
y sus sales farmacéuticamente aceptables.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/062853.
Solicitante: NERVIANO MEDICAL SCIENCES S.R.L..
Nacionalidad solicitante: Italia.
Dirección: VIALE PASTEUR, 10 20014 NERVIANO (MI) ITALIA.
Inventor/es: BRASCA, MARIA, GABRIELLA, BERIA, ITALO, CALDARELLI, MARINA, CARUSO, MICHELE, POSTERI,Helena, CECCARELLI,WALTER, VALSASINA,BARBARA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/506 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensadas y conteniendo otros heterociclos.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D401/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › que contienen tres o más heterociclos.
- C07D403/04 C07D […] › C07D 403/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos por el grupo C07D 401/00. › unidos directamente por un enlace entre dos miembros cíclicos.
- C07D471/04 C07D […] › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
PDF original: ES-2389673_T3.pdf
Fragmento de la descripción:
Derivados de pirrolopirimidina sustituidos, procedimiento para su preparación y su uso como inhibidores de quinasas
La presente invención se refiere a ciertos compuestos de pirrolo-pirimidina sustituidos, que modulan la actividad de las proteína quinasas. Los compuestos de esta invención su útiles por lo tanto en el tratamiento de enfermedades causadas por la actividad no regulada de proteína quinasas. La presente invención también proporciona métodos para la preparación de estos compuestos, composiciones farmacéuticas que comprenden estos compuestos. También se describen métodos para el tratamiento de enfermedades utilizando composiciones farmacéuticas que comprenden estos compuestos.
El uso de inhibidores mitóticos en la terapia del cáncer es una estrategia clínica ampliamente aceptada para el tratamiento de un amplio espectro de cánceres humanos. Los taxanos (Paclitaxel y Docetaxel) y los alcaloides de Vinca (Vincristina y Vinblastina) funcionan estabilizando o desestabilizando los microtúbulos con consecuencias catastróficas en las células que progresan a través de mitosis. Estos son agentes terapéuticos de primera línea para diversos tipos tumorales y de segunda línea para cánceres de ovario, mama, pulmón, vejiga y esófago resistentes al cisplatino (Taxanos) . Sin embargo, debido al papel de los microtúbulos en procedimientos tales como el movimiento celular, la fagocitosis y el transporte axónico se observan frecuentemente algunas toxicidades tales como neuropatía periférica con estos agentes. El progreso a través de mitosis es un requerimiento de todas las células proliferantes y por lo tanto las terapias contra el cáncer que tienen dianas en la mitosis son generalmente aplicables a una amplia gama de tipos tumorales. Algunas proteína quinasas juegan papeles clave en la orquestación del ciclo celular y algunas de ellas son ya sujeto de terapias dirigidas en el marco de la oncología incluyendo Cdk-2 y Aurora-A. La fidelidad de la mitosis tiene una importancia fundamental y existen varios "puntos de control" en las células normales para mantener la integridad del cromosoma durante el ciclo celular. Estos puntos de control desaparecen a menudo durante la transformación oncogénica y esto permite que las células cancerosas toleren la aneuploidía y la inestabilidad cromosómica. La inhibición de la mitosis en células tumorales con "puntos de control comprometidos" debe tener consecuencias catastróficas puesto que las células cancerosas intentan llevar adelante una mitosis aberrante.
La familia de quinasas de tipo polo, que comprende 4 serina/treonina quinasas (Plk-1-4) , está implicada predominantemente en la entrada en, el progreso a través de y la salida de la mitosis. Estas quinasas están caracterizadas por tener un dominio quinasa n-terminal y un dominio "Caja Polo" c-terminal, único. Este dominio es responsable del redireccionamiento de la quinasa a diversas estructuras mitóticas (centrosomas, cinetonúcleos, polos de los husos, cuerpo medio) y la regulación temporal y espacial de las Plk es importante para el progreso normal a través de la mitosis (revisado por van Vugt y Medema, en Oncogene 2005, 24 (17) :2844-59; Barr et al, Nat Rev Mol Cell Biol. 2004, 5 (6) :429-40; Dai y Cogswell, Prog Cell Cycle Res. 2003, 5:327-34; Glover et al, Genes Dev. 1998, 12 (24) :3777-87) .
El miembro más caracterizado de la familia es Plk-1 y su actividad ha sido implicada en diversos procedimientos durante la mitosis incluyendo la transición G2/M por medio de la regulación de la actividad de Cdk-1 de múltiples modos (activación de CdC25c, translocación nuclear de ciclina B, inactivación de Myt-1 y Wee-1) (Inoue et al, EMBO
J. 2005, 24 (5) :1057-67; van Vugt et al, J Biol Chem. 2004, 9 (35) :36841-54; Watanabe et al, Proc Natl Acad Sci U S
A. 2004, 101 (13) :4419-24; Nakajima et al, J Biol Chem. 2003, 278 (28) :25277-80; Toyoshima-Morimoto et al, J Biol Chem. 2002, 277 (50) :48884-8; Bartholomew et al, Mol Cell Biol., 2001 21 (15) :4949-59; Qian et al, Mol Biol Cell. 2001, 12 (6) :1791-9; Roshak et al, Cell Signal. 2000, 12 (6) :405-11) ; la maduración y separación del centrosoma; la regulación de la cohesión del brazo cromosómico en la profase y la separación de las cromátidas hermanas en la transición metafase/anafase; la activación del Complejo Promotor de la Anafase para comenzar la salida de la mitosis; la citocinesis. Plk-1 es expresada al alza en algunas células tumorales incluyendo los carcinomas de mama, ovario, pulmón de células no pequeñas, colon, cabeza y cuello, endometrio y esófago y su expresión al alza se correlaciona a menudo con una mala prognosis. La interrupción de la función de Plk-1 por medio de diferentes métodos en células tumorales (ARNip y ablación antisentido, proteínas negativas dominantes e inmunodepleción) da como resultado una mitosis aberrante seguida de catástrofe mitótica a la vez que se ocasiona una parada del ciclo celular "mediado por puntos de control" en células normales. De este modo, la atenuación farmacológica de la función de Plk-1 puede tener un beneficio terapéutico en el tratamiento de varios cánceres diferentes.
COMPENDIO DE LA INVENCIÓN
Algunos derivados de pirrolo-pirimidina para el tratamiento de enfermedades hiperproliferativas tales como el cáncer se han descrito en los documentos WO 2006/071644 (Vertex Pharm Inc.) , WO 2005/014572, WO 2007/068728 y WO 2007/071621 (Pfizer Italia Srl) . La solicitud WO 2007/11034 en nombre del mismo Solicitante, también describe y reivindica derivados de pirrolo-pirimidina, pero ninguno de los compuestos ilustrados allí está incluido en la fórmula general (I) de la presente solicitud.
Un compuesto específico reivindicado en el documento WO 2005/014572 anteriormente mencionado está excluido de la presente fórmula general.
A pesar de estos avances, todavía existe la necesidad de agentes eficaces para dicha enfermedad. Los autores de la presente invención han descubierto ahora que los compuestos de fórmula (I) , descritos más abajo, son inhibidores de quinasas y por lo tanto son útiles en terapia como agentes antitumorales y carecen, en términos tanto de toxicidad como de efectos secundarios, de los inconvenientes asociados con los fármacos antitumorales disponibles en la actualidad.
Por lo tanto, un primer objeto de la presente invención es proporcionar un compuesto de pirrolo-pirimidina sustituido representado por la fórmula (I) ,
donde:
R1 es -OR' o -NR'R", donde R' y R" son, cada uno independientemente, hidrógeno o un grupo sustituido opcionalmente seleccionado entre alquilo C1-C6 lineal o ramificado, alquenilo C2-C6, alquinilo C2-C6, cicloalquilo C3-C6 y heterociclilo;
R2 es hidrógeno, o
R1 y R2 tomados juntos son una cadena de -NH-CH2-CH2- y forman una lactama de 6 miembros fusionada 15 con el anillo de pirrol;
R3 es un alquilo C1-C6 lineal o ramificado sustituido opcionalmente;
R4 y R5 son, cada uno independientemente halógeno, un grupo -O-R3, o un grupo sustituido opcionalmente seleccionado entre alcoxi polifluorado y heterociclilo, donde R3 se define como antes;
y sus sales farmacéuticamente aceptables.
La presente invención también proporciona métodos para la preparación del compuesto de pirrolo-pirimidina sustituido, representado por la fórmula (I) , preparado a través de un procedimiento que consiste en transformaciones sintéticas convencionales.
También se describe un método para el tratamiento de enfermedades causadas por y/o asociadas con la actividad no regulada de las proteína quinasas, particularmente la familia PLK, la proteína quinasa C en diferentes isoformas,
Met, PAK-4, PAK-5, ZC-1, STLK-2, DDR-2, Aurora 1, Aurora 2, Bub-1, Chk1, Chk2, HER2, raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, IGF-R, PI3K, quinasa weel, Src, Abl, Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek, familia de quinasas Cdk/ciclina, más concretamente PLK-1 y PLK-3, que comprende la administración a un mamífero, que lo necesite, de una cantidad eficaz de un compuesto de pirrolo-pirimidina sustituido representado por la fórmula (I) como se ha definido anteriormente.
También se describe un método para el tratamiento de una enfermedad causada por y/o asociada con la actividad no regulada de proteínas quinasas seleccionada del grupo que consiste en cáncer, trastornos proliferativos celulares, infecciones virales, trastornos autoinmunitarios y neurodegenerativos.
... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de fórmula (I) :
donde: 5 R1 es -OR' o NR'R", donde R' y R" son, cada uno independientemente, hidrógeno o un grupo sustituido
opcionalmente seleccionado entre alquilo C1-C6 lineal o ramificado, alquenilo C2-C6, alquinilo C2-C6, cicloalquilo C3-C6 y heterociclilo; R2 es hidrógeno, o R1 y R2 tomados juntos son una cadena de -NH-CH2-CH2-y forman una lactama de 6 miembros
fusionada con el anillo de pirrol; R3 es un alquilo C1-C6 lineal o ramificado sustituido opcionalmente; R4 y R5 son, cada uno independientemente halógeno, un grupo -O-R3, o un grupo sustituido
opcionalmente seleccionado entre alcoxi polifluorado y heterociclilo, donde R3 se define como antes; y sus sales farmacéuticamente aceptables.
2. Un compuesto de fórmula (I) de acuerdo con la reivindicación 1 donde: R1 es -OH o -NR'R", donde R' y R" se definen como en la reivindicación 1.
3. Un compuesto de fórmula (I) de acuerdo con las reivindicaciones 1 o 2 donde la posición de los sustituyentes R4 y R5 son las referidas más abajo:
donde R4 y R5 son, cada uno independientemente halógeno, un grupo -O-R3, o un grupo sustituido opcionalmente seleccionado entre alcoxi polifluorado y heterociclilo, donde R3 se define como en la reivindicación 1.
4. Un compuesto de fórmula (I) de acuerdo con la reivindicación 1, donde:
R1 y R2 tomados juntos son una cadena de -NH-CH2-CH2-y forman una lactama de 6 miembros fusionada con el anillo de pirrol, y R3, R4 y R5 se definen como en la reivindicación 1.
5. Un compuesto o una de sus sales farmacéuticamente aceptables de acuerdo con la reivindicación 1 que se
selecciona del grupo que consiste en: éster etílico de ácido 5-[2- (5-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1-metil-1H-pirrol-3carboxílico (A1B1C1M1) ;
ácido 5-[2- (5-bromo-2-metil-fenilamino) -pirimidin-4-il]-1-metil-1H-pirrol-3-carboxílico (A1B2C1M1) ; 30 amiduro de ácido 5-[2- (5-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1-metil-1H-pirrol-3carboxílico (A1B3C1M1) ; 44
amiduro de ácido 1-metil-5-[2- (5-piperazin-1-il-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1H-pirrol-3carboxílico (A1B3C2M1) ;
éster etílico de ácido 1-metil-5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}1H-pirrol-3-carboxílico (A1B1C3M1) ;
ácido 1-metil-5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1H-pirrol-3carboxílico (A1B2C3M1) ;
amiduro de ácido 1-metil-5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1Hpirrol-3-carboxílico (A1B3C3M1) ;
éster etílico de ácido 5-[2- (5-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1- (2-fluoro-etil) -1H-pirrol10 3-carboxílico (A2B1C1M1) ;
éster etílico de ácido 5-[2- (5-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1- (2, 2, 2-trifluoroetil) -1Hpirrol-3-carboxílico (A3B1C1M1) ;
amiduro de ácido 5-[2- (S-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1- (2-fluoro-etil) -1H-pirrol-3carboxílico (A2B3C1M1) ;
éster etílico de ácido 5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1- (2, 2, 2trifluoro-etil) -1H-pirrol-3-carboxílico (A3B1C3M1) ;
ácido 5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1- (2, 2, 2-trifluoro-etil) -1Hpirrol-3-carboxílico (A3B2C3M1) ;
amiduro de ácido 5-[2- (5-bromo-2-trifluorometoxi-fenilamino) -pirimidin-4-il]-1- (2, 2, 2-trifluoroetil) -1H20 pirrol-3-carboxílico (A3B3C1M1) ;
amiduro de ácido 5-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1- (2, 2, 2trifluoro-etil) -1H-pirrol-3-carboxílico (A3B3C3M1) ;
1. metil-2-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1, 5, 6, 7-tetrahidropirrolo[3, 2-c]piridin-4-ona (A1C3M2) ,
2-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxi-fenilamino]-pirimidin-4-il}-1- (2, 2, 2-trifluoro-etil) -1, 5, 6, 7tetrahidro-pirrolo[3, 2-c]piridin-4-ona (A3C3M2) , y
1. (2-hidroxi-etil) -2-{2-[5- (4-metil-piperazin-1-il) -2-trifluorometoxifenilamino]-pirimidin-4-il}-1, 5, 6, 7tetrahidro-pirrolo[3, 2-c]piridin-4-ona (A5C3M2) .
6. Un procedimiento para la preparación de un compuesto de fórmula (I) como se ha definido en la reivindicación 1, 30 caracterizado por que el procedimiento comprende:
d) desproteger un compuesto de fórmula (XIII) :
donde R3, R4 y R5 se definen como en la reivindicación 1 y Q es un grupo amino protector adecuado tal como t-butoxicarbonilo, para proporcionar un compuesto de fórmula (Ia) :
donde R3, R4 y R5 se definen como en la reivindicación 1; o d') hacer reaccionar un compuesto de fórmula (VIII) :
donde R' se define como en la reivindicación 1 excepto hidrógeno y R3 se define como en la reivindicación 1, con una arilamina sustituida opcionalmente de fórmula (IX) :
donde R' se define como en la reivindicación 1 excepto hidrógeno y R3, R4 y R5 se definen como en la reivindicación 1; o d") hacer reaccionar un compuesto de fórmula (VII) :
donde R' se define como en la reivindicación 1 excepto hidrógeno y R3 se define como en la reivindicación 1, con un derivado de yodofenilo sustituido opcionalmente de fórmula (XVII) :
separar opcionalmente el compuesto resultante en los isómeros individuales, convertir el compuesto en un compuesto de fórmula (I) diferente y/o en una sal farmacéuticamente aceptable si se desea.
7. Un procedimiento de acuerdo con la reivindicación 6, caracterizado por que el compuesto de fórmula (XIII) como se ha definido en la reivindicación 6, se prepara de acuerdo con las siguientes etapas:
a) haciendo reaccionar un compuesto de fórmula (XIV) :
b) haciendo reaccionar el compuesto resultante de fórmula (XV) con una arilamina sustituida opcionalmente de fórmula (IX) como se ha definido en la reivindicación 6, en condiciones reductoras, para proporcionar un compuesto de fórmula (XIII) como se ha definido en la reivindicación 6;
o
c) haciendo reaccionar un compuesto de fórmula (XIV) como se ha definido anteriormente, con un
derivado de yodofenilo sustituido opcionalmente de fórmula (XVII) como se ha definido en la reivindicación 6, en condiciones reductoras, para proporcionar un compuesto de fórmula (XIII) como se ha definido en la reivindicación 6.
8. Un procedimiento de acuerdo con la reivindicación 6, caracterizado por que los compuestos de fórmula (VII) y
(VIII) como se ha definido en la reivindicación 6, se preparan de acuerdo con las siguientes etapas:
e) haciendo reaccionar el compuesto de fórmula (II) :
con un compuesto de fórmula (X) :
donde R' se define como antes excepto hidrógeno, en presencia de sodio metálico, para proporcionar un compuesto de fórmula (III) :
donde R' se define como antes excepto hidrógeno;
f) haciendo reaccionar el compuesto resultante de fórmula (III) con ácido clorhídrico o bromhídrico, para proporcionar un compuesto de fórmula (IV) :
donde R' se define como antes excepto hidrógeno y X es cloro o bromo; g) reduciendo el compuesto resultante de fórmula (IV) , para proporcionar un compuesto de fórmula (V) :
donde R' se define como antes excepto hidrógeno;
h) haciendo reaccionar el compuesto resultante de fórmula (V) con un compuesto de fórmula (VI) :
R3-Y (VI)
donde R3 se define como en la reivindicación 1 e Y es halógeno o un grupo eliminable adecuado tal como toluenosulfonilo o trifluorometanosulfonilo en presencia de una base, para proporcionar un compuesto de fórmula (VII) como se ha definido en la reivindicación 6;
i) haciendo reaccionar el compuesto resultante de fórmula (VII) con nitrito de isoamilo en presencia de una fuente de yoduro tal como yoduro de cobre (I) , yoduro de cesio, yodo o una mezcla de los mismos, 20 para proporcionar un compuesto de fórmula (VIII) como se ha definido en la reivindicación 6.
9. Un procedimiento de acuerdo con la reivindicación 6, caracterizado por que la conversión opcional de un compuesto de fórmula (I) en un compuesto de fórmula (I) diferente, se lleva a cabo de una de las siguientes maneras:
I) convirtiendo un compuesto de fórmula (Ib) como se ha definido en la reivindicación 6, en un 25 compuesto de fórmula (I) donde R1 es un grupo -OH o la sal correspondiente a través de hidrólisis ácida o alcalina;
II) convirtiendo un compuesto de fórmula (Ib) como se ha definido anteriormente, en un compuesto de fórmula (I) donde R1 es un grupo -NR'R" mediante tratamiento con una amina de fórmula R'R"-NH (XII) , como se ha definido anteriormente, en un tubo sellado;
III) convirtiendo un compuesto de fórmula (I) donde R1 es -OH o la sal correspondiente en un compuesto de fórmula (I) donde R1 es un grupo -NR'R", a través de reacción con una amina de fórmula
R'R"-NH (XII) , donde R' y R" se definen como en la reivindicación 1, en condiciones alcalinas y en presencia de un agente condensante adecuado;
IV) convirtiendo un compuesto de fórmula (I) donde R1 es -NR'R" y R5 es bromo, en un compuesto de fórmula (I) donde R1 se define como antes y R5 es heterociclilo, donde R3 se define como antes, en
condiciones reductoras, mediante tratamiento con una amina de fórmula R"'R'"-NH (XI) donde R'" y R'v son, cada uno independientemente, hidrógeno o un grupo sustituido opcionalmente seleccionado entre alquilo C1-C6 lineal o ramificado, alquenilo C2-C6, alquinilo C2-C6, cicloalquilo C3-C6 y heterociclilo, o R'" y R'v tomados junto con el átomo de nitrógeno al que están unidos, pueden formar un grupo heterociclilo opcionalmente sustituido.
V) convirtiendo un compuesto de fórmula (Ia) donde R5 es bromo, en un compuesto de fórmula (Ia) donde R5 es heterociclilo, donde R3 se define como antes, mediante tratamiento con una amina de fórmula R"'R'v-NH (XI) como se ha definido anteriormente, en condiciones reductoras.
10. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un compuesto de
fórmula (I) o una de sus sales farmacéuticamente aceptables, como se ha definido en la reivindicación 1, y al menos 15 un excipiente, vehículo y/o diluyente farmacéuticamente aceptable.
11. Un producto o kit que comprende un compuesto de fórmula (I) o una de sus sales farmacéuticamente aceptables, como se ha definido en la reivindicación 1, o sus composiciones farmacéuticas como se ha definido en la reivindicación 10 y uno o más agentes quimioterapéuticos, en forma de una preparación combinada para el uso simultáneo, separado o sucesivo en la terapia anticancerosa.
12. Un compuesto de fórmula (I) o una de sus sales farmacéuticamente aceptables, como se ha definido en la reivindicación 1, para su uso como medicamento.
13. Un compuesto de fórmula (I) o una de sus sales farmacéuticamente aceptables, como se ha definido en la reivindicación 1, para su uso en un método para el tratamiento del cáncer.
14. Un intermedio de fórmula (XV) :
15. Un intermedio de fórmula (VIII) :
donde R' se define como en la reivindicación 1 excepto hidrógeno y R3 se define como en la reivindicación 1.
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Formas en estado sólido de sales de Nilotinib, del 15 de Julio de 2020, de PLIVA HRVATSKA D.O.O: Una forma cristalina de fumarato de Nilotinib designada como Forma III, caracterizada por datos seleccionados de uno o más de los siguientes: a. un patrón de […]
Inhibidores de Bcl-2/Bcl-xL y su uso en el tratamiento de cáncer, del 15 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF MICHIGAN: Compuesto que tiene una estructura **(Ver fórmula)**