PROCEDIMIENTOS, KITS Y DISPOSITIVOS DE TRATAMIENTO DE ÁCIDOS NUCLEICOS.
Procedimiento para tratar enzimáticamente moléculas ácido nucleicas en una mezcla que incluye un agente caotrópico,
proteínas degradadas y desnaturalizadas y moléculas de ADN y ARN liberadas de las proteínas unidas, que comprende la dilución de dicha mezcla con por lo menos un reactivo acuoso para reducir la concentración del agente caotrópico a menos de 0,05 M, preferentemente a menos de 0,01 M, y someter por lo menos algunas de dichas moléculas de ARN y ADN a por lo menos un tratamiento enzimático sin extraer o aislar dichas moléculas de ARN y ADN unas de otras, o de los otros componentes de la mezcla de reacción
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/015611.
Solicitante: BRANDEIS UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 415 SOUTH STREET WALTHAM, MA 02454-9110 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WANGH, LAWRENCE J., HARTSHORN,CRISTINA.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Mayo de 2004.
Clasificación Internacional de Patentes:
- C12N15/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12Q1/68A4
Clasificación PCT:
- C07H21/02 C […] › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con ribosilo como radical sacárido.
- C07H21/04 C07H 21/00 […] › con desoxirribosilo como radical sacárido.
- C12M1/00 C12 […] › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › Equipos para enzimología o microbiología.
- C12M1/34 C12M […] › C12M 1/00 Equipos para enzimología o microbiología. › Medida o ensayo de detección de las condiciones del medio, p. ej. por contadores de colonias.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- C12P19/34 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Clasificación antigua:
- C07H21/02 C07H 21/00 […] › con ribosilo como radical sacárido.
- C07H21/04 C07H 21/00 […] › con desoxirribosilo como radical sacárido.
- C12M1/00 C12M […] › Equipos para enzimología o microbiología.
- C12M1/34 C12M 1/00 […] › Medida o ensayo de detección de las condiciones del medio, p. ej. por contadores de colonias.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- C12P19/34 C12P 19/00 […] › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2355899_T3.pdf
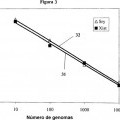

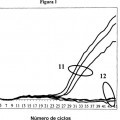
Fragmento de la descripción:
CAMPO TÉCNICO
La presente invención se refiere a la preparación de una o más moléculas ácido nucleicas, ADN o ARN, como matrices liberadas de las proteínas unidas, y disponibles para utilizaciones posteriores, que comprenden la detección, la modificación y/o la manipulación, interviniendo o no la amplificación de las secuencias en el interior de dichas 5 moléculas ácido nucleicas.
ANTECEDENTES
Las moléculas ácido nucleicas, ARN y ADN, que se encuentran tanto en muestras celulares como no celulares, se asocian a menudo con proteínas u otras macromoléculas, cuya unión interfiere con la detección o la manipulación enzimática de los ácidos nucleicos. Debido a esto, la mayoría de los protocolos concebidos para detectar 10 o utilizar los ácidos nucleicos, comienzan con una o varias etapas de purificación y/o aislamiento que se llevan a cabo antes de cualquier manipulación posterior, tal como la amplificación de secuencias diana particulares o la replicación de secuencias informativas.
Los procedimientos que se utilizan para preparar los ácidos nucleicos deben ser compatibles con las etapas bioquímicas posteriores. Además, resulta preferido realizar la purificación en las más escasas etapas fiables, y con el 15 número más pequeño posible de recipientes, con el fin de reducir pérdidas. Constituyen importantes características de los ensayos la exactitud cuantitativa y la conveniencia de la utilización, que pueden llevarse a cabo sobre grandes cantidades de muestras pequeñas, por ejemplo, muestras compuestas solamente de una célula, o de un número relativamente pequeño de células, o de muestras compuestas de una pequeña parte tisular, una fracción de una célula, o de un pequeño volumen de un extracto celular u homogenizado, o de muestras no celulares de ácidos nucleicos. La 20 manipulación y el tratamiento, particularmente de las muestras pequeñas, no deberá comportar la pérdida, degradación o contaminación de dichas muestras de los ácidos nucleicos dentro de dichas muestras.
Los procedimientos tradicionales para la purificación o el aislamiento del ADN o del ARN de las células y de la separación de las moléculas de ADN de las moléculas de ARN, comprenden típicamente, de manera no limitativa: a) interrupción/desnaturalización de la muestra en presencia de potentes agentes desnaturalizantes tales como sales de 25 guanidina, urea, detergentes, álcalis potentes, o una combinación de los anteriores; b) separación de ácidos nucleicos de interés a partir de proteínas desnaturalizadas y/o de otros ácidos nucleicos, mediante extracción con un líquido no acuoso, tal como el fenol:cloroformo (que se utiliza para la separación total del ADN y del ARN), o mediante adsorción a una matriz (resina, perlas o fibras, que se utilizan para la extracción selectiva del ARNm y para otras aplicaciones), o mediante la neutralización con un tampón alcalino y centrifugación (utilizado para el aislamiento del ADN plasmídico); 30 c) recuperación de los ácidos nucleicos mediante precipitación con un alcohol o con un catión monovalente, tal como el sodio o el amonio, o el cloruro de litio, y resuspensión en un volumen apropiadamente pequeño o, alternativamente, elución de los ácidos nucleicos en un volumen apropiadamente pequeño. El volumen en el que los ácidos nucleicos purificados están contenidos determina la fracción de ácidos nucleicos que puede analizarse en un ensayo. El volumen es de importancia particular cuando el análisis se lleva a cabo en muestras muy pequeñas tales como células únicas o 35 en muy pocas células. En la técnica es conocido que ciertas muestras iniciales requieren la utilización de condiciones más severas para romper las células. Pueden seleccionarse las condiciones para degradar selectivamente o digerir el ADN o el ARN para recuperar las otras. Las moléculas de ARN son mucho más sensibles a la degradación que las moléculas de ADN, debido a su sensibilidad a las condiciones alcalinas, a la temperatura elevada y a la presencia omnipresente de las ARNasas. Así, muchos protocolos para el aislamiento del ARN requieren condiciones más suaves 40 e incluyen la presencia de agentes concebidos para inhibir a las ARNasas.
Los ejemplos de procedimientos conocidos para la purificación, aislamiento, o separación de ADN o ARN genómicos, incluyen la utilización de bromuro de cetiltrimetilamonio (CTAB) y una alta concentración salina (Jones, A.S. (1963). Use of Alkyltrimethylammonium Bromides for the Isolation of Ribo- and Deoxyribo-Nucleic Acids, Nature 199:280-282); escasa concentración salina bajo presión hidrostática, hiperbárica (patente US nº 6.111.096); 45 precipitación salina suave (y digestión proteásica opcional); unión irreversible a matrices cubiertas de óxido de aluminio (patente US nº 6.291.166); preparación del ARN mediante lisis de tiocianato de guanidio seguido por centrifugación a través de un amortiguador de Cs-Cl (Chirgwin, J.M. et al. (1979), Isolation of Biologically Active Ribonucleic Acid from Sources Enriched in Ribonuclease, Biochemistry 18: 5294-5299); varias modificaciones y mejoras del procedimiento del tiocianato de guanidio-fenol-cloroformo (Chomczynski, P. y Sacchi N. (1987): Single-Step Method of RNA Isolation by 50 Acid Guanidinium Thiocyanate-Phenol-Chloroform Extraction, Anal Biochem 162:156-159), ampliado posteriormente para incluir el aislamiento del ADN (Chomczynski, P.(1993) A Reagent for the Single-Step Simultaneous Isolation of RNA, DNA and Proteins from Cell and Tissue Samples, Biotechniques 15:532-537); unión del ARN o ADN total a matrices tales como filtros de fibras de vidrio, membranas de gel de sílice, perlas magnéticas o matrices basadas en celulosa. 55
El documento WO 97/05248 A (13 febrero de 1997), describe un procedimiento para aislar ARN, ADN y proteínas a partir de una muestra única de material biológico que comprende la homogeneización de un material biológico en una solución que incluye por lo menos un agente caotrópico con una concentración de 2 M-7 M y un tampón para mantener el pH a aproximadamente 6-12, formando así una mezcla que comprende el agente caotrópico, proteínas degradadas y desnaturalizadas y moléculas de ADN y ARN, y, a la cual mezcla, con el fin de, por ejemplo, la 60
utilización subsiguiente en tratamientos enzimáticos tales como RT-PCR, se añaden disolventes orgánicos para precipitar el ARN, entonces el ADN, y después, las proteínas.
La extracción específica de las moléculas de ARNm se lleva a cabo solamente mediante la interacción de sus colas poly(A) con oligo(dT) unido a la celulosa o a las resinas que contienen un complejo estreptavidínico; y la precipitación selectiva de las moléculas de ARNm con sondas Poly T PNA y estreptavidina. No siempre se encuentra 5 presente, probablemente, una cola poly(A) intacta, particularmente para moléculas de ARN muy largas tales como Xist ARNm (Hong. Y.K. et al. (1999). A New Structure for the Murine Xist Gene and its Relationship to Chromosome Choice/Counting During X-Chromosome Inactivation. Proc. Natl. Acad. Sci. USA 96:6829-6834).
Un ejemplo de aislamiento y purificación in situ lo constituye la hibridación fluoresceínica in situ (FISH). Los procedimientos implican típicamente la fijación de la muestra, durante la cual las proteínas que están unidas son 10 desnaturalizadas, seguido por etapas de lavado en presencia de un detergente que elimina, por lo menos, algunas proteínas. Todas estas manipulaciones requieren una inversión considerable de tiempo y de trabajo. Además, todas pueden conducir a la pérdida de moléculas ácido nucleicas durante el procedimiento de purificación/extracción o a una detección más pobre de las secuencias diana. Esto último puede constituir un problema, ya que las sondas FISH necesitan reconocer y visualizar en la información básica mencionada anteriormente un número muy pequeño de 15 moléculas diana.
Recientemente, los procedimientos de amplificación de las dianas en tiempo real, por ejemplo, las técnicas PCR en tiempo real, han proporcionado una poderosa herramienta para la cuantificación precisa del número de copias del ARN, posibilitando el estudio de las modulaciones delicadas de los niveles de expresión génica. Tal como se ha mencionado anteriormente, sin embargo, el aislamiento del ARN representa un considerable reto, a causa, tanto de las 20 características fisicoquímicas de este tipo de molécula como de su sensibilidad con respecto a la acción de múltiples ARNasas, que están presentes intracelularmente o que se introducen fácilmente debido a la contaminación medioambiental.... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para tratar enzimáticamente moléculas ácido nucleicas en una mezcla que incluye un agente caotrópico, proteínas degradadas y desnaturalizadas y moléculas de ADN y ARN liberadas de las proteínas unidas, que comprende la dilución de dicha mezcla con por lo menos un reactivo acuoso para reducir la concentración del agente caotrópico a menos de 0,05 M, preferentemente a menos de 0,01 M, y someter por lo menos algunas de 5 dichas moléculas de ARN y ADN a por lo menos un tratamiento enzimático sin extraer o aislar dichas moléculas de ARN y ADN unas de otras, o de los otros componentes de la mezcla de reacción.
2. Procedimiento según la reivindicación 1, en el que dicha mezcla incluye por lo menos un componente seleccionado de entre el grupo constituido por un detergente que lisa células, un agente reductor, un disolvente miscible en agua, un agente quelante, y un tampón neutralizante. 10
3. Procedimiento según la reivindicación 1 ó 2, en el que la dilución se lleva a cabo mediante la adición en serie de por lo menos dos reactivos acuosos.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dicho por lo menos un tratamiento enzimático incluye la amplificación exponencial del ácido nucleico.
5. Procedimiento según la reivindicación 4, en el que dicha amplificación es un proceso de reacción en 15 cadena de la polimerasa o una transcripción inversa.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que se incluye una enzima para llevar a cabo dicho por lo menos tratamiento enzimático en dicho por lo menos un reactivo acuoso; en el que opcionalmente dicha enzima es seleccionada de entre el grupo constituido por una ADNasa, una transcriptasa inversa, una ADN polimerasa y una glucosidasa. 20
7. Procedimiento según la reivindicación 6, en el que la dilución y dicho por lo menos un tratamiento enzimático se llevan a cabo en el mismo recipiente; en el que opcionalmente dicho recipiente es seleccionado de entre el grupo constituido por un tubo, una placa de microtitulación y un dispositivo microfluídico.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, en el que dicha mezcla se prepara incubando una muestra que contiene moléculas de ARN y ADN unidas a proteínas y un agente de fragmentación que 25 contiene un agente caotrópico a una concentración del agente caotrópico de por lo menos aproximadamente 2 M.
9. Procedimiento según la reivindicación 8, en el que la incubación de la muestra y el reactivo de fragmentación incluye el calentamiento, siendo así el agente caotrópico concentrado, en el que preferentemente dicho calentamiento es suficiente para que la mezcla resultante sea por lo menos semiseca, y en el que opcionalmente la mezcla resultante se conserva antes de su utilización. 30
10. Procedimiento según la reivindicación 8 ó 9, en el que la incubación y la dilución se llevan a cabo en el mismo recipiente.
11. Procedimiento según cualquiera de las reivindicaciones 8 a 10, en el que dicho reactivo de fragmentación es un reactivo seco; en el que opcionalmente dicho reactivo de fragmentación seco se prepara a partir de una mezcla que incluye un disolvente miscible en agua y/o en el que dicho reactivo de fragmentación seco se prepara a partir de 35 una mezcla que incluye por lo menos un componente seleccionado de entre el grupo constituido por un detergente que lisa las células, un agente reductor, un agente quelante y un tampón neutralizante.
12. Procedimiento según la reivindicación 11, en el que dicho reactivo seco se adhiere a una superficie de un recipiente, por ejemplo, siendo dicha superficie la superficie interior de un tubo, una tapa de tubo, un pocillo de una placa de microtitulación, o una cubierta de una placa de microtitulación. 40
13. Procedimiento según cualquiera de las reivindicaciones 8 a 12, en el que dicha muestra comprende desde una fracción de una célula hasta 200 células.
14. Procedimiento según cualquiera de las reivindicaciones 8 a 13, en el que la cantidad del reactivo de fragmentación es suficiente para proporcionar una concentración de 2 M a 8 M del agente caotrópico en un volumen de 20 a 50 nl. 45
15. Procedimiento de recipiente único, para la síntesis de ADNc a partir del ARN en una muestra biológica utilizando una transcriptasa inversa amplificando y detectando por lo menos una secuencia seleccionada de dicho ADNc, que comprende:
a) combinar dicha muestra biológica con un reactivo de fragmentación, que comprende una sal caotrópica que presenta una concentración de por lo menos 2 M durante un tiempo y a una temperatura suficientes para 50 desnaturalizar o degradar las proteínas para producir una muestra fragmentada que contiene ARN liberado de las proteínas unidas e inactivar las nucleasas con una pérdida de ARN no superior al veinticinco por ciento;
b) reducir la concentración de la sal caotrópica en dicha muestra fragmentada a menos de 0,05 M diluyendo sin lavar la muestra fragmentada con por lo menos un reactivo acuoso antes de añadir la transcriptasa inversa;
c) incubar con transcriptasa inversa la muestra diluida y fragmentada para transcribir dicho ARN a ADNc;
d) amplificar por lo menos una secuencia seleccionada de dicho ADNc; y
e) detectar dicha por lo menos una secuencia amplificada del ADNc 5
en el que las etapas b) a e) se llevan a cabo sin separar inicialmente el ARN de las proteínas degradadas o de dicha sal caotrópica.
16. Procedimiento según la reivindicación 15, en el que dicho reactivo de fragmentación comprende un detergente que lisa las células.
17. Procedimiento según la reivindicación 16, en el que dicha muestra biológica comprende por lo menos 10 una célula.
18. Procedimiento según la reivindicación 15, en el que la etapa a) comprende el calentamiento para concentrar la sal caotrópica después de combinar la muestra biológica con el reactivo de fragmentación.
19. Procedimiento según la reivindicación 15, en el que en la etapa b) la concentración de la sal caotrópica se reduce a menos de 0,01 M. 15
20. Procedimiento según la reivindicación 19, en el que la sal caotrópica es un reactivo seco que es reconstituido durante su utilización.
21. Procedimiento según la reivindicación 18, en el que la etapa b) comprende la dilución con agua que comprende hexámeros aleatorios, calentar para desnaturalizar las cadenas dobles, y el enfriamiento para hibridar los hexámeros aleatorios al ARN. 20
22. Procedimiento según la reivindicación 21, en el que la etapa c) comprende la adición de la transcriptasa inversa y el tampón RT en una cantidad que no diluye además, por más de un factor de seis, la muestra fragmentada y diluida procedente de la etapa b).
23. Procedimiento según la reivindicación 22, en el que en la etapa d) la amplificación se lleva a cabo en un tampón de amplificación que es añadido en esta etapa, y en el que esta adición diluye el ADNc por un factor de por lo 25 menos nueve.
24. Procedimiento según la reivindicación 15, en el que las proteínas que son desnaturalizadas o degradadas comprenden las nucleasas.
Patentes similares o relacionadas:
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Método para romper un ácido nucleico y añadir un adaptador por medio de transposasa y reactivo, del 1 de Julio de 2020, de MGI Tech Co., Ltd: Un metodo para romper un acido nucleico y anadir un adaptador por medio de una transposasa, que comprende las siguientes etapas: interrumpir […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Etiquetado y evaluación de una secuencia diana, del 13 de Mayo de 2020, de RhoDx, Inc: Un método para modificar un ácido nucleico, que comprende: (a) poner en contacto un ácido nucleico de cadena sencilla con una actividad de transferasa […]
Preparación de bibliotecas de ácido nucleico marcado usando protocolo de adición en un solo tubo, del 13 de Mayo de 2020, de ILLUMINA, INC: Un método para preparar una biblioteca de fragmentos de ácido nucleico marcados que comprende: (a) poner en contacto una célula individual […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]