HIDRATO VARIABLE CRISTALINO DE LA SAL HEMISUCCINATO DE (S)-6-(4-(2-((3-(9H-CARBAZOL-4-ILOXI)-2-HIDROXIPROPIL)AMINO)-2-METILPROPIL)FENOXI)-3-PIRIDINOCARBOXAMIDA.
Un hidrato variable cristalino de sal de 6-[4-[2-[[3-(9H-carbazol-4-iloxi)-2hidroxipropil]amino]-2-metilpropil]fenoxi])-hemisuccinato de (S)-(3-piridinocarboxamida,
en la que el contenido en agua de dicho hidrato en peso está entre 6 y 11% cuando se mide a 22 ± 5ºC y entre 10-80% de humedad relativa y con un patrón de difracción de rayos X que comprende los siguientes picos: 7,6 ± 0,1 y 8,8 ± 0,1º en 2&952;; cuando se obtiene el patrón a 2025ºC y 25-30% de humedad relativa (HR) usando una fuente de radiación de cobre (CuK&945;; &955; = 1,54056 Å)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/024886.
Solicitante: ELI LILLY AND COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: LILLY CORPORATE CENTER INDIANAPOLIS, IN 46285.
Inventor/es: BUSH, JULIE, KAY.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Julio de 2005.
Fecha Concesión Europea: 8 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07D401/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- A61K31/4439 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un ciclo de cinco eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. omeprazol (nicotina A61K 31/465).
- A61P3/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › Anorexiantes; Medicamentos para el tratamiento de la obesidad.
- A61P3/10 A61P 3/00 […] › para la hiperglucemia, p.ej. antidiabéticos.
- C07D401/12 C07D 401/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
Antecedentes de la Invención
Los compuestos de fórmula II:
**(Ver fórmula)**
y sales farmacéuticamente aceptables de los mismos útiles como agonistas de los receptores β3 selectivos, fueron descritos por Crowell et al., en la Publicación de Patente Europea Nº 827.746 (Crowell).
El ejemplo 126 de Crowell describía la síntesis de una sal de hemisuccinato de un compuesto de formula II con la estructura:
**(Ver fórmula)**
referida de ahora en adelante como “SAM Classic”.
Dichos procedimientos sintéticos describían la producción de una “forma amorfa” de SAM Classic “que contiene sólo etanol residual en trazas”. Crowell describió la producción de la SAM Classic amorfa por intercambio de disolvente del etanol en el solvato etanólico cristalino de SAM Classic con agua. En particular, Crowell explicó que “La mezcla (de la suspensión acuosa) se filtró a vacío y se lavó la torta de masa filtrante con agua (3x100 ml). El sólido se secó al aire a vacío durante aproximadamente 2 horas, después en una estufa a vacío (65ºC) durante la noche. Esto dio producto (amorfo) como un sólido blanco ligeramente oscurecido. Así, Crowell describe que en el procedimiento de secado del material de la torta húmeda, la estructura del cristal del material inicialmente aislado (presente como una torta húmeda) desaparecía para formar la SAM Classic amorfa.
Los materiales deficientemente cristalinos, en particular materiales amorfos, son típicamente menos deseables que los materiales altamente cristalinos para procedimientos de formulación.
Además, generalmente no es deseable formular productos farmacéuticos que contengan cantidades sustanciales de disolvente orgánico debido a la potencial toxicidad del disolvente para el receptor del mismo y cambia la potencia del producto farmacéutico como una función del disolvente. Aunque la SAM Classic amorfa preparada por los procedimientos explicados en la patente europea EP 827.746 se podía usar como un producto farmacéutico, sería muy deseable y ventajoso encontrar una forma cristalina estable de SAM Classic que no contuviera cantidades sustanciales de disolvente orgánico dentro de su estructura cristalina que se pudiera preparar de manera reproducible y de manera eficaz a escala comercial.
Sorprendentemente y según la invención, ahora se ha descubierto que un hidrato cristalino de SAM Classic permite la producción reproducible, aislamiento y formulación a escala comercial, es suficientemente estable para uso en formulaciones orales y se puede producir y aislar en un estado altamente cristalino.
Breve Resumen de la Invención
La presente invención se refiere a un hidrato variable cristalino de la sal 6-[4-[2-[[3-(9Hcarbazol-4-iloxi)-2-hidroxipropil]amino]-2-metilpropil]fenoxi])-hemisuccinato de la (S)-(3piridinocarboxamida, en el que el contenido en agua de dicho hidrato en peso está entre 6 y 11% cuando se mide a 22 ± 5ºC y entre 10-80% de humedad relativa. Este material cristalino se refiere de ahora en adelante como “Hidrato SAM Classic”.
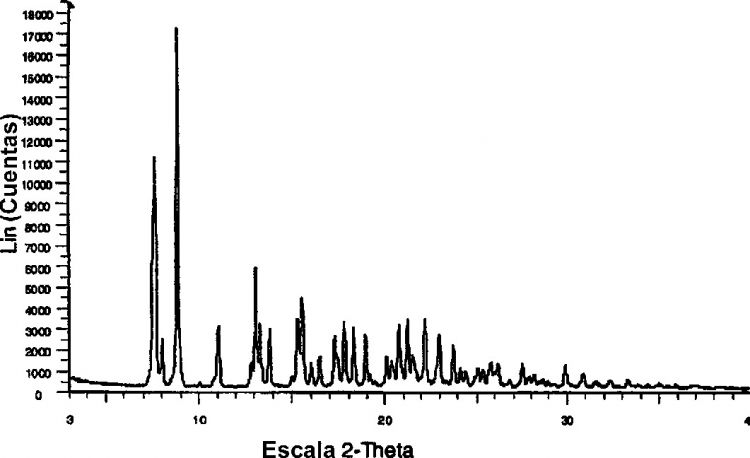
La presente invención se refiere además a Hidrato SAM Classic con un patrón de difracción de rayos X que comprende los siguientes picos: 7,6 ± 0,1 y 8,8 ± 0,1 en 2θ; cuando se obtiene el patrón a 20-25ºC y 25-30% de humedad relativ(HR) usando una fuente de radiación de cobre (CuKα; λ = 1,54056 Å).
En otra realización, la presente invención se refiere a una composición farmacéutica que contiene Hidrato SAM Classic y un portador farmacéutico. En otra realización más, las composiciones farmacéuticas de la presente invención se pueden adaptar para el uso en el tratamiento de la obesidad y/o la diabetes de Tipo II.
Por otra parte, la obesidad y/o la diabetes de Tipo II se pueden tratar por procedimientos que comprenden administrar a un paciente con necesidad de los mismos una cantidad eficaz de Hidrato SAM Classic.
Además, la presente invención se refiere a Hidrato SAM Classic para tratar la obesidad y/o la diabetes de Tipo II. En otra realización más, la presente invención se refiere al uso de Hidrato SAM Classic para la fabricación de un medicamento para el tratamiento de la obesidad y/o la diabetes de Tipo II.
Breve Descripción de las Figuras
La figura 1 es un patrón XRD representativo para Hidrato SAM Classic.
Descripción Detallada de la Invención
Para los fines de la presente invención, como se reivindica en la presente memoria, se definen a continuación los siguientes términos.
El término “producto farmacéutico” cuando se usa en la presente memoria como un adjetivo significa sustancialmente no perjudicial.
El término “paciente” como se usa en la presente memoria se refiere a seres humanos y a animales no humanos tales como animales de compañía (perros, gatos, caballos y similares). Un paciente preferido es un ser humano.
Los términos “tratamiento” y “tratar” como se usa en la presente memoria significan aliviar, mejorar, prevenir, prohibir, restringir, reducir, detener o invertir el progreso o la importancia de una afección patológica o secuela de la misma, descrita en la presente memoria.
La expresión “un paciente con necesidad del mismo” es un paciente que padece la afección patológica reivindicada o secuela de la misma, cuando se determina por diagnóstico médico, es decir, cuando se determina por el médico relacionado.
Como se usa en la presente memoria, el término “cantidad eficaz” significa una cantidad de Hidrato SAM Classic que pueda tratar las afecciones descritas en la presente memoria.
Según Crowell, la eliminación del agua del precursor de la torta húmeda a la SAM Classic amorfa descrita en el mismo por secado al aire a vacío durante aproximadamente 2 horas, después en una estufa a vacío a 65ºC durante la noche, hizo que desapareciera la estructura cristalina de este precursor. Así, Crowell sugiere que la estructura cristalina de Hidrato SAM Classic no es estable cuando se prepara usando las técnicas de laboratorio/fabricación clásicas descritas en el mismo y, por lo tanto, no adecuadas para el desarrollo como ingrediente farmacéutico activo (IFA). Como se describe en la presente memoria, los Solicitantes han encontrado procedimientos comercialmente importantes para la preparación y el aislamiento de Hidrato SAM Classic.
Caracterización de Hidrato SAM Classic
Se usan diversos procedimientos, incluyendo análisis de sorción de humedad, análisis de Karl Fischer, difracción de polvo de rayos X (XRD) y resonancia magnética nuclear del estado sólido de 13C (RMNES), para caracterizar el Hidrato SAM Classic.
El perfil de sorción de humedad para Hidrato SAM Classic revela que es un hidrato no estequiométrico. La estructura cristalina de Hidrato SAM Classic retiene aproximadamente 611% de agua entre 10 y 80% de humedad relativa. El hidrato se equilibra rápidamente con la atmósfera, de manera que el contenido en agua observado por técnicas analíticas es una función de la humedad relativa a la que se equilibró la muestra.
El contenido en agua de Hidrato SAM Classic se puede terminar por valoración de Karl Fischer volumétrica empleando un sistema de valoración Karl Fischer (KF) adecuado, por ejemplo, un sistema Metrohm®. El contenido en agua, por KF, se determina por la reacción cuantitativa de agua con yodo y dióxido de azufre aunque en presencia de alcohol y una base orgánica tal como piridina. La cantidad de agua se cuantifica por determinación del punto final usando un valorante apropiadamente calibrado. Condiciones del Procedimiento: agua Purificada Estándar; reactivo Sin Piridina de Material Compuesto Título -Hydranal 2K o reactivo Sin Piridina AquaStar Comp2 o equivalente (2 mg/ml); Caudal Volumétrico – 5 ml/min; Velocidad del Agitador -la velocidad máxima a la que no se están creando burbujas de aire en el recipiente de valoración. Procedimiento: Transferir una alícuota de muestra (200 mg o más) al recipiente de valoración. Disolver completamente la muestra en metanol anhidro previamente al análisis. Realizar primero valoración. Realizar una segunda valoración usando aproximadamente la misma cantidad de Hidrato SAM Classic empleada en el primer barrido. Calcular el promedio de los dos resultados.
Cálculos:
%Agua...
Reivindicaciones:
1. Un hidrato variable cristalino de sal de 6-[4-[2-[[3-(9H-carbazol-4-iloxi)-2hidroxipropil]amino]-2-metilpropil]fenoxi])-hemisuccinato de (S)-(3-piridinocarboxamida, en la que el contenido en agua de dicho hidrato en peso está entre 6 y 11% cuando se mide a 22 ± 5ºC y entre 10-80% de humedad relativa y con un patrón de difracción de rayos X que comprende los siguientes picos: 7,6 ± 0,1 y 8,8 ± 0,1º en 2θ; cuando se obtiene el patrón a 2025ºC y 25-30% de humedad relativa (HR) usando una fuente de radiación de cobre (CuKα; λ = 1,54056 Å).
2. El hidrato según la reivindicación 1, en el que el contenido en agua está entre 7,5 y 11%.
3. El hidrato según la reivindicación 1 ó 2, con un patrón de difracción de rayos X que comprende además los picos siguientes: 13,1 ± 0,1 y 15,5 ± 0,1º en 2θ.
4. El hidrato según la reivindicación 3, con un patrón de difracción de rayos X que comprende además los siguientes picos: 8,0 ± 0,1, 11,0 ± 0,1, 13,3 ± 0,1, 13,8 ± 0,1 y 15,3 ± 0,1º en 2θ.
5. El hidrato según la reivindicación 1, con un espectro de resonancia magnética nuclear de 13C de estado sólido que comprende picos a los siguientes desplazamientos químicos: 59,8 ± 0,1, 111,4 ± 0,1 y 151,4 ± 0,1 ppm cuando se ha equilibrado el hidrato al 33% de H. R. previamente a la recogida de datos.
6. El hidrato según la reivindicación 5, con un espectro de resonancia magnética nuclear de 13C de estado sólido que comprende además picos a los siguientes desplazamientos químicos: 99,2 ± 0,1, 102,4 ± 0,1, 134,9 ± 0,1, 146,9 ± 0,1 y 149,2 ± 0,1 ppm.
7. El hidrato según una cualquiera de las reivindicaciones 1-6, en el que la cantidad de impurezas químicas presentes en peso es < 2%.
8. El hidrato según una cualquiera de las reivindicaciones 1-7, en el que la cantidad de etanol presente en peso es ≤ 1%.
9. Una composición farmacéutica que comprende una cantidad eficaz del hidrato según una cualquiera de las reivindicaciones 1-8 y un portador farmacéutico.
10. La composición farmacéutica según la reivindicación 9, que contiene entre 1 y 600 mg del hidrato.
11. Una composición farmacéutica según la reivindicación 9, que comprende adicionalmente ingredientes activos.
12. Una composición farmacéutica según la reivindicación 11, en la que los otros ingredientes activos se seleccionan de sibutramina, sibutramina desmetilada o sibutramina didesmetilada.
13. Una composición farmacéutica según la reivindicación 11 ó 12, en la que el otro ingrediente activo es hidrocloruro de sibutramina monohidratado.
14. El hidrato según una cualquiera de las reivindicaciones 1-8 o una composición según la reivindicación 9-13 para uso en el tratamiento de un cuerpo humano por terapia.
5 15. Un hidrato según una cualquiera de las reivindicaciones 1-8 o una composición según una cualquiera de las reivindicaciones 9-13 para uso en el tratamiento de la obesidad o de la diabetes de Tipo II.
16. Un hidrato según una cualquiera de las reivindicaciones 1-8 o una composición según una cualquiera de las reivindicaciones 9-13 para uso en el tratamiento de la obesidad.
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]