METODOS PARA MEJORAR LA BIODISPONIBILIDAD DE UN INHIBIDOR DE RENINA.
Uso de una combinación de un inhibidor de renina y un inhibidor de proteína de eflujo,
en donde el inhibidor de renina es un derivado amida de ácido delta-amino-gamma-hidroxi-omega-aril-alcanoico o una sal farmacéuticamente aceptable del mismo para la fabricación de un medicamento,
en donde el inhibidor de proteína de eflujo mejora la biodisponibilidad de un inhibidor de renina, y
en donde el inhibidor de proteína de eflujo es un inhibidor MDR1
Tipo: Resumen de patente/invención. Número de Solicitud: W05008369EP.
Solicitante: NOVARTIS AG
NOVARTIS PHARMA GMBH.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: GROSS, GERHARD, CAMENISCH,GIAN,P, OTTINGER,ISABEL, WASMUTH,DANIEL.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/165 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos aromáticos, p. ej. colchicina, atenolol, progabide.
Clasificación PCT:
- A61K31/165 A61K 31/00 […] › teniendo ciclos aromáticos, p. ej. colchicina, atenolol, progabide.
- A61K38/13 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Ciclosporinas.
- A61P9/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos en el aparato cardiovascular.
- A61P9/12 A61P […] › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
Clasificación antigua:
- A61K31/165 A61K 31/00 […] › teniendo ciclos aromáticos, p. ej. colchicina, atenolol, progabide.
- A61K38/13 A61K 38/00 […] › Ciclosporinas.
- A61P9/00 A61P […] › Medicamentos para el tratamiento de trastornos en el aparato cardiovascular.
- A61P9/12 A61P 9/00 […] › Antihipertensivos.
Fragmento de la descripción:
Métodos para mejorar la biodisponibilidad de un inhibidor de renina.
La ruta oral es frecuentemente la ruta más conveniente para la administración de un fármaco, pero desafortunadamente muchos agentes terapéuticos no son oralmente activos debido a su pobre biodisponibilidad.
La biodisponibilidad de muchos agentes terapéuticos se puede reducir mediante la acción de proteínas llamadas bomba de eflujo
que expulsan activamente sustancias externas de la célula para hacer surgir, por ejemplo, el efecto de resistencia multifármaco. Estas proteínas de eflujo de fármaco comprenden principalmente transportadores del tipo MDR (proteína de resistencia a multifármaco) y MRP (proteína asociada con resistencia a multifármaco). Algunas de las proteínas de eflujo mejor estudiadas incluyen P-glucoproteína (Pgp o MDR1) y MRP2.
Aunque las proteínas de eflujo ubicadas en la membrana son bien conocidas como uno de los factores que contribuyen al síndrome de resistencia al multifármaco adquirido que surge en muchos pacientes con cáncer después de quimioterapia repetida, sólo hasta hace poco se ha dado cuenta que, por ejemplo, MDR1, también se encuentra en el tejido normal tal como intestino delgado, colon, hígado y células endoteliales en la barrera hematoencefálica. La presencia de tales proteínas de eflujo en el tubo gastrointestinal (GI), especialmente, en el intestino delgado y colon, puede contribuir a la pobre la biodisponibilidad de muchos fármacos de producto natural (que incluye los agentes anticáncer vinblastina y doxorubicina). Por ejemplo, muchos agentes quimioterapéuticos dados oralmente no pueden mostrar actividad antineoplásica debido a la pobre biodisponibilidad y su incapacidad para ingresar a los tejidos del GI. Adicionalmente, las proteínas de eflujo presentes en hepatocitos pueden reducir adicionalmente la biodisponibilidad de agentes terapéuticos mediante eliminación por vía de la bilis (ver Faber et al., Adv. Fármaco Del. Rev., 55, 107-124, 2003).
Los agentes terapéuticos administrados oralmente pueden superar varias barreras antes de alcanzar su sitio objetivo. El primer obstáculo principal para cruzar es el epitelio intestinal. Aunque los compuestos lipófilos se pueden difundir fácilmente a través de la membrana de plasma de punta, su paso posterior a través de la membrana basolateral y en la sangre portal no es por medios garantizados. Las proteínas de bomba de eflujo ubicadas en la membrana de punta, que incluye varios transportadores de fármaco de la familia del casete de unión a ATP (ABC), por ejemplo, los transportadores ABC tal como MDR1, MRP1 y MRP2, pueden controlar los compuestos desde el interior de la célula de nuevo en el lumen intestinal, que restringe su biodisponibilidad oral al evitar su absorción en la sangre. El segundo obstáculo principal para enfrentar es el hígado en donde los fármacos se transportan pasivamente o mediante procesos de transporte saturables de la sangre portal a través de plasma de hepatocito (sinusoidal) y membranas de bilis (canalicular) en la bilis. Las proteínas de bomba de eflujo ubicadas en las membranas canaliculares, que de nuevo incluyen varios transportadores de fármaco de la familia ABC, por ejemplo, transportadores ABC tal como MDR1, proteína de resistencia al cáncer de mama (BCRP) y MRP2, pueden controlar los compuestos de fármaco desde dentro de los hepatocitos en la bilis, restringiendo su biodisponibilidad oral al promover la eliminación biliar. Por ejemplo, el MDR1 ha demostrado que transporta la mayoría de inhibidores proteasa VIH y reduce su biodisponibilidad oral y penetración en linfocito, cerebro, testículos y fetal, que resulta posiblemente en mayores efectos limitantes en la eficacia terapéutica de estos fármacos. La WO 2005/089 731 A y ARZNEIMITTELFORSCHUNG, 2002, Vol. 52, No.8, 593-599 describe preparaciones farmacéuticas. Por lo tanto, un método para mejorar la biodisponibilidad puede ser para coadministrar un inhibidor de proteína de eflujo, es decir, un compuesto que inhibe la función de proteínas de eflujo, con una sustancia de fármaco. En otras palabras, cuando un inhibidor de proteína de eflujo se coadministra con un agente terapéutico que es también un sustrato para el que el sistema de eflujo específico, la biodisponibilidad oral y/o las concentraciones farmacológicas activas en el sitio objetivo del agente terapéutico se puede mejorar al inhibir el mecanismo de eflujo dentro del respaldo de la célula en el lumen intestinal y/o al inhibir la secreción en la bilis.
Sin embargo, las proteínas de eflujo exhiben baja especificidad de sustrato, y transportan muchos tipos de moléculas. La especificidad no se entiende rigurosamente, y no existe forma de predecir la estructura molecular de una sustancia de fármaco si ese fármaco específico será un sustrato para una cierta proteína transportadora. Así, no es generalmente posible predecir si un fármaco particular o compuesto se someterá a la acción de la bomba de eflujo discutida anteriormente. También, si un fármaco particular tiene una baja biodisponibilidad oral, no es generalmente posible predecir si se origina la baja biodisponibilidad, completamente o parcialmente, mediante las proteínas de eflujo discutidas anteriormente, ni se puede predecir si la baja biodisponibilidad se puede incrementar mediante la coadministración de un inhibidor de proteína de eflujo (ver Chan et al. Eur. J. Pharmaceut. Sci., 21, 25-51, 2004).
De forma sorprendente, ahora se ha encontrado que muchos inhibidores de renina, por ejemplo, aquellos descritos en las Patentes Estadounidenses No. 5,559,111, No. 6,197,959 y No. 6,376,672, son sustratos para un sistema de eflujo prominente, y se transportan activamente mediante los miembros de la familia ABC, en particular MDR1 y MRP2. Así, la biodisponibilidad de estos inhibidores de renina se puede mejorar al inhibir el mecanismo de eflujo involucrado, en particular, al inhibir el transporte de fármaco mediante MDR1 y/o MRP2.
La figura 1 muestra el efecto del inhibidor de renina SPP100 en la actividad ATPasa en vehículos de membrana que expresan altos niveles de MDR1.
La figura 2 muestra el transporte bidireccional del inhibidor de renina SPP100 a través de monocapas celulares Caco-2 en la dirección de punta (AP) a basolateral (BL) y BL-a-AP.
La figura 3 muestra el efecto del inhibidor MDR1 PSC833 en la permeabilidad del inhibidor de renina SPP100 a través de monocapas celulares Caco-2.
La figura 4 muestra el efecto del inhibidor MDR1 PSC833 en la concentración del inhibidor de renina SPP100 en plasma y en depuración biliar en ratas durante infusión intravenosa constante.
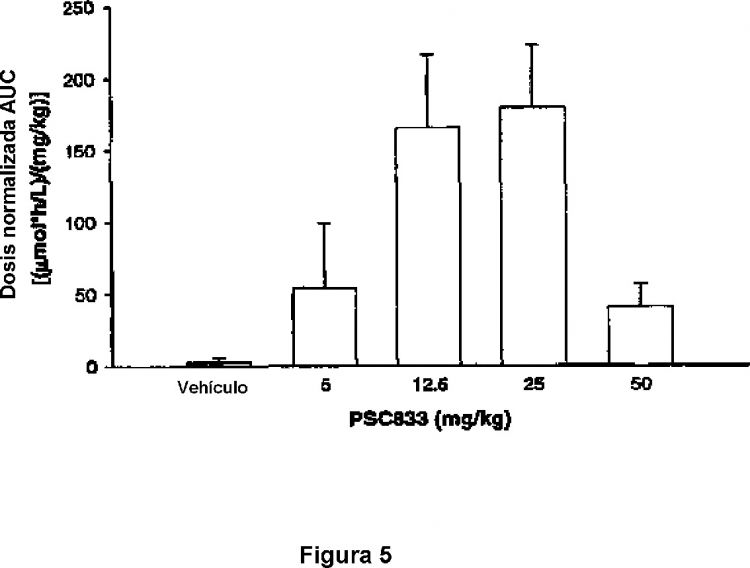
La figura 5 muestra los valores del área normalizada de dosis bajo la curva (AUC) del inhibidor de renina SPP100 en el plasma de ratas después de aplicación oral única en la ausencia o presencia de PSC833.
En particular, la presente invención se relaciona con derivados de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico como se describe en la Patente Estadounidense No. 5,559,111.
La presente invención proporciona en particular las realizaciones como se lista en las reivindicaciones 1 a 30. De acuerdo con lo anterior, la presente invención proporciona un método para mejorar la biodisponibilidad, preferiblemente, la biodisponibilidad oral, de un inhibidor de renina, cuyo método comprende coadministrar a un mamífero, especialmente un humano, en necesidad de tal tratamiento, una combinación de un inhibidor de renina y un inhibidor de proteína de eflujo como se define en las reivindicaciones. El inhibidor de proteína de eflujo se administra en una cantidad de tal manera que la biodisponibilidad de un inhibidor de renina se mejora en comparación con la biodisponibilidad que estaría en la ausencia del inhibidor de proteína de eflujo (por ejemplo 10% cuando se administra oralmente a los humanos). Un inhibidor de proteína de eflujo y un inhibidor de renina preferiblemente cada uno se co-administra en una cantidad tal manera que la combinación tiene un efecto terapéutico deseado, por ejemplo, un efecto anti-hipertensivo.
En particular, la presente invención proporciona un método para mejorar la biodisponibilidad de un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, cuyo método comprende co-administrar a un mamífero, especialmente un humano, en necesidad de tal tratamiento, una combinación de un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo, y un inhibidor de proteína de eflujo como se define en las reivindicaciones.
El término co-administración
...
Reivindicaciones:
1. Uso de una combinación de un inhibidor de renina y un inhibidor de proteína de eflujo, en donde el inhibidor de renina es un derivado amida de ácido d-amino-?-hidroxi-?-aril-alcanoico o una sal farmacéuticamente aceptable del mismo para la fabricación de un medicamento,
en donde el inhibidor de proteína de eflujo mejora la biodisponibilidad de un inhibidor de renina, y
en donde el inhibidor de proteína de eflujo es un inhibidor MDR1.
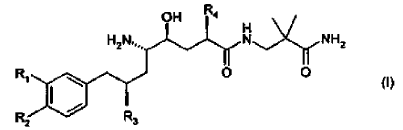
2. El uso de acuerdo con la reivindicación 1, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula

en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
3. El uso de acuerdo con la reivindicación 2, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
4. El uso de acuerdo con la reivindicación 3, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
5. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en donde el inhibidor MDR1 es PSC833.
6. Uso de una combinación de un inhibidor de renina y un inhibidor de proteína de eflujo, en donde el inhibidor de proteína de eflujo es PSC833, para la fabricación de un medicamento, en donde el inhibidor de proteína de eflujo mejora la biodisponibilidad de un inhibidor de renina.
7. El uso de acuerdo con la reivindicación 6, en donde el inhibidor de renina es un derivado amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo.
8. El uso de acuerdo con la reivindicación 7, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula
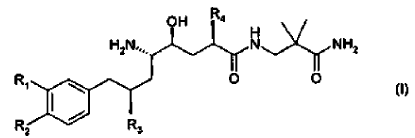
en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
9. El uso de acuerdo con la reivindicación 8, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
10. El uso de acuerdo con la reivindicación 9, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
11. Una composición farmacéutica que comprende una cantidad terapéuticamente efectiva de un inhibidor de renina en combinación con un inhibidor de proteína de eflujo, dicho inhibidor de proteína de eflujo está presente en una cantidad de tal manera que, luego de la administración, la biodisponibilidad de un inhibidor de renina se mejora en por lo menos 5%, en donde el inhibidor de renina es un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo, en donde el inhibidor de proteína de eflujo es un inhibidor MDR1.
12. La composición farmacéutica de acuerdo con la reivindicación 11, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula
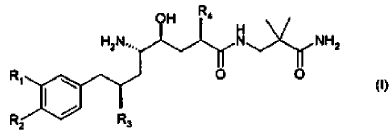
en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
13. La composición farmacéutica de acuerdo con la reivindicación 12, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
14. La composición farmacéutica de acuerdo con la reivindicación 13, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
15. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 11 a 14, en donde el inhibidor MDR1 es PSC833.
16. Una composición farmacéutica que comprende una cantidad terapéuticamente efectiva de un inhibidor de renina en combinación con un inhibidor de proteína de eflujo, dicho inhibidor de proteína de eflujo está presente en una cantidad de tal manera que, luego de la administración, la biodisponibilidad de un inhibidor de renina se mejora en por lo menos 5%, en donde el inhibidor de proteína de eflujo es PSC833.
17. La composición farmacéutica de acuerdo con la reivindicación 16, en donde el inhibidor de renina es un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo.
18. El método de la composición farmacéutica de acuerdo con la reivindicación 17, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula
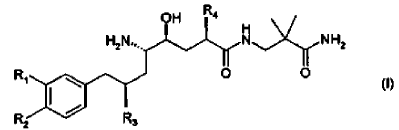
en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
19. La composición farmacéutica de acuerdo con la reivindicación 18, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
20. La composición farmacéutica de acuerdo con la reivindicación 19, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
21. Uso de un inhibidor de proteína de eflujo para mejorar la biodisponibilidad de un inhibidor de renina, en donde el inhibidor de renina es un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo, y en donde el inhibidor de proteína de eflujo es un inhibidor MDR1.
22. El uso de acuerdo con la reivindicación 21, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula
en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
23. El uso de acuerdo con la reivindicación 22, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
24. El uso de acuerdo con la reivindicación 23, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
25. El uso de acuerdo con cualquiera de las reivindicaciones 21 a 24, en donde el inhibidor MDR1 es PSC833.
26. Uso de un inhibidor de proteína de eflujo para mejorar la biodisponibilidad de un inhibidor de renina o una sal farmacéuticamente aceptable del mismo, en donde el inhibidor de proteína de eflujo es PSC833.
27. El uso de acuerdo con la reivindicación 26, en donde el inhibidor de renina es un derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico, o una sal farmacéuticamente aceptable del mismo.
28. El uso de acuerdo con la reivindicación 27, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico tiene la Fórmula
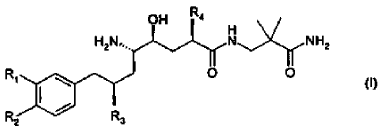
en donde R1 es alcoxi C1-4-alcoxi C1-4 o alcoxi C1-4-alquilo C1-4; R2 es alquilo C1-4 o alcoxi C1-4; y R3 y R4 son alquilo C1-4 independientemente ramificado; o una sal farmacéuticamente aceptable del mismo.
29. El uso de acuerdo con la reivindicación 28, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es un compuesto de la Fórmula (I) en donde R1 es 3-metoxipropoxi; R2 es metoxi; y R3 y R4 son isopropilo; o una sal farmacéuticamente aceptable del mismo.
30. El uso de acuerdo con la reivindicación 29, en donde el derivado de amida de ácido d-amino-?-hidroxi-?-aril-alcanoico es (2-carbamoil-2-metil-propil)-amida hemifumarato de ácido (2S,4S,5S,7S)-5-amino-4-hidroxi-2-isopropil-7-[4-metoxi-3-(3-metoxi-propoxi)-bencil]-8-metil-nonanoico.
Patentes similares o relacionadas:
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Moléculas químicas que inhiben el mecanismo de corte para tratar enfermedades causadas por anomalías de empalme, del 17 de Junio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Un compuesto elegido entre el grupo que comprende: • N-(3-Dimetilamino-propil)-3-(4-trifluorometoxi-fenilamino)-benzamida; • 4-(4-Metoxi-fenilamino)-3-metil-N-(3-metil-butil)-benzamida; […]
Sales cristalinas de un profármaco de dextroanfetamina, del 6 de Mayo de 2020, de SANDOZ AG: Una sal cristalina de L-lisina-d-anfetamina representada por la estructura química como se representa en la fórmula (II) **(Ver fórmula)** […]
Composición farmacéutica inyectable estable de antagonista del receptor de neuroquinina-1 y procedimiento para su preparación, del 29 de Abril de 2020, de PHARMATHEN S.A.: Una composición farmacéutica de liberación controlada para administración intramuscular o subcutánea que comprende Aprepitant o Fosaprepitant […]
Combinaciones de moduladores duales de IRS/STAT3 y agentes anticancerígenos para el tratamiento del cáncer, del 29 de Abril de 2020, de TyrNovo Ltd: Una composición farmacéutica que comprende un inhibidor de EGFR y/o un anticuerpo EGFR en combinación con un compuesto representado por la estructura […]
Implantes intraoculares que contienen prostamida y métodos de uso de éstos, del 1 de Abril de 2020, de ALLERGAN, INC.: Implante intraocular biodegradable, comprendiendo el implante una matriz de polímero biodegradable, polietilen glicol 3350, y una prostamida como el […]
Formulaciones de 15-hidroxiestearato de macrogol, del 25 de Diciembre de 2019, de ALLERGAN, INC.: Composición oftálmica que comprende un principio activo farmacéutico en una cantidad suficiente para contribuir al tratamiento, la prevención o reducción […]
Inhibidores de benzimidazol del canal de sodio, del 18 de Diciembre de 2019, de Zalicus Pharmaceuticals Ltd: Un compuesto seleccionado del grupo que consiste en **(Ver fórmula)** o una sal o solvato farmacéuticamente aceptable del mismo.