VECTORES DE EIAV CON CODONES OPTIMIZADOS.
Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico en una partícula retrovírica en una célula productora para generar un retrovirus de replicación defectuosa en una célula diana,
en el que la secuencia nucleotídica está optimizada en sus codones para la expresión en la célula productora, y en el que la secuencia nucleotídica comprende la secuencia mostrada en SEC ID nº: 16
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB01/01784.
Solicitante: OXFORD BIOMEDICA LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: MEDAWAR CENTRE, ROBERT ROBINSON AVENUE, THE OXFORD SCIENCE PARK,OXFORD 0X4 4GA.
Inventor/es: KINGSMAN, ALAN JOHN, KIM,NARRY THE HOWARD HUGHES MEDICAL INSTITUTE, KOTSOPOULOU,EKATERINI ENDERS 850, ROHLL,JONATHAN, MITROPHANOUS,KYRIACOS ANDREOU.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K14/155 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Lentiviridae, p. ej. virus de la inmunodeficiencia humana (VIH), virus visnamaedi, virus de la anemia infecciosa equina.
- C07K14/16B
- C12N15/867 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores retrovirales.
- C12N7/02C
Clasificación PCT:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C07K14/16 C07K 14/00 […] › VIH-1.
- C07K14/555 C07K 14/00 […] › Interferones (IFN).
- C12N15/86 C12N 15/00 […] › Vectores virales.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N7/04 C12N […] › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Inactivación o atenuación; Producción de partes elementales de virus.
Clasificación antigua:
- C12N15/86 C12N 15/00 […] › Vectores virales.
Fragmento de la descripción:
Vectores de EIAV con codones optimizados.
Campo de la invención
La presente invención se refiere a usos para la seguridad de vectores retrovíricos capaces de suministrar genes terapéuticos para uso en terapia génica, y a nuevas secuencias nucleotídicas para dicho uso.
Antecedentes de la invención
Los vectores retrovíricos se usan ahora ampliamente como vehículos para suministrar genes en células. Su popularidad deriva del hecho de que son fáciles de producir y median la integración estable del gen que portan al genoma de la célula diana. Esto permite la expresión a largo plazo del gen suministrado (1).
Durante cierto tiempo, ha habido un considerable interés en el desarrollo de sistemas de vectores retrovíricos basados en lentivirus. Los lentivirus son un pequeño subgrupo de retrovirus complejos. Contienen, además de los genes retrovíricos habituales (gag, pol y env), genes que les permiten regular su ciclo de vida e infectar células que no se dividen (2). Los sistemas de vectores basados en ellos son por lo tanto de interés debido a su uso potencial en la transferencia de un gen de interés a células que no se dividen, tales como neuronas. Además, los vectores lentivíricos permiten la expresión muy estable a largo plazo del gen de interés. Este se ha demostrado que es por lo menos tres meses para células neuronales de rata transducidas, mientras que los vectores a base de MLV sólo fueron capaces de expresar el gen de interés durante seis semanas.
El lentivirus usado más habitualmente es el Virus de la Inmunodeficiencia Humana (VIH), el agente etiológico del SIDA (síndrome de inmunodeficiencia adquirida). Los vectores a base de VIH han demostrado que transducen eficazmente células que no se dividen (3), y se pueden usar, por ejemplo, para dirigir genes terapéuticos anti-VIH a células susceptibles al VIH.
Sin embargo, los vectores a base de VIH tienen un número de desventajas significativas que pueden limitar su aplicación terapéutica a ciertas enfermedades. En particular, VIH-1 es un patógeno humano que posee proteínas y secuencias potencialmente oncogénicas. Existe riesgo de que la introducción de partículas vectoriales producidas en células que se empaquetan, que expresan gag-pol de VIH, introducirá estas proteínas en el paciente, conduciendo a la seroconversión.
Por lo tanto, se ha puesto énfasis en la seguridad de estos vectores. Una estrategia se fija en el diseño de sistemas de producción para vectores retrovíricos. Un sistema de vector retrovírico consiste básicamente en dos elementos, una estirpe celular de empaquetamiento, y un genoma del vector. La estirpe de empaquetamiento más simple consiste en un provirus en el que se ha suprimido la secuencia ? (un determinante del empaquetamiento del ARN que en VIH se encuentra entre U5 y gag). Cuando se transfectan de forma estable en una célula, se producirán partículas víricas que contienen transcriptasa inversa, pero el ARN viriónico no se empaquetará dentro de estas partículas. El componente complementador en un sistema de vector retrovírico es el propio vector genómico. El vector genómico necesita contener una secuencia de empaquetamiento, pero gran parte de las regiones codificantes estructurales se pueden suprimir. A menudo se incorpora en el vector un gen marcador seleccionable, u otra secuencia nucleotídica de interés. Entonces, los lotes de vectores de la estirpe de empaquetamiento se pueden usar para infectar células diana. Si la célula es infectada con éxito por la partícula vírica, la secuencia del vector genómico se transcribirá de forma inversa y se integrará por la maquinaria retrovírica. Sin embargo, la infección es un proceso final, de forma que no debería ocurrir ninguna replicación o diseminación posterior del vector.
Sin embargo, como se ha indicado anteriormente, se encuentran problemas en el diseño de vectores retrovíricos seguros y eficaces. Estos incluyen la posibilidad de que la recombinación entre el vector de empaquetamiento y la secuencia de empaquetamiento puede conducir a la generación de virus competente para la replicación de tipo salvaje. En consecuencia, se han realizado esfuerzos para mejorar la seguridad de los constructos de células de empaquetamiento.
En las estirpes celulares de empaquetamiento de segunda generación, además de la supresión de la secuencia de empaquetamiento, también se suprimió la 3'LTR, de forma que son necesarias dos recombinaciones para generar un virus de tipo salvaje.
En estirpes de empaquetamiento de tercera generación, los genes gag-pol y el gen env se colocan en constructos separados que se introducen secuencialmente en las células de empaquetamiento, para evitar la recombinación durante la transfección.
Con respecto a la señal de empaquetamiento, el documento EP 0.368.882A (Sodroski) describe que en VIH corresponde a la región entre el donante de corte y empalme principal de 5' y el codón de iniciación de gag, y particularmente corresponde a un segmento justo en dirección 3' del donante de corte y empalme principal de 5', y alrededor de 14 bases en dirección 5' del codón de iniciación de gag. Esta región es la que Sodroski enseña que se debe de suprimir del casete de gag-pol. El documento WO 97/12622 (Verma) describe que en VIH-1 se puede realizar una supresión interna de 39 pb en la secuencia ? entre el sitio donante de corte y empalme de 5' y el codón de partida del gen gag.
Se puede usar el bamboleo de codones para reducir la frecuencia de recombinación a la vez que se mantiene la secuencia proteica primaria de los constructos, véase (4) en el que la región de solapamiento entre los constructos de expresión de gag-pol y env se redujo hasta 61 pb que se extienden a lo largo de la región común entre pol y env que están en marcos de lectura diferentes. Se introdujeron mutaciones de transversión en los 20 codones finales de pol, reteniendo la integridad de la región codificante a la vez que se reduce la homología con env hasta 55% en la región de solapamiento. De forma similar, se introdujeron mutaciones de bamboleo en el 3' de env, y se suprimieron todas las secuencias en dirección 3' del codón de parada de env.
Los vectores eficientes contienen habitualmente parte de gag en el vector genómico, para incrementar el título de viriones. A diferencia de la secuencia de empaquetamiento que puede estar en cualquier posición dentro de una secuencia para efectuar el empaquetamiento, la secuencia de gag debe de estar en su posición nativa adyacente a ? para que tenga algún efecto.
Se apreciará que, mientras se pueden hacer mejoras significativas en el diseño de células de empaquetamiento y vectores, todavía hay alcance para un refinamiento adicional de las estirpes de empaquetamiento actuales.
Sumario de la invención
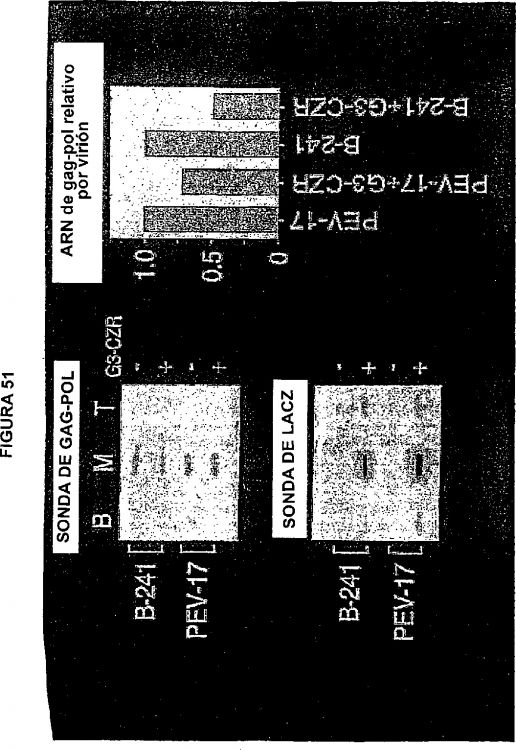
Por lo tanto, un objetivo de la presente invención consiste en proporcionar partículas retrovíricas, en particular partículas lentivíricas, y particularmente aquellas que poseen constructos nucleotídicos que codifican proteínas terapéuticas, que tengan seguridad mejorada con respecto a la partícula vírica de tipo salvaje correspondiente. En el documento WO 99/41397 se describe la optimización de codones de los genes gag-pol como un medio para superar el requisito de Rev/RRE para exportar y para potenciar la estabilidad de ARN. Sin embargo, ahora se ha encontrado que la secuencia de gag-pol con codones optimizados resuelve los problemas de recombinación potenciales con genomas vectoriales que poseen parte de una secuencia de gag con el objeto de incrementar el título. Esta estrategia también evita la necesidad de usar regiones de gag procedentes de diferentes virus en los constructos de empaquetamiento y de genomas vectoriales.
Otra ventaja significativa proporcionada por la invención es que la optimización de codones interrumpe las estructuras secundarias de ARN, tal como la señal de empaquetamiento, haciendo así al ARNm de gag-pol no empaquetable. De este modo, la presente invención permite que se retenga la secuencia retrovírica en dirección 5' del codón de iniciación de gag, en contraste con Sodroski y Verma, sin comprometer significativamente la seguridad.
Exposición de la invención
En consecuencia, en un aspecto, la presente invención proporciona el uso de una secuencia nucleotídica que codifica las proteínas gag y pol retrovíricas, capaz de ensamblar un genoma...
Reivindicaciones:
1. Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico en una partícula retrovírica en una célula productora para generar un retrovirus de replicación defectuosa en una célula diana, en el que la secuencia nucleotídica está optimizada en sus codones para la expresión en la célula productora, y en el que la secuencia nucleotídica comprende la secuencia mostrada en SEC ID nº: 16.
2. Uso según la reivindicación 1, en el que la partícula retrovírica deriva sustancialmente de EIAV.
3. Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico en una partícula retrovírica en una célula productora para evitar el empaquetamiento del genoma del vector retrovírico en una célula diana, en el que la secuencia nucleotídica está optimizada en sus codones para la expresión en la célula productora, y en el que la partícula retrovírica deriva sustancialmente de EIAV; y la secuencia nucleotídica comprende la secuencia mostrada en SEC ID nº: 16.
4. Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico, que comprende por lo menos parte de una secuencia nucleotídica de gag, en una partícula retrovírica en una célula productora para prevenir la recombinación entre dicha secuencia nucleotídica que codifica las proteínas retrovíricas gag y pol y la al menos parte de una secuencia nucleotídica de gag, en el que la secuencia nucleotídica que codifica las proteínas retrovíricas gag y pol está optimizada en sus codones para la expresión en la célula productora, y en el que la secuencia nucleotídica comprende la secuencia mostrada en SEC ID nº: 16.
5. Uso según la reivindicación 4, en el que la partícula retrovírica deriva sustancialmente de EIAV.
6. Uso según cualquiera de las reivindicaciones anteriores, en el que el genoma retrovírico comprende además un nucleótido de interés (NOI).
7. Uso según cualquiera de las reivindicaciones anteriores, en el que la secuencia nucleotídica es independiente de Rev.
8. Uso según cualquiera de las reivindicaciones anteriores, en el que la secuencia nucleotídica no contiene la secuencia de RRE.
9. Método para producir un retrovirus de replicación defectuosa, que comprende transfectar una célula productora con lo siguiente:
caracterizado porque la secuencia nucleotídica que codifica proteínas retrovíricas gag y pol está optimizada en sus codones para la expresión en la célula productora, y porque la secuencia nucleotídica de codones optimizados comprende la secuencia mostrada en SEC ID nº: 16.
10. Método según la reivindicación 9, en el que la partícula retrovírica deriva sustancialmente de EIAV.
11. Método para evitar el empaquetamiento de un genoma retrovírico en una célula diana, que comprende las etapas siguientes:
caracterizado porque la secuencia nucleotídica que codifica proteínas retrovíricas gag y pol está optimizada en sus codones para la expresión en la célula productora, y porque la secuencia nucleotídica de codones optimizados comprende la secuencia mostrada en SEC ID nº: 16.
12. Método según la reivindicación 11, en el que la partícula retrovírica deriva sustancialmente de EIAV.
13. Método para evitar la recombinación entre un genoma de vector retrovírico y una secuencia nucleotídica que codifica un polipéptido vírico requerido para el ensamblaje del genoma vírico en partículas retrovíricas, que comprende transfectar una célula productora con lo siguiente:
caracterizado porque la secuencia nucleotídica que codifica proteínas retrovíricas gag y pol está optimizada en sus codones para la expresión en la célula productora, y porque la secuencia nucleotídica de codones optimizados comprende la secuencia mostrada en SEC ID nº: 16.
14. Método según la reivindicación 13, en el que la partícula retrovírica deriva sustancialmente de EIAV.
15. Método según cualquiera de las reivindicaciones 9 a 14, en el que el genoma retrovírico comprende además un nucleótido de interés (NOI).
16. Método según cualquiera de las reivindicaciones 9 a 14, en el que iii) comprende una secuencia nucleotídica que codifica una proteína env.
17. Método según cualquiera de las reivindicaciones 9 a 14, en el que por lo menos uno de i) a iii) contiene uno o más genes accesorios funcionales.
18. Método según cualquiera de las reivindicaciones 9 a 14, en el que i) a iii) están desprovistos de cualesquiera genes accesorios funcionales.
19. Método según cualquiera de las reivindicaciones 9 a 18, en el que la secuencia nucleotídica que codifica las proteínas retrovíricas gag y pol es independiente de Rev.
20. Método según cualquiera de las reivindicaciones 9 a 19, en el que la secuencia nucleotídica que codifica las proteínas retrovíricas gag y pol no contiene la secuencia de RRE.
21. Secuencia nucleotídica que codifica proteínas retrovíricas gag y pol que comprende la secuencia de SEC ID nº: 16.
22. Vector que comprende una secuencia nucleotídica según la reivindicación 21, en el que el vector es independiente de Rev.
23. Sistema de vector vírico que comprende:
24. Sistema de producción vírico que comprende:
25. Sistema según la reivindicación 23 o la reivindicación 24, en el que el vector vírico es un vector retrovírico.
26. Sistema según la reivindicación 25, en el que el vector retrovírico es un vector lentivírico.
27. Sistema según cualquiera de las reivindicaciones 23 a 26, en el que el vector lentivírico deriva sustancialmente de EIAV.
28. Sistema según cualquiera de las reivindicaciones 23 a 27, en el que la secuencia nucleotídica definida en i-ii) también incluye una proteína de cubierta.
29. Sistema según la reivindicación 28, en el que el gen de cubierta tiene codones optimizados.
30. Sistema según cualquiera de las reivindicaciones 23 a 29, en el que el nucleótido de interés se selecciona de entre un gen terapéutico, un gen marcador y un gen de selección.
31. Sistema según cualquiera de las reivindicaciones 23 a 30, que comprende uno o más genes accesorios funcionales.
32. Sistema según cualquiera de las reivindicaciones 23 a 30, desprovisto de cualesquiera genes accesorios funcionales.
33. Sistema según cualquiera de las reivindicaciones 23 a 32, en el que la secuencia nucleotídica (ii) no contiene la secuencia de RRE.
34. Sistema vírico según cualquiera de las reivindicaciones 23 a 33, para uso en un método para producir partículas víricas.
35. Método para producir una partícula vírica, comprendiendo dicho método introducir en una célula productora:
36. Partícula vírica producida por el sistema de producción según cualquiera de las reivindicaciones 29 a 34, o por el método según la reivindicación 35.
37. Sistema vírico según cualquiera de las reivindicaciones 24 a 34, o una partícula vírica según la reivindicación 36, para tratar una infección vírica.
38. Composición farmacéutica que comprende el sistema vírico según cualquiera de las reivindicaciones 24 a 34, o la partícula vírica según la reivindicación 37, junto con un vehículo o diluyente farmacéuticamente aceptable.
Patentes similares o relacionadas:
Tratamiento de trastornos inflamatorios, autoinmunitarios y neurodegenerativos con polipéptidos derivados de Tat inmunosupresores, del 4 de Septiembre de 2019, de PIN Pharma, Inc: Un polipéptido derivado del trans-activador de la transcripción (Tat) inmunosupresor, comprendiendo el polipéptido derivado de Tat una secuencia de aminoácidos que […]
Células que comprenden partículas lentivíricas con codones optimizados, del 21 de Diciembre de 2016, de Oxford BioMedica (UK) Limited: Un método de producción de un vector de VIH de replicación defectuosa, que comprende transfectar una célula productora con lo siguiente: i) un genoma del VIH […]
Variantes del virus HIV-2, del 27 de Julio de 2016, de QIAGEN GMBH: VARIANTES DEL VIRUS VIH-2, NOMINALMENTE VIRUS VIH D205, PUEDEN CLONARSE A PARTIR DEL CORRESPONDIENTE VIRUS AISLADO VIH D205 (ECACC V 87122304) […]
Producción recombinante de inhibidores de la fusión antivirales peptídicos, del 29 de Octubre de 2014, de F. HOFFMANN-LA ROCHE AG: Un proceso para la producción de un péptido antifusogénico como un péptido de fusión de una longitud de aproximadamente 14 a aproximadamente 70 aminoácidos en una […]
Construcciones de antígenos útiles en la detección y diferenciación de anticuerpos contra el VIH, del 4 de Junio de 2014, de ABBOTT LABORATORIES: Una construcción de antígeno que consiste en una secuencia de aminoácidos de ID SEC NO: 55 o en una secuencia de aminoácidos diferente de la secuencia de […]
Constructos de antígenos útiles en la detección y la diferenciación de anticuerpos contra el VIH, del 27 de Noviembre de 2013, de ABBOTT LABORATORIES: Un constructo de antígeno seleccionado de entre: 1. Un constructo de antígeno que comprende: a. una fusión de un primer polipéptido de la env de la gp120 del VIH-1 […]
Clones moleculares con genes mutados GAG/POL de VIH, GAG de VIS y ENV de VIS, del 27 de Agosto de 2013, de THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES (100.0%): Una construcción de ácido nucleico que comprende una LTR 5', una señal de empaquetamiento, un gen gag/pollentiviral independiente de Rev del cual se […]
PÉPTIDOS PARA DETECTAR ESTIRPES DE LENTIVIRUS, del 31 de Julio de 2013, de UNIVERSIDAD PUBLICA DE NAVARRA: Péptidos para detectar estirpes de lentivirus. La presente invención describe una serie de péptidos que se corresponden con sitios antigénicos nuevos, de estirpes […]