Sal de dihidrógeno-fosfato de un antagonista del receptor D2 de prostaglandina.
Un compuesto de fórmula (III) **Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/039901.
Solicitante: AVENTIS PHARMACEUTICALS INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 300 SOMERSET CORPORATE BOULEVARD BRIDGEWATER, NEW JERSEY 08807- ESTADOS UNIDOS DE AMERICA.
Inventor/es: ORTON,EDWARD, LANGEVIN,BEVERLY, SHERER,DANIEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/505 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirimidinas; Pirimidinas hidrogenadas, p. ej. trimetoprima.
- C07D239/46 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Varios átomos de oxígeno, azufre o nitrógeno.
- C07D239/47 C07D 239/00 […] › Un átomo de nitrógeno y un átomo de oxígeno o azufre, p. ej. citosina.
PDF original: ES-2409833_T3.pdf
Fragmento de la descripción:
Sal de dihidrógeno-fosfato de un antagonista del receptor D2 de prostaglandina.
Campo de la invención La fabricación a gran escala de una composición farmacéutica puede plantear muchos retos al químico y al
ingeniero químico. Aunque muchos de estos retos se refieren al manejo de grandes cantidades de reactivos y al control de reacciones a gran escala, el manejo del producto final plantea retos especiales asociados a la naturaleza del propio producto activo final. No solamente debe el producto ser preparado con un rendimiento elevado, ser estable y capaz de un fácil aislamiento, sino que el producto debe poseer propiedades que sean adecuadas para los tipos de preparaciones farmacéuticas en las que probablemente va a ser finalmente usado. La estabilidad del
ingrediente activo de la preparación farmacéutica debe ser considerada durante cada etapa del procedimiento de fabricación, que incluye la síntesis, aislamiento, almacenamiento masivo, formulación farmacéutica y formulación a largo plazo. Cada una de estas etapas puede verse afectada por diversas condiciones medioambientales de temperatura y humedad.
La sustancia farmacéuticamente activa usada para preparar las composiciones farmacéuticas debe ser tan pura como sea posible y su estabilidad química en almacenamiento a largo plazo debe estar garantizada bajo diversas condiciones medioambientales. Esto es absolutamente esencial para evitar la aparición de productos de degradación no deseables en composiciones farmacéuticas. Estos productos de degradación pueden ser potencialmente tóxicos o dar lugar a simplemente a una reducción de la potencia de la composición.
Una preocupación principal para la fabricación a gran escala de compuestos farmacéuticos es que la sustancia activa debe mantener una estabilidad polimórfica durante su manejo para asegurar parámetros de tratamiento congruentes y calidad farmacéutica. Dependiendo de las características de estabilidad de un compuesto farmacéutico, puede ser sometido a experimentar cambios durante la fabricación y/o el almacenamiento, dando lugar potencialmente a problemas de control de calidad y aspectos de la formulación. Este cambio puede afectar al carácter reproducible del procedimiento de fabricación y, por tanto conducir a formulaciones finales que no cumplan los requisitos de alta calidad y de rigurosidad dispuestos por las agencias reguladoras sobre las formulaciones de composiciones farmacéuticas. Teniendo en cuenta lo que antecede, se debe considerar generalmente que al menos la selección de un compuesto farmacéutico que tenga características de estabilidad física mejorada puede proporcionar ventajas significativas sobre las formas menos estables del mismo compuesto.
La presente invención se dirige a la sal de dihidrógeno-fosfato de un antagonista de receptor D2 de prostaglandina farmacológicamente activo que tiene propiedades físicas altamente preferidas. El compuesto es útil como un antagonista D2 para tratar un paciente que padece o está sometido a estados (enfermedades) patológicos mediados por PGD2 que incluyen, pero sin limitación enfermedad alérgica (como rinitis alérgica, conjuntivitis alérgica, dermatitis atópica, asma bronquial y alergia a alimentos) , mastocitosis sistémica, trastornos acompañados de activación sistémica de mastocitos, choque anafiláctico, broncoconstricción, bronquitis, urticaria, eccema ,
enfermedades acompañadas de picores, (como dermatitis atópica y urticaria) , enfermedades como cataratas, desprendimiento de retina, inflamación, infección y trastornos del sueño) que son generadas secundariamente como consecuencia del comportamiento acompañado de picor (como rasguños y picaduras) , inflamación, inflamaciones de obstrucción pulmonar crónica, herida de reperfusión isquémica, accidente cardiovascular, artritis reumatoide crónica, pleuresía, colitis ulcerativa y similares.
Antecedentes de la invención La estimulación de alergia local en pacientes con rinitis alérgica, asma bronquial, conjuntivitis alérgica y dermatitis atópica se ha mostrado que da lugar a una rápida elevación de los niveles de prostaglandina D2 “ (PGD2) ” en los fluidos de emanaciones nasales y bronquiales, lágrimas y fluidos de la cámara cutánea. La PGD2 tiene muchas acciones inflamatorias, como aumentar la permeabilidad vascular en el tejido conjuntivo y la piel, aumento de la 45 resistencia de las vías aéreas nasales, estrechamiento de las vías aéreas e infiltración de eosinófilos en el tejido conjuntivo y la tráquea.
La PGD2 es un producto de ciclo-oxigenasa principal de ácido araquidónico producido a partir de mastocitos en tras una estimulación inmunológica [Lewis, RA, Soter NA, Diamond PT, Austen KF, Oates JA, Roberts LJ II, Prostaglandin D2 generation after activation of rat and human mast cells with anti-IgE, J. Immunol. 129, 1627-1631, 50 1982]. Los mastocitos activados, una fuente principal de PGD2, son uno de los factores claves para controlar la Muchas de las acciones de la PGD2 están mediadas a través de su acción sobre el receptor de prostaglandina de tipo D (“DP”) , un receptor acoplado a proteína G expresado en el epitelio y músculos lisos. En el asma, el epitelio respiratorio ha sido reconocido hace tiempo como una fuente clave de citoquinas inflamatorias y quimioquinas que controlan el progreso de la enfermedad [Holgate S, Lackie P, Wilson S, Roche W, Davies D, Bronchial Epithelium as a Key Regulator of Airway Allergen Sensisitzation and Remodelling in Asthma, Am JRespir CrU Care Med. 162, 113117, 2000]. En un modelo experimental de ratón de asma, el receptor de DP está enormemente sobreregulado en el
epatelio de las vías aéreas tras una estimulación con antígeno [Matsuoka T, Hirata M, Tanaka H, Takahashi Y, Murata T, Kabashima K, Sugimoto Y, Kobayashi T, Ushikubi F, Aze Y, Eguchi N, Urade Y, Yoshida N, Kimura K, Mizoguchi A, Honda Y, Nagai H, Narumiya S, prostaglandin D2 as a mediator of allergic asthma, Science 287, 20132017, 2000]. En ratones con el sistema inmunológico inactivado, que carecen del receptor de DP, hay una reducción considerable en la hiperactividad de las vías aéreas y la inflamación crónica, dos de las características cardinales del
asma humano [Matsuoka T, Hirata M, Tanaka H, Takahashi Y, Murata T, Kabashima K, Sugimoto Y, Kobayashi T, Ushikubi F, Aze Y, Eguchi N, Urade Y, Yoshida N, Kimura K, Mizoguchi A, Honda Y, Nagai H, Narumiya S, Prostaglandin D2 as a mediator of allergic asthma, Science 287, 2013-2017, 2000].
El receptor de DP se cree también que está involucrado en la rinitis alérgica humana, una enfermedad alérgica frecuente que se caracteriza por los síntomas de estornudos, picores, rinorrea y congestión nasal. La administración local de PGD2 a la nariz provoca un aumento dependiente de la dosis de la congestión nasal [Doyle WJ, Boehm S, Skoner DP, Physiologic responses to intranasal dose-response challenges with histamine, methacholine, bradykinin, and prostaglandin in adult volunteers with and without nasal allergy, J Allergy Clin Immunol. 86 (6 Pt 1) , 924-35, 1990].
Los antagonistas del receptor de DP se ha mostrado que reducen las inflamación de las vías aéreas en un modelo de asma experimental con cobayas [Arimura A, Yasui K, Kishino J, Asanuma F, Hasegawa H, Kakudo S, Ohtani M, Arita H, Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751, J Pharmacol Exp Ther. 298 (2) , 411-9, 2001]. Por lo tanto la PGD2 parece que actúa sobre el receptor de DP y desempeña una función importante en la activación de ciertas características claves del asma alérgico.
Los antagonistas de DP se ha mostrado que son eficaces para aliviar los síntomas de la rinitis alérgica en múltiples especies y, más específicamente, se ha mostrado que inhiben la congestión nasal inducida por antígenos, el síntoma más manifiesto de la rinitis alérgica [Jones, T. R., Savoie, C, Robichaud, A., Sturino, C, Scheigetz, J., Lachance, N., Roy, B., Boyd, M., Abraham, W., Studies with a DP receptor antagonist in sheep and guinea pig models of allergic rhinitis, Am. J. Resp. Crit. Care Med. 167, A218, 2003; and Arimura A, Yasui K, Kishino J, Asanuma F, Hasegawa H, Kakudo S, Ohtani M, Arita H, Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751. J. Pharmacol. Exp. Ther. 298 (2) , 411-9, 2001].
Los antagonistas de DP son también eficaces en modelos experimentales de conjuntivitis alérhicas y dermatitis alérgica [Arimura A, Yasui K, Kishino J, Asanuma F, Hasegawa H, Kakudo S, Ohtani M, Arita H, Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751. J. Pharmacol. Exp. Ther. 298 (2) , 411-9, 2001; and Torisu K, Kobayashi... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de fórmula (III)
2. El compuesto según la reivindicación 1, en una forma cristalina.
3. Una composición farmacéutica, que comprende una cantidad farmacéuticamente eficaz del compuesto según la reivindicación 1 mezclado con un vehículo farmacéuticamente aceptable.
4. Uso del compuesto según la reivindicación 1, para la elaboración de un medicamento para tratar una enfermedad alérgica, mastocitosis sistémica, un trastorno acompañado de activación sistémica de mastocitos, choque anafiláctico, broncoconstricción, bronquitis, urticaria, eccema, enfermedades acompañadas de picor, una enfermedad que es generada secundariamente como resultado de un comportamiento acompañado de picores, inflamación, enfermedades de obstrucción pulmonar crónica, herida de reperfusión isquémica, accidente cerebrovascular, artritis reumatoide crónica, pleuresía o colitis ulcerativa.
5. Uso según la reivindicación 4, en el que la enfermedad que es generada secundariamente como resultado de un comportamiento acompañado de picores es cataratas, desprendimiento de retina, inflamación, infección o trastornos 15 del sueño.
6. Uso según la reivindicación 4, en el que la enfermedad acompañada de picores es dermatitis alérgica o urticaria.
7. Uso según la reivindicación 4, para tratar una enfermedad alérgica.
8. Uso según la reivindicación 7, en el que la enfermedad alérgica es asma bronquial, rinitis alérgica, dermatitis alérgica, conjuntivitis alérgica o alergia a alimentos.
9. Uso según la reivindicación 4, para tratar una enfermedad de obstrucción pulmonar crónica.
10. El compuesto según la reivindicación 1, para ser usado en el tratamiento de una enfermedad alérgica, mastocitosis sistémica, un trastorno acompañado de una activación sistémica de mastocitos, choque anafiláctico, broncoconstricción, bronquitis, urticaria, eccema, una enfermedad acompañada de picores, una enfermedad que es generada secundariamente como resultado de un comportamiento acompañado de picores, inflamación,
enfermedades de obstrucción pulmonar crónica, herida de reperfusión isquémica, accidente cerebrovascular, artritis reumatoide crónica, pleuresía o colitis ulcerativa.
11. El compuesto según la reivindicación 10, en el que la enfermedad que es generada secundariamente como resultado de un comportamiento acompañado de picores es cataratas, desprendimiento de retina, inflamación, infección o trastornos del sueño.
12. El compuesto según la reivindicación 10, en el que la enfermedad acompañada de picores es dermatitis alérgica
o urticaria.
13. El compuesto según la reivindicación 10, para tratar una enfermedad alérgica.
14. El compuesto según la reivindicación 13, en el que la enfermedad alérgica es asma bronquial, rinitis alérgica, 5 dermatitis alérgica, conjuntivitis alérgica o alergia a alimentos.
15. El compuesto según la reivindicación 10, para tratar una enfermedad de obstrucción pulmonar crónica.
16. Una composición farmacéutica, que comprende una cantidad farmacéuticamente eficaz del compuesto según la reivindicación 1 y un compuesto seleccionado entre el grupo que consiste en una antihistamina, un antagonista de leucotrieno, un agonista beta, un inhibidor de PDE4, un antagonista de TP y un antagonista de CrTh2, mezclado con
un vehículo farmacéuticamente aceptable.
17. La composición farmacéutica según la reivindicación 16, en la que la antihistamina es fexofenadina, desloratadina, loratadina o citirizina, el antagonista de leucotrieno es montelukast o zafirulast, el agonista beta es alguterol, salbuterol o terbutalina, el inhibidor de PDE4 es roflumilast o cilomilast, el antagonista de TP es Ramatrobran y el antagonista de CrTh2 es Ramatrobran.
FIGURA 1
FIGURA 2
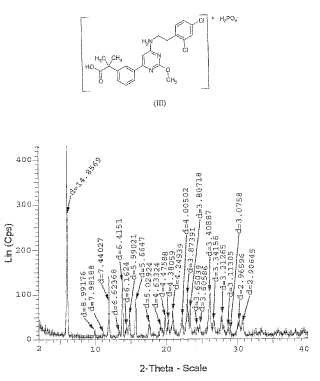
Valor de d Intensidad Intensidad Anstrom Recuentos por segundo % 14, 8569 432 100 8, 99176 20 4, 6 7, 98188 26 3, 7 7, 44027 140 32, 4 6, 62368 16 3, 7
6, 4151 129 29, 9 6, 1624 30 6, 9 5, 99021 56 13 5, 66647 88 20, 4 5, 02924 43 10 4, 63324 33 7, 6 4, 47588 52 12 4, 38059 43 10 4, 24939 62 14, 4 4, 00502 54 12, 5 3, 87391 97 22, 5 3, 80718 71 16, 4 3, 65039 31 7, 2 3, 60586 32 7, 4 3, 40887 102 23, 6 3, 34156 41 9, 5 3, 21265 54 12, 5 3, 11305 29 6, 7 3, 0758 22, 6 5, 2 2, 96596 36 8, 3 2, 09645 35 8, 1
FIGURA 3
Acontecimiento térmico La sal de dihidrógeno-fosfato
Punto de fusión 218ºC
FIGURA 4
FIGURA 5
HR de la muestra (%) Ciclo 1 0, 1
8, 6
19, 2
28, 7
38, 2
48, 3
57, 7
66, 9
75, 9
85, 2
94, 1
Ciclo 2 0, 1 8, 9 19, 4 28, 8 28, 4 48, 4 57, 8 66, 9 75, 8 85, 2 94, 0
Cambio en peso (%) Absorción Desorción Histéresis
0, 0000 0, 0340 0, 0472 0, 0879 0, 1169 0, 1518 0, 1932 0, 2447 0, 3118 0, 4404 0, 9040
0, 0133 0, 0440 0, 0672 0, 0995 0, 1310 0, 1659 0, 2123 0, 2629 0, 3326 0, 4611 0, 9463 0, 0133 0, 0464 0, 0124 0, 0730 0, 0158 0, 1004 0, 0124 0, 1335 0, 0166 0, 1609 0, 0091 0, 2123 0, 0191 0, 2679 0, 0232 0, 3400 0, 0282 0, 4644 0, 0241 0, 9040
0, 0182 0, 0531 0, 0091 0, 0804 0, 0133 0, 1086 0, 0091 0, 1410 0, 0100 0, 1758 0, 0100 0, 2272 0, 0149 0, 2828 0, 0199 0, 3541 0, 0216 0, 4802 0, 0191 0, 9463
FIGURA 6
FIGURA 7
FIGURA 8
FIGURA 9
Cambio en peso HR de muestra 0, 000 1, 14 -0, 001 2, 17 0, 008 5, 05 0, 026 9, 90 0, 054 19, 94 0, 079 29, 92 0, 102 39, 92 0, 124 49, 86 0, 146 59, 83 0, 170 69, 89 0, 196 79, 69 0, 234 89, 51 0, 263 94, 72 0, 245 89, 77 0, 215 79, 96 0, 191 70, 01 0, 168 60, 03 0, 145 50, 15 0, 124 40, 04 0, 104 30, 17 0, 083 19, 81 0, 056 10, 26 0, 039 4, 87 0, 022 2, 07
FIGURA 10
Posición de los picos (cm-1)
3246, 33
2943, 13
1729, 41
1654, 53
1625, 97
1595, 66
1535, 18
1494, 85
1471, 73
1362, 52
1251, 90
1107, 05
1051, 19
1027, 20
945, 09
892, 45
864, 26
852, 33
823, 94
803, 36
768, 17
749, 19
695, 68
687, 27
668, 53
FIGURA 11
FIGURA 12
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Inhibidores de la HDAC en combinación con los inhibidores de la pi3k, para el tratamiento del linfoma no Hodgkin, del 1 de Julio de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para usar en el tratamiento del linfoma no Hodgkin que comprende una cantidad terapéuticamente eficaz de un inhibidor […]
Compuestos de pirimidina como inhibidores de quinasas, del 1 de Julio de 2020, de Icahn School of Medicine at Mount Sinai: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal del mismo, donde: R1 es CN, S(O)jAr1 o S(O)k(alquilen C1-6)Ar1; j es 0, 1 o 2; k es 0, 1 o 2; […]
Síntesis y formas de sal novedosas de (R)-5-((E)-2-pirrolidin-3-ilvinil)pirimidina, del 1 de Julio de 2020, de Oyster Point Pharma, Inc: Un procedimiento para la fabricación de (R)-5-((E)-2-pirrolidin-3-ilvinil)pirimidina que comprende: (a) tratar el compuesto 1 con cloruro de metanosulfonilo para […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Actividad antitumoral de inhibidores de multicinasas en cáncer colorrectal, del 10 de Junio de 2020, de ENTRECHEM, S.L: Composición para uso en la prevención y/o el tratamiento de cáncer colorrectal en un paciente, que comprende: a) un compuesto de fórmula (I) **(Ver fórmula)** […]
Formulaciones farmacéuticas de estatinas y ácidos grasos omega-3 para encapsulación, del 27 de Mayo de 2020, de Catalent Ontario Limited: Una cápsula de gelatina blanda multifase para administración oral, comprendiendo la cápsula de gelatina blanda: una forma de dosificación […]