Tiazolidinediona N-alquilada fenoxi-sustituida como moduladores del receptor de estrógenos alfa.
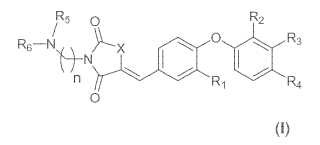
Un compuesto de Fórmula (I) :
en la que X es S;
n es 1-4;
R1 es halo, alquilo (C1-C4) opcionalmente sustituido, alcoxilo (C1-C4) opcionalmente sustituido o hidroxilo;
R2 se selecciona entre alquilo (C1-C3) halo-sustituido, ciano, halo, -C (O) NH2 y -C (O) O-alquilo (C1-C4) o, alternativamente, R2 está ligado a R3 para formar un arilo fusionado al anillo de fenilo al que R2 y R3 se muestran unidos;
R3 es H o, alternativamente, R3 está ligado a R2 para formar un anillo de arilo fusionado al anillo de fenilo al que R3 y R2 se muestran unidos; R4 es halo, ciano, alquilo (C1-C3) halo-sustituido, -C≡CH, -C (O) O-alquilo (C1-C4), -C (O) NH2 o -S (O2) -alquilo (C1-C4) ;
y R5 y R6 son independientemente H o alquilo (C1-C4) opcionalmente sustituido o, alternativamente, R5 y R6 están ligados junto con el átomo de N al que están unidos para formar un heteroarilo que contiene N de 5-9 miembros opcionalmente sustituido o un heterociclilo que contiene N de 5-7 miembros opcionalmente sustituido;
o un isómero óptico, enantiómero, diastereómero, isómero cis-trans, racemato o sal farmacéuticamente aceptable del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/056018.
Solicitante: JANSSEN PHARMACEUTICA N.V..
Nacionalidad solicitante: Bélgica.
Dirección: TURNHOUTSEWEG 30 2340 BEERSE BELGICA.
Inventor/es: GAUL,Michael, SEARLE,Lily Lee, RENTZEPERIS,Dionisios.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D277/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 277/00 Compuestos heterocíclicos que contienen ciclos de tiazol-1,3 o tiazol-1,3 hidrogenado. › Atomos de oxígeno.
PDF original: ES-2377165_T3.pdf
Fragmento de la descripción:
Tiazolidinediona N-alquilada fenoxi-sustituida como moduladores del receptor de estrógenos alfa Campo de la invención La presente invención se refiere a ciertos compuestos nuevos, a procedimientos para preparar compuestos, composiciones, compuestos intermedios y derivados de los mismos, y para tratar afecciones, tales como cáncer, artritis, enfermedad inflamatoria de las vías respiratorias y trastornos metabólicos. Más concretamente, los compuestos de la presente invención son moduladores del receptor de estrógenos alfa (ERR-α) útiles para tratar, mejorar o inhibir la aparición de estados patológicos, trastornos y afecciones mediadas por la actividad de ERR-α.
Antecedentes de la invención
Los receptores nucleares son miembros de una superfamilia de factores de transcripción. Los miembros de esta familia comparten similitudes estructurales y regulan un diverso conjunto de efectos biológicos (Olefsky, J. M. J. Biol. Chem. 2001, 276 (40) , 36863-36864) . Los ligandos activan o inhiben estos factores de transcripción que controlan los genes implicados en el metabolismo, la diferenciación y la reproducción (Laudet, V. y H. Gronmeyer. “The Nuclear Receptor Factbooks”. 2002, San Diego: Academic Press) . En la actualidad, el proyecto del genoma humano ha identificado aproximadamente 48 miembros de esta familia, así como ligandos afines para aproximadamente 28 de ellos (Giguere, V. Endocrine Rev. 1999, 20 (5) , 689-725) . Esta familia de proteínas está compuesta por dominios estructurales modulares que se pueden intercambiar entre los miembros de la familia sin que ello provoque una pérdida funcional. Un receptor nuclear típico contiene un terminal N hipervariable, un dominio de unión a ADN (DBD) conservado, una región bisagra y un dominio de unión a ligandos (LBD) conservado. La función del DBD consiste en dirigir al receptor hacia secuencias de ADN específicas (elemento de respuesta a NHR o NRE) y la función del LBD es la de reconocer a su ligando afín. Dentro de la secuencia del receptor nuclear, hay regiones implicadas en la activación de la transcripción. El dominio AF-1 se sitúa en el terminal N y activa constitutivamente la transcripción (Rochette-Egly, C. et al. Cell 1997, 90, 97-107; Rochette-Egly, C. et al. Mol. Endocrinol. 1992, 6, 2197-2209) , mientras que el dominio AF-2 se encuentra dentro del LBD, y su activación transcripcional depende del ligando (Wurtz, J. M. et al. Nat. Struct. Biol. 1996, 3, 87-94) . Los receptores nucleares pueden existir como monómeros, homodímeros o heterodímeros y se unen a repeticiones de nucleótidos directas o invertidas (Laudet y Gronmeyer, 2002; Aranda, A. y A. Pascual. Physiol. Rev. 2001, 81 (3) , 1269-1304) .
Los miembros de esta familia existen en estado biológico basal bien activado o inhibido. El mecanismo básico de la activación génica implica el intercambio de proteínas correguladoras dependiente del ligando. Estas proteínas correguladoras se denominan coactivadoras o coinhibidoras (McKenna, L. J. et al. Endocrine Rev. 1999, 20, 321-344) . Los receptores nucleares en estado inhibido están unidos a su elemento de respuesta de ADN y asociados con proteínas coinhibidoras que reclutan desacetilasas de histonas (HDAC) (Jones, P. L. y Y. B. Shi. Curr. Top. Microbiol. Immunol. 2003, 274, 237-268) . En presencia de un agonista, se produce un intercambio de coinhibidores con coactivadores que, a su vez, reclutan factores de transcripción que se ensamblan en un complejo de remodelación de cromatina dependiente de ATP. Las histonas son hiperacetiladas, provocando el desplegamiento del nucleosoma y paliando la inhibición. El dominio AF-2 actúa como un interruptor molecular dependiente del ligando para el intercambio de proteínas correguladoras. En presencia de un agonista, el dominio AF-2 se somete a una transición configuracional y presenta una superficie sobre el LBD para interactuar con las proteínas coactivadoras. En ausencia de un agonista o en presencia de un antagonista, el dominio AF-2 presenta una superficie que promueve las interacciones con proteínas coinhibidoras. Las superficies de interacción del LBD tanto para coactivadoras como para coinhibidoras se solapan y proporcionan un mecanismo molecular conservado para la activación o la inhibición génica que es compartido por los miembros de esta familia de factores de transcripción (Xu, H. E. et al. Nature 2002, 415 (6873) , 813-817) .
Se han identificado ligandos naturales que modulan la actividad biológica de los receptores nucleares sólo para aproximadamente la mitad de los receptores nucleares conocidos. Los receptores para los que no se ha identificado ningún ligando natural se denominan “receptores huérfanos”. El descubrimiento de ligandos o compuestos que interactúan con un receptor huérfano acelerará el entendimiento de la función de los receptores nucleares en la fisiología y la enfermedad, y facilitará la búsqueda de nuevos enfoques terapéuticos. Una subclase de estos receptores para la que no se ha identificado ningún ligando natural es la de los receptores de estrógenos (ERR) .
ERR-α (también conocido como ERR-1) , un receptor huérfano, es el primero de los tres miembros identificados de la subfamilia de receptores de estrógenos de los receptores nucleares huérfanos (ERR-α, β, γ) . La subfamilia de ERR está estrechamente relacionada con los receptores de estrógenos (ER-α y ER-β) . Primero se aislaron ERR-α y ERR-β mediante un rastreo de hibridación en condiciones poco restrictivas (Giguere, V. et al. Nature 1988, 331, 91-94) , seguidos más tarde por el descubrimiento de ERR-γ (Hong, H. et al. J. Biol. Chem. 1999, 274, 22618-22626) . Los ERR y los ER comparten una similitud secuencial, observándose la mayor homología en sus DBD, aproximadamente del 60%, y todos ellos interactúan con el elemento de respuesta a estrógenos de ADN clásico. Pruebas bioquímicas recientes sugirieron que los ERR y los ER comparten genes diana, incluyendo pS2, lactoferina, aromatasa y osteopontina, y comparten proteínas correguladoras (Giguere, V. Trends in Endocrinol. Metab. 2002, 13, 220-225; Vanacker, J. M. et al. EMBO J. 1999, 18, 4270-4279; Kraus, R. J. et al. J. Biol. Chem. 2002, 272, 24286-24834; Hong et al., 1999; Zhang, Z. y C. T. Teng. J. Biol. Chem. 2000, 275, 20387-20846) . Por lo tanto, una de las principales funciones de los ERR es la de regular la respuesta de los genes sensibles a estrógenos. El efecto de la hormona esteroidea estrógeno se media fundamentalmente en la mama, los huesos y el endometrio. Así pues, la identificación de los compuestos que interactuarán con los ERR será beneficiosa para el tratamiento de la enfermedad ósea, el cáncer de mama y la reproducción.
Se ha observado que ERR-α está presente en tejido mamario tanto normal como canceroso (Ariazi, E. A. et al. Cancer Res. 2002, 62, 6510-6518) . Se ha publicado que la principal función de ERR-α en el tejido mamario normal es la de inhibir los genes sensibles a los estrógenos. Se ha publicado que, en los cánceres de mama o las líneas celulares insensibles a los estrógenos (ER-α negativos) , ERR-α se encuentra en estado activado (Ariazi et al., 2002) . Por lo tanto, los compuestos que interactúen con ERR-α pueden ser agentes útiles para el tratamiento del cáncer de mama, es decir aquéllos que sean ER-α negativos e insensibles a la terapia antiestrogénica clásica, o se pueden usar como un agente adjunto para los cánceres de mama sensibles a los antiestrogénicos. Estos agentes pueden actuar como antagonistas mediante la reducción de la actividad biológica del ERR-α en estos tejidos en particular.
Muchas mujeres, tras la menopausia, experimentan osteoporosis, una afección producida por la reducción de la producción de estrógenos. La reducción de los niveles de estrógenos da como resultado un aumento de la pérdida ósea (Turner, R. T. et al. Endocrine Rev. 1994, 15 (3) , 275-300) . Se ha observado un efecto anabólico en el desarrollo óseo ante la administración de estrógenos a pacientes postmenopáusicas con osteoporosis (Pacifici, R. J. Bone Miner. Res. 1996, 11 (8) , 1043-1051) , pero se desconoce el mecanismo molecular, pues animales noqueados con ER-a y ER-b tienen defectos esqueléticos menores, en los que la acción de los estrógenos es mediada como de costumbre (Korach, K. S. Science 1994, 266, 1524-1527; Windahl, S.H. et al. J. Clin. Invest. 1999, 104 (7) , 895-901) . La expresión de ERR-α en los huesos está regulada por estrógeno (Bonnelye, E. et al. Mol. Endocrin. 1997, 11, 905-916; Bonnelye, E. et al. J. Cell Biol. 2001, 153, 971-984) . ERR-α se mantiene a través de etapas de... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de Fórmula (I) :
en la que X es S; n es 1-4; R1 es halo, alquilo (C1-C4) opcionalmente sustituido, alcoxilo (C1-C4) opcionalmente sustituido o hidroxilo; R2 se selecciona entre alquilo (C1-C3) halo-sustituido, ciano, halo, -C (O) NH2 y -C (O) O-alquilo (C1-C4) o, alternativamente, R2 está ligado a R3 para formar un arilo fusionado al anillo de fenilo al que R2 y R3 se muestran unidos; R3 es H o, alternativamente, R3 está ligado a R2 para formar un anillo de arilo fusionado al anillo de fenilo al que R3 y R2 se muestran unidos; R4 es halo, ciano, alquilo (C1-C3) halo-sustituido, -C≡CH, -C (O) O-alquilo (C1-C4) , -C (O) NH2 o -S (O2) -alquilo (C1-C4) ; y R5 y R6 son independientemente H o alquilo (C1-C4) opcionalmente sustituido o, alternativamente, R5 y R6 están ligados junto con el átomo de N al que están unidos para formar un heteroarilo que contiene N de 5-9 miembros opcionalmente sustituido o un heterociclilo que contiene N de 5-7 miembros opcionalmente sustituido;
o un isómero óptico, enantiómero, diastereómero, isómero cis-trans, racemato o sal farmacéuticamente aceptable del mismo.
2. El compuesto de la reivindicación 1, en el que R1 es alcoxilo (C1-C4) no sustituido.
3. El compuesto de la reivindicación 2, en el que R1 es –O-CH3.
4. El compuesto de la reivindicación 1, en el que R2 es CF3.
5. El compuesto de la reivindicación 1 o la reivindicación 4, en el que R3 es H.
6. El compuesto de la reivindicación 1, en el que R2 está ligado a R3 para formar un fenilo fusionado al anillo de fenilo 25 al que R2 y R3 se muestran unidos.
7. El compuesto de la reivindicación 1 o la reivindicación 4, en el que R4 es ciano.
8. El compuesto de la reivindicación 1, en el que R1 es -O-CH3; R2 es CF3;
R3 es H; R4 es CN; y X es S; R5 y R6 son independientemente alquilo (C1-C4) o, alternativamente, R5 y R6 están ligados junto con el átomo de N al que están unidos para formar un miembro opcionalmente sustituido seleccionado entre:
o un isómero óptico, enantiómero, diastereómero, racemato, isómero cis-trans o sal farmacéuticamente aceptable del mismo.
9. El compuesto de la reivindicación 8, en el que R5 y R6 son -CH3 o, alternativamente, R5 y R6 están ligados junto con el átomo de N al que están unidos para formar un miembro opcionalmente sustituido seleccionado entre:
10. El compuesto de la reivindicación 1 seleccionado entre:
4. {2-Metoxi-4-[3- (2-morfolin-4-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-fenoxi}-3-trifluorometil-benzonitrilo;
4-{4-[3- (2-Dimetilamino-etil) -2, 4-dioxo-tiazolidin-5-ildenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4Dioxo-3- (2-pirrolidin-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4- (2-Metoxi-4-{3-[2- (4-metil-piperazin-1-il) -etil]-2, 4-dioxo-tiazolidin-5-ilidenometil}-fenoxi) -3-trifluorometilbenzonitrilo; 4-{4-[3- (2-Dimetilamino-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-fluoro-fenoxi}-3-trifluorometil-benzonitrilo;
4-{2-Fluoro-4-[3- (2-morfolin-4-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Dietilamino-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Imidazol-1-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-piperidin-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-pirazol-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo;
4-{4-[2, 4-Dioxo-3- (2-[1, 2, 4]triazol-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-triftuorometil-benzonitrilo; 4-{4-[3- (2-Azepan-1-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-pirrol-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; y 4-{4-[2, 4-Dioxo-3- (2-pirrolidin-1-il-etil) -tiazolidin-5-ilidenometil]-2-fluoro-fenoxi}-3-trifluorometil-benzonitrilo.
11. El compuesto de la reivindicación 1, que es:
12. El compuesto de la reivindicación 1, que es:
13. El compuesto de la reivindicación 1, que es:
14. El compuesto de la reivindicación 1, que es:
15. Una composición farmacéutica que comprende al menos un compuesto de la reivindicación 1 y al menos un 5
vehículo farmacéuticamente aceptable.
16. Una composición farmacéutica de la reivindicación 15, que comprende además al menos un agente, fármaco, medicamento, anticuerpo y/o inhibidor adicional para tratar, mejorar o prevenir una enfermedad mediada por ERR-α.
17. La composición farmacéutica de la reivindicación 15 que comprende al menos un compuesto seleccionado entre:
4-{2-Metoxi-4-[3- (2-morfolin-4-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Dimetilamino-etil) -2, 4-dioxo-tiazolidin-6-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-pirrolidin-1-il-etil) tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; y 4- (2-Metoxi-4-{3-[2- (4-metil-piperazin-1-il) -etil]-2, 4-dioxo-tiazolidin-5-ilidenometil}-fenoxi) -3-trifluorometilbenzonitrilo; 4-{4-[3- (2-Dimetilamino-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-fluoro-fenoxi}-3-trifluorometil-benzonitrilo; 4-{2-Fluoro-4-[3- (2-morfolin-4-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Dietilamino-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Imidazol-1-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-piperidin-1-il-etil) -tiazolidin-5-ilidenometi]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3 (2-pirazol-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-[1, 2, 4]triazol-1-il-etil) -tiazolidin-6-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[3- (2-Azepan-1-il-etil) -2, 4-dioxo-tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; 4-{4-[2, 4-Dioxo-3- (2-pirrol-1-il-etil) -tiazolidin-5-ilidenometil]-2-metoxi-fenoxi}-3-trifluorometil-benzonitrilo; y 4-{4-[2, 4-Dioxo-3- (2-pirrolidin-1-il-etil) -tiazolidin-5-ilidenometil]-2-fluoro-fenoxi}-3-trifluorometil-benzonitrilo.
18. La composición farmacéutica de la reivindicación 17 que comprende, al menos:
19. Un compuesto según lo definido en la reivindicación 1 para su uso en un procedimiento para tratar a un sujeto que padece o ha sido diagnosticado de una enfermedad, afección o trastorno mediado por la actividad ERR-α.
20. El compuesto para su uso según lo reivindicado en la reivindicación 19, en el que la enfermedad, el trastorno o la afección médica se selecciona del grupo que consiste en enfermedad ósea, formación de huesos, formación de cartílagos, pérdida de cartílagos, degeneración de cartílagos, lesión de cartílagos, espondilitis anquilosante, lesión crónica de espalda, gota, osteoporosis, metástasis ósea osteolítica, mieloma múltiple, condrosarcoma, condrodisplasia, osteogénesis imperfecta, osteomalacia, enfermedad de Paget, polimialgia reumática, pseudogota, artritis, artritis reumatoide, artritis infecciosa, osteoartritis, artritis psoriática, artritis reactiva, artritis de la niñez, Síndrome de Reiter y lesión por estrés repetitivo.
21. El compuesto para su uso según lo reivindicado en la reivindicación 19, en el que la enfermedad, el trastorno o la afección se selecciona del grupo que consiste en enfermedad periodontal, enfermedad inflamatoria de las vías respiratorias crónica, bronquitis crónica y enfermedad pulmonar obstructiva crónica.
22. El compuesto para su uso según lo reivindicado en la reivindicación 19, en el que la enfermedad, el trastorno o la afección es cáncer de mama.
23. El compuesto para su uso según lo reivindicado en la reivindicación 19, en el que la enfermedad, el trastorno o la afección se seleccionan del grupo que consiste en síndrome metabólico, obesidad, trastornos de la homeostasis energética, diabetes, trastornos lipídicos, trastornos cardiovasculares, arteriosclerosis, hiperglucemia, nivel elevado de glucosa en sangre y resistencia a la insulina.
24. El compuesto para su uso según lo reivindicado en la reivindicación 19, en el que el tratamiento comprende administrar al sujeto una cantidad terapéuticamente eficaz de (a) al menos un compuesto de la reivindicación 1; y (b) al menos un agente adicional seleccionado entre un agonista inverso de ERR-α, un segundo antagonista de ERR-α, un modulador de glucoquinasa, un agente anti-diabético, un agente anti-obesidad, un agente reductor de lípidos, un agente anti-trombótico, un inhibidor directo de la trombina y un agente reductor de la presión sanguínea, siendo dicha administración en cualquier orden.
25. El compuesto para su uso según lo reivindicado en la reivindicación 24, en el que el agente adicional de (b) es un segundo agonista inverso de ERR-α diferente del compuesto de (a) .
26. El compuesto para su uso según lo reivindicado en la reivindicación 24, en el que el agente adicional de (b) es un agente anti-obesidad seleccionado entre antagonistas de CB1, inhibidores de la recaptación de la monoamina e inhibidores de la lipasa.
27. El compuesto para su uso según lo reivindicado en la reivindicación 24, en el que el agente adicional de (b) se selecciona entre rimonabant, sibutramina y orlisat.
28. Un compuesto según lo definido en la reivindicación 1 para su uso en un procedimiento para prevenir o inhibir la progresión de una afección mediada por ERR-α en un sujeto en necesidad del mismo.
29. Un compuesto según lo definido en la reivindicación 1 para su uso en un procedimiento para prevenir o inhibir la aparición de una afección prediabética en un sujeto en necesidad del mismo.
30. El compuesto para su uso según lo reivindicado en la reivindicación 19, 28 ó 29, en el que dicho tratamiento, dicha prevención o dicha inhibición comprende administrar a dicho sujeto una cantidad terapéuticamente eficaz de al menos un compuesto según la reivindicación 1.
31. El compuesto para su uso según lo reivindicado en la reivindicación 30, en el que la cantidad terapéuticamente eficaz del compuesto de la reivindicación 1 es de aproximadamente 0, 1 mg/dosis a aproximadamente 5 g/dosis.
32. El compuesto para su uso según lo reivindicado en la reivindicación 30, en el que la cantidad terapéuticamente eficaz del compuesto de la reivindicación 1 es de aproximadamente 0, 5 mg/dosis a aproximadamente 1.000 mg/dosis.
33. El compuesto para su uso según lo reivindicado en la reivindicación 30, en el que la cantidad terapéuticamente 15 eficaz del compuesto de la reivindicación 1 es de aproximadamente 1 mg/dosis a aproximadamente 100 mg/dosis.
34. Un procedimiento para fabricar una composición farmacéutica que comprende mezclar cualquiera de los compuestos según la reivindicación 1 y un vehículo farmacéuticamente aceptable.
Patentes similares o relacionadas:
Ligandos novedosos del receptor de estrógenos, del 17 de Julio de 2019, de Karo Pharma AB: Compuesto de fórmula (I) o un éster, una amida, un carbamato o una sal farmacéuticamente aceptable del mismo, que incluye una sal de tal […]
Métodos para tratar el síndrome de fuga vascular, del 18 de Abril de 2018, de Akebia Therapeutics Inc: Un compuesto para su uso en el tratamiento del síndrome de fuga vascular, teniendo el compuesto la fórmula I:**Fórmula** en la que R es una unidad […]
Antagonistas de TRPM8, del 18 de Abril de 2018, de DOMPE' FARMACEUTICI S.P.A.: Compuesto que tiene la fórmula I:**Fórmula** y sales farmacéuticamente aceptables del mismo, en la que: X se selecciona de S u O; R1 se selecciona del […]
Sales de tiazolidinadiona ahorradoras de PPAR para el tratamiento de enfermedades metabólicas, del 8 de Noviembre de 2017, de Cirius Therapeutics, Inc: Una sal del compuesto A**Fórmula**
Nueva síntesis de compuestos de tiazolidindiona, del 26 de Octubre de 2016, de Octeta Therapeutics, LLC: Un compuesto que tiene la estructura **Fórmula**
Derivados de tiazolidinediona, su preparación y su utilización en el tratamiento de cánceres, del 5 de Octubre de 2016, de Université de Lorraine: Compuesto de fórmula (I)**Fórmula** caracterizado por que presenta, a una concentración de 100 μM, una viabilidad hepatocitaria superior al 60%, y por […]
Composición farmacéutica que comprende pioglitazona y glimepirida para uso en el tratamiento de diabetes, del 14 de Septiembre de 2016, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Una composición farmacéutica que comprende un mejorador de la sensibilidad a la insulina seleccionado de la pioglitazona, o una sal farmacológicamente aceptable de […]
Derivados del 4-feniltiazol y su utilización como medicamentos para el tratamiento de enfermedades neurodegenerativas, el dolor y la epilepsia, del 13 de Abril de 2016, de IPSEN PHARMA: Compuesto elegido entre los siguientes compuestos: - 2,6-di-terc-butil-4-{2-[3-metil-1-(metilamino)butil]-1,3-tiazol-4-il}fenol; - 2,6-di-terc-butil-4-{2-(1S)-1-(metilamino)etil]-1,3-tiazol-4-il}fenol; […]