UN MÉTODO PARA LA PREPARACIÓN DE DEXLOXIGLUMIDA CRISTALINA.
Un método para la preparación de dexloxiglumida cristalina mediante cristalización del producto en bruto a partir de un disolvente,
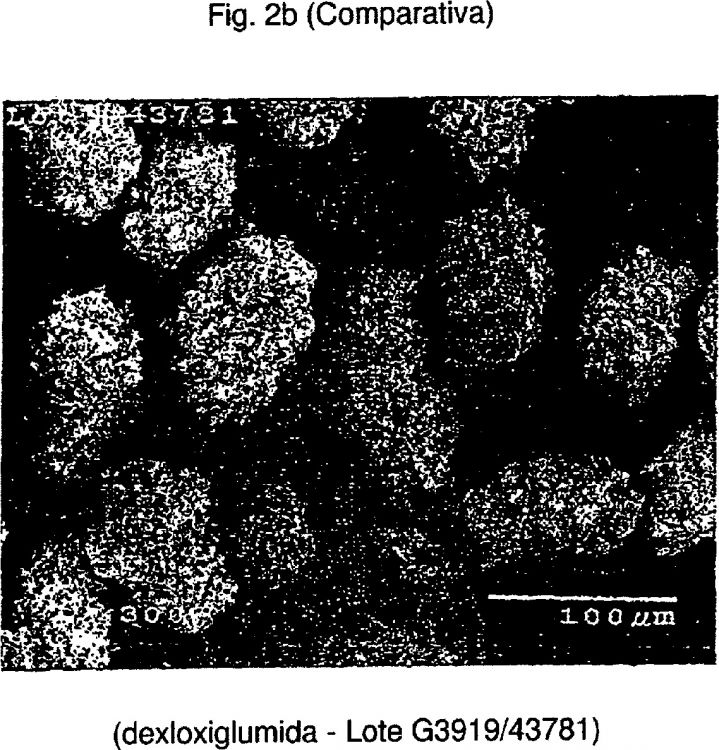
caracterizado porque se usa isopropil-éter como disolvente y porque la etapa de cristalización se realiza añadiendo una semilla de dexloxiglumida microcristalina que tiene un tamaño medio de partículas (D50) ≤q 20 μm (método de medición realizado mediante difracción de luz láser con el instrumento Malvern Master Sizer 2000) a una solución supersaturada de dexloxiglumida en bruto, en el que la semilla es añadida a dicha solución supersaturada de dexloxiglumida en bruto que es mantenida a una temperatura entre 35 y 40ºC, en una relación de una parte de material de semilla a 40-200 partes de producto en bruto, y en el que la dexloxiglumida así preparada está en forma de partículas cristalinas que tienen un porcentaje en volumen de menos de 15% de partículas finas que tienen dimensiones de menos de 10 μm y un valor del tamaño medio de partículas (D50) entre 50 y 130 μm (método de medición realizado mediante difracción de luz láser con el instrumento Malvern Master Sizer 2000)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/002208.
Solicitante: ROTTAPHARM S.P.A..
Nacionalidad solicitante: Italia.
Dirección: GALLERIA UNIONE 5 20122 MILANO ITALIA.
Inventor/es: MAKOVEC, FRANCESCO, ROVATI, LUCIO, CLAUDIO.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Junio de 2004.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C07C237/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 237/00 Amidas de ácidos carboxílicos, estando sustituida la estructura carbonada de la parte ácida por grupos amino. › con átomos de nitrógeno de grupos amino unidos a la estructura carbonada de la parte ácida, acilados.
Clasificación PCT:
- C07C231/24 C07C […] › C07C 231/00 Preparación de amidas de ácidos carboxílicos. › Separación; Purificación.
- C07C233/12 C07C […] › C07C 233/00 Amidas de ácidos carboxílicos. › con el átomo de nitrógeno de al menos uno de los grupos carboxamido unido a un átomo de carbono de un radical hidrocarbonado sustituido por átomos de halógeno o por grupos nitro o nitroso.
Clasificación antigua:
- C07C231/24 C07C 231/00 […] › Separación; Purificación.
- C07C233/12 C07C 233/00 […] › con el átomo de nitrógeno de al menos uno de los grupos carboxamido unido a un átomo de carbono de un radical hidrocarbonado sustituido por átomos de halógeno o por grupos nitro o nitroso.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
Fragmento de la descripción:
Un método para la preparación de dexloxiglumida cristalina.
El objeto de la presente invención es un nuevo método para la preparación, mediante cristalización de isopropil-éter, de ácido (R)-4-[(3,4-diclorobenzoil)amino]-5-[(3-metoxipropil)pentilamino]-5-oxo-pentanoico (dexloxiglumida, CR 2017); fórmula molecular: C21H30Cl2N2O5; número de registro CAS: 119818-90-2.
La dexloxiglumida, el compuesto que es el objeto de la presente invención, se ha mostrado que posee una potente actividad antagonista hacia el receptor de colecistoquinina de tipo 1 (CCK1). Por lo tanto, la dexloxiglumida puede ser ventajosamente usada para el tratamiento de diversas enfermedades en el hombre como algunos estados patológicos del tracto gastrointestinal, por ejemplo, síndrome de irritación de colon, dispepsia no ulcerativa, cólico biliar y disquinesia, reflujo gastro-esofágico, pancreatitis o, más generalmente, trastornos de movilidad gastrointestinal.
La preparación y algunas actividades farmacológicas de este compuesto han sido ya descritas, por ejemplo, en la patente de Estados Unidos US 5.602.179.
Los siguientes documentos describen los fundamentos de la técnica referidos a la dexloxiglumida:
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; KATSCHINSKI, Martin. "Loxiglumide. Rotta Research" XP002306781 recuperado de base de datos STN, nº de acceso 2002: 580170;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; VARGA Gabor: "Dexloxiglumide (Rotta Research Lab.)" XP002306782 recuperado de base de datos STN, nº de acceso 2001: 580010;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; FRIED M. et al.: "The role of fat and cholecystokinin in functional dyspepsia" XP002306783 recuperado de base de datos STN, nº de acceso 2002: 577063;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; PERSIANI S. et al.: "Pharmacokinetics of dexloxiglumide after administration of single and repeat oral escalating dosis in healthy young males" XP002306784 recuperado de base de datos STN, nº de acceso 2002: 485631;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; MASELLI M. A. et al.: "Effect of three non-peptide cholecystokinin antagonists on human isolated gallbladder" XP002306785 reecuperado de base de datos STN, nº de acceso 2002: 50662;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; REVEL, Laura et al.: "Dexloxiglumide: CCK1 (CCKA) repector antagonist treatment of irritable bowel syndrome" XP002306939 recuperado de base de datos STN, nº de acceso 1999: 656782;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; VARGA Gabor et al.: "Different actions of CCK on pancreatic and gastric growth in the rat: effect of CCKA receptor blockade" XP002306940 recuperado de base de datos STN, nº de acceso 1998: 370098;
- BASE DE DATOS CA [Online] CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; SCARPIGNATO, C. et al: "Effect of dexloxiglumide and spiroglumide; two new CCK-receptor antagonists, on gastric emptying and secretion in the rat: evaluation of their receptor selectivity in vivo" XP002306786 recuperado de base de datos STN, nº de acceso 1196: 398396.
En el documento US 5.602.179, la purificación final del producto se realizó mediante cristalización en una mezcla de H2O/alcohol con una relación de 2:1 (v/v). Esta purificación hizo posible que se obtuviera un compuesto químicamente puro, es decir, con una pureza química y una pureza óptica de más de 99,5%.
Sin embargo, las características reológicas del producto así obtenido fueron bastante insatisfactorias debido a que el cristal tenía escasas propiedades de capacidad de flujo, que impedían su uso ventajoso para la preparación de formas farmacéuticas orales como, por ejemplo, comprimidos.
Además de ello, el intento de variar las proporciones relativas de los dos componentes de la mezcla acuosa/alcohóli-ca no mejoró las características de la materia prima que, por el contrario, tenía todavía mezclas de polimorfos.
Un primer objeto de la invención es proporcionar un método que permita la producción de un producto cristalino que esté exento de formas polimorfas y que tenga una forma cristalina y una distribución de tamaños de partículas que tenga las propiedades físicas deseadas adecuadas para la preparación de formas farmacéuticas para un uso oral a una escala industrial.
Un objeto particular de la invención es proporcionar un método que pueda producir dexloxiglumida cristalina que tenga características de capacidad de flujo adecuadas para la formulación de comprimidos.
La capacidad de flujo es quizá la más importante de las propiedades físicas de cualquier polvo que esté destinado para ser usado en formulaciones de comprimidos. Una capacidad de flujo escasa significa de hecho que el polvo será difícil de manejar, tendiendo a adherirse a las diversas superficies que estén en contacto con los materiales, provocando así problemas en el suministro a las cámaras de medición y compresión del procedimiento.
Esto ocurre a menudo cuando un procedimiento de cristalización incontrolada produce cristales de tamaños y formas grandemente diferentes, en los que los cristales más pequeños de formas más o menos diferentes se acumulan de forma no uniforme sobre los cristales más grandes. La distribución de los tamaños de partículas es generalmente polimodal en estos casos y, por tanto, es difícil obtener un producto que tenga una distribución específica y reproducible de tamaños de partículas.
Por tanto, es importante, desde el punto de vista de un procedimiento industrial, obtener un producto en el cual, una vez que se haya identificado una distribución óptima del tamaño y la forma cristalina, estos permanezcan constantes y reproducibles.
Otro objeto de la invención es proporcionar un método que haga posible una distribución gaussiana o unimodal de los tamaños de partículas o, incluso, una distribución bimodal en la que el pico correspondiente a la distribución cuantitativamente más pequeña no sobrepase un 10-15% en peso del total.
En vista de los objetos anteriormente mencionados, el tema de la invención es un método como se define en las reivindicaciones adjuntas y el uso de este método para la preparación de comprimidos farmacéuticos.
Una vez que se han identificado el disolvente de cristalización elegido, en este caso isopropil-éter, que hizo posible que se obtuviera un polvo con un elevado grado de pureza, rendimiento de cristalización elevado, facilidad de secado y con una forma cristalina pura exentas de formas polimorfas, se realizaron numerosos experimentos con el fin de identificar las condiciones de cristalización ideales que permitieran la preparación, cuando fuera posible, de un polvo que tenga una morfología y un tamaño de partículas que le proporcionen capacidad de flujo y características de compresibilidad adecuadas para ser usados en prensas rotatorias.
Se encontró también que, con el fin de que este producto posea buenas características de capacidad de flujo, el nivel de partículas finas (<10 μm) tenía que estar limitado y, en cualquier caso, no ser superior al 15%.
Con el fin de intentar obtener un polvo que fuera adecuado para una compresión con respecto tanto a la morfología como al tamaño de partículas, se evaluaron y se optimizaron numerosos parámetros, estos fueron, por ejemplo, la relación óptima de soluto/disolvente, es decir, la relación de dexloxiglumida/isopropil-éter, la calidad y cantidad del material de semilla, teniendo en cuenta que el material de semilla debe tener un tamaño de granos suficientemente fino con el fin de que el área superficial de la semilla fuera grande en relación a la masa total, la temperatura a la que el material de semilla se añadía a la solución supersaturada del producto en bruto y la curva de la relación de enfriamiento del sistema.
Como se indicó anteriormente, el producto obtenido como se describe en la patente US 5.602.179, es decir, mediante purificación final con una mezcla acuosa/alcohólica, tenía características reológicas desfavorables.
Las técnicas que son generalmente usadas...
Reivindicaciones:
1. Un método para la preparación de dexloxiglumida cristalina mediante cristalización del producto en bruto a partir de un disolvente, caracterizado porque se usa isopropil-éter como disolvente y porque la etapa de cristalización se realiza añadiendo una semilla de dexloxiglumida microcristalina que tiene un tamaño medio de partículas (D50)
2. Un método según la reivindicación 1, caracterizado porque se usa una relación de una parte en peso de producto en bruto con una cantidad entre 1,5 y 3 partes en volumen de disolvente de isopropil-éter.
3. Un método según la reivindicación 1 ó 2, caracterizado porque, después de la adición del material de semilla, la masa de reacción es agitada a una temperatura entre 34 y 38ºC, durante un período entre 2 y 8 h y seguidamente la temperatura de la masa de reacción es reducida de forma lenta, con agitación, a 10
4. Un método según la reivindicación 1, en el que la dexloxiglumida está en una forma de partículas cristalinas que tiene un valor del tamaño medio de partículas (D50) entre 80 y 100 μm.
5. Un método según la reivindicación 4, en el que la dexloxiglumida tiene una distribución de tamaño de partículas con un índice de extensión de menos de 2,5.
6. Uso de un método según cualquiera de las reivindicaciones 1 a 5, para la preparación de un comprimido farmacéutico.
Patentes similares o relacionadas:
Nuevo procedimiento, del 2 de Octubre de 2019, de CAMBREX KARLSKOGA AB: Una sal de fórmula I,**Fórmula** o un solvato de la misma.
Compuestos para dirigir la administración de fármacos y potenciar la actividad de ARNip, del 7 de Agosto de 2019, de NITTO DENKO CORPORATION: Compuesto para facilitar la administración de fármacos a una célula diana, que consiste en la estructura (retinoide)m-grupo de unión-(retinoide)n; en el que […]
Derivados de colchicina novedosos, métodos y usos de los mismos, del 12 de Junio de 2019, de ALBERTA HEALTH SERVICES: Compuesto de: **Fórmula** sal farmacéuticamente aceptable, hidrato, solvato, tautómero, isómero óptico, o combinación del mismo, en las que: R3 se selecciona de […]
Composiciones que comprenden profármacos de anfetamina escindibles enzimáticamente e inhibidores de los mismos, del 26 de Abril de 2019, de Signature Therapeutics, Inc: Una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable y una cantidad terapéuticamente eficaz de un compuesto […]
Inhibidores de KDM1A para el tratamiento de enfermedades, del 24 de Abril de 2019, de Imago Biosciences Inc: Un compuesto de Fórmula I:**Fórmula** o una de sus sales, en donde: Y se elige entre un enlace, NR4a, O, C(O)NH, NHC(O), S, SO2 y CH2; Z se elige entre un enlace, […]
Composiciones terapéuticamente activas y su método de uso, del 20 de Marzo de 2019, de Agios Pharmaceuticals, Inc: Un compuesto de fórmula II:**Fórmula** o una sal farmacéuticamente aceptable del mismo, donde: R1 se selecciona entre ciclohexilo, ciclopentilo, […]
Compuestos terapéuticamente activos y sus métodos de uso, del 5 de Febrero de 2019, de Agios Pharmaceuticals, Inc: Un compuesto de fórmula I o una sal o hidrato farmacéuticamente aceptable del mismo, en el que:**Fórmula** ; cada R2 y R3 se selecciona independientemente de arilo […]
Derivados de lactama útiles como inhibidores de IDH1 mutante, del 11 de Octubre de 2018, de Agios Pharmaceuticals, Inc: Un compuesto de fórmula I o su sal farmacéuticamente aceptable, tautómero, isotopólogo o hidrato farmacéuticamente aceptable, en donde: R1 es carbociclilo […]