AMPLIFICACION PROTEOMICA DE PEQUEÑAS MOLECULAS QUE SE UNEN A PROTEINAS CELULARES DIANA.
Procedimiento para evaluar la afinidad de unión de un componente diana de un analito a un compuesto que comprende (a) poner en contacto una primera alícuota del analito con un soporte sólido en el que se inmoviliza el compuesto;
(b) poner en contacto una segunda alícuota del analito con un soporte sólido como en (a), separando posteriormente la segunda alícuota del analito de dicho soporte sólido; (c) poner de nuevo en contacto el analito separado de la etapa (b) con un soporte sólido como en (a); (d) determinar las cantidades del componente diana unido al soporte sólido en las etapas (a) y (c); y (e) comparar la cantidad de componente diana unido al soporte sólido en la etapa (a) con la cantidad de componente diana unido al soporte sólido de la etapa (c)
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07117996.
Solicitante: MAX-PLANCK-GESELLSCHAFT ZUR FORDERUNG DER WISSENSCHAFTEN E.V..
Nacionalidad solicitante: Alemania.
Dirección: HOFGARTENSTRASSE 8 80539 MUNCHEN ALEMANIA.
Inventor/es: WEBER, CHRISTOPH, GODL, KLAUS, DAUB, HENRIK, BAIRLEIN,MICHAELA, SHARMA,KIRTI, TEBBE,ANDREAS.
Fecha de Publicación: .
Fecha Solicitud PCT: 5 de Octubre de 2007.
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- C12Q1/48B
- G01N33/543B
Clasificación PCT:
- C12Q1/48 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una transferasa.
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Amplificación proteómica de pequeñas moléculas que se unen a proteínas celulares diana.
Campo de la invención
La presente invención está relacionada con métodos para la evaluación y/o cuantificación de la afinidad de unión de moléculas pequeñas u otros compuestos a componentes diana contenidos dentro de un analito, tales como proteínas diana contenidas dentro del proteoma de una célula o tejido.
Antecedentes de la invención
La industria farmacéutica en la actualidad se enfrenta a dos retos fundamentales en su procedimiento de desarrollo de fármacos, concretamente la identificación de proteínas diana apropiadas para intervención en enfermedad y la identificación de candidatos a fármaco de alta calidad que actúan específicamente en estas dianas. Estos dos retos son de máxima importancia en el diseño de medicinas exitosas.
La intervención con compuestos de bajo peso molecular representa un concepto terapéutico fundamental para el tratamiento de trastornos humanos. Debido a sus papeles clave en los procesos de transducción de señales implicados en la aparición y progreso de varias enfermedades tales como cánceres humanos, diversos miembros de la superfamilia de enzimas proteína quinasa se han fijado considerablemente como objetivos por moléculas pequeñas que interrumpen sus funciones catalíticas. Estos esfuerzos en el desarrollo de fármacos han proporcionado una plétora de herramientas para la disección de la señalización celular mediante enfoques genéticos químicos. A diferencia de la inactivación genética clásica, la inhibición de moléculas pequeñas puede modular selectivamente la actividad catalítica de una proteína quinasa de un modo que es rápido, ajustable y, en la mayoría de los casos, reversible. Además, muchas interacciones proteína-proteína formadas mediante proteínas quinasas se preservan en presencia de antagonistas de moléculas pequeñas y pueden por lo tanto diseccionarse a partir de sus funciones catalíticas.
A pesar de estas obvias ventajas, los antagonistas de moléculas pequeñas desarrollados para inhibición de quinasas tienen el potencial de inactivar varias dianas en células intactas, debido a elementos estructurales comunes que se encuentran en los dominios catalíticos de diferentes proteínas quinasas o incluso miembros de otras familias enzimáticas. La selectividad de los inhibidores de quinasa puede evaluarse mediante actividad paralela in vitro o ensayos de unión para grandes cantidades de proteínas quinasas recombinantes (Fabian, M.A. et al., Nat. Biotechnol. 23, 329-36 (2005); Davies, S.P. et al., Biochem. J. 351, 95-105 (2000)). Este enfoque proporciona sin duda datos cuantitativos y valiosos acerca de la selectividad de los fármacos, pero tiene dos limitaciones principales: Primero, además de una parte significativa del complemento de proteína quinasa (= el quinoma), las dianas potenciales de otras clases enzimáticas están poco representadas o completamente ausentes de estos formatos de exploración. En segundo lugar, y quizás de forma más importante, la colección de quinasas recombinantes incluidas en un panel de selectividad no se ajusta al perfil celular de dianas potenciales expresadas en, por ejemplo, un sistema celular en el que se investigan los efectos biológicos de un inhibidor de quinasa.
Estos defectos pueden abordarse con enfoques proteómicos, que emplean compuestos inmovilizados, por ejemplo, inhibidores de quinasa, para la purificación selectiva por afinidad de proteínas diana en combinación con identificación de proteínas, por ejemplo, mediante espectrometría de masas (MS). Esta sencilla técnica se ha usado con éxito para identificar los componentes diana de diversos inhibidores de quinasa en extractos celulares. Sin embargo, la identificación de componentes diana estaba limitada en el sentido de que las afinidades del inhibidor hacia sus parejas de unión celular no pudieron inferirse a partir de los datos de MS. Para obtener información cuantitativa adicional, fue necesario recurrir a ensayos de actividad in vitro secundarios para identificar las dianas de inhibidor que se inhibían potentemente y por lo tanto eran potencialmente relevantes para las acciones celulares observadas del fármaco. Sin embargo, en la práctica, es un desafío evaluar el espectro de dianas completo de un fármaco de molécula pequeña debido al hecho de que las proteínas recombinantes requeridas no están todas disponibles o los ensayos in vitro demuestran ser difíciles de establecer.
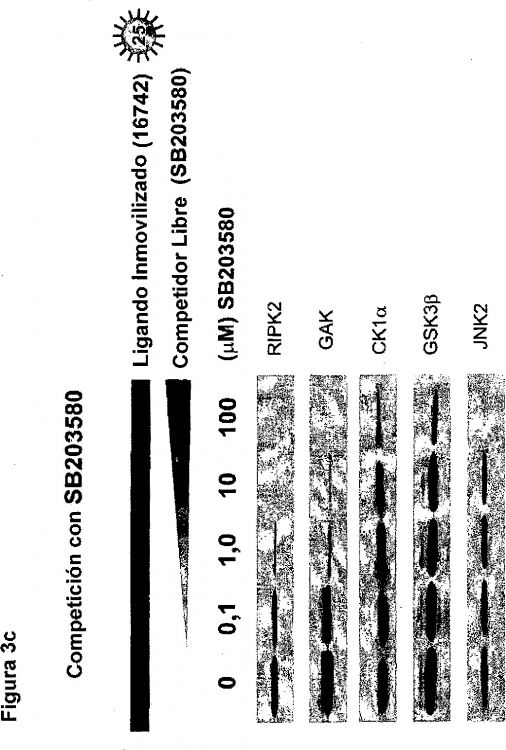
El documento US 5324633 describe un método para medir la afinidad de unión de un receptor a un ligando, de manera que un conjunto de polímeros, que se sintetizan o inmovilizan en un sustrato, se exponen a un receptor marcado con fluorescencia en soluciones de diversa concentración y la intensidad de fluorescencia del receptor marcado se mide por medio de, por ejemplo, un contador de fotones que usa microscopía confocal. Un método para identificar dianas de SB 203580 mediante la inmovilización de un análogo de SB 203580 adecuado y cromatografía de afinidad se describe en Godl et al., Proc Natl Acad Sci U S A. 2003 Dec 23; 100(26):15434-9, que permitió el enriquecimiento e identificación de dianas de proteína quinasa de SB 203580. Una técnica general libre de radiomarcaje sin modificación o inmovilización de los compuestos o de la partícula diana para clasificar las afinidades de unión proteína-ligando y determinar la competición alostérica contra la de sitio de unión directa en mezclas de compuestos se describe en Annis DA et al., J Am Chem Soc. 2004 Dec 1; 126(47):15495-503. El documento US 2007087348 (A1) describe un método para determinar uno o más parámetros cinéticos de unión entre un primer miembro de unión y un segundo miembro de unión mediante la adsorción del primer miembro de unión a una superficie en una pluralidad de micropuntos. El segundo miembro de unión se presenta después al primer miembro de unión en cada uno de los micropuntos, existiendo una pluralidad de combinaciones de densidad de superficie del primer miembro de unión y concentración del segundo miembro de unión entre la pluralidad de micropuntos. Se obtienen después datos indicativos de una reacción de unión entre el primero de los micropuntos y se analizan para obtener uno o más parámetros cinéticos de la unión entre el primer y segundo miembros de unión. Valsasina B et al., da una visión de conjunto de algunos ejemplos de perfilación de selectividad de quinasas mediante cromatografía por afinidad con el inhibidor (Expert Rev Proteomics. 2004 Oct; 1(3):303-15). Un método de espectrometría de masas por selección de afinidad (AS-MS) para medidas cuantitativas de afinidad de unión proteína-ligando (Kd) en grandes bibliotecas de compuestos, mediante el que la capacidad de un ligando de valoración para desplazar un miembro de la biblioteca unido a diana, como se midió mediante MS, revela la clasificación de afinidad del componente de la mezcla con relación a compuestos "calibrantes por afinidad interna" de afinidad conocida para la diana CDK2 se describe en Annis DA et al., Anal Chem. 2007 Jun 15; 79(12):4538-42.
Lowe y colaboradores determinan la constante de disociación (KL) de lactato deshidrogenasa (componente diana del analito) para 5'-AMP inmovilizado (ligando inmovilizado) en presencia de un NADH competidor en condiciones de lote. Basándose en volúmenes de elución KL puede calcularse, siempre que Ki sea conocido (C. R. Lowe, et al., Eur. J. Biochem., 1974, Vol. 42, páginas 1-6).
Un conocimiento exhaustivo de las proteínas celulares marcadas como objetivo por la intervención de moléculas pequeñas es un prerrequisito para definir interacciones químico biológicas a nivel molecular (Daub, H. et al., Assay Drug Dev. Technol. 2, 215-24 (2004); Fabian, M. A. et al., Nat. Biotechnol. 23, 329-36 (2005)). Aunque las técnicas de purificación por afinidad junto con la espectrometría de masas (MS) se han usado exitosamente para identificar las proteínas interactuantes de inhibidores de moléculas pequeñas inmovilizadas, estos enfoques previos proteómicos no suministran información de afinidades de dianas celulares (Godl, K. et al., PNAS U.S.A., 100, 15434-9 (2003); Brehmer, D. et al., Cancer Res. 65, 379-82 (2005); Daub, H., Biochim. Biophys. Acta 1754, 183-90 (2005)).
Existe por lo tanto la necesidad de métodos de proteómica que permitan la evaluación o determinación directa cualitativa y/o cuantitativa...
Reivindicaciones:
1. Procedimiento para evaluar la afinidad de unión de un componente diana de un analito a un compuesto que comprende
2. Procedimiento de la reivindicación 1, que comprende adicionalmente poner en contacto una tercera alícuota de dicho analito con un soporte sólido como en (a), que no tiene, sin embargo, dicho compuesto inmovilizado en él y determinar la cantidad de componente diana unido a dicho soporte sólido;
en el que la etapa (e) comprende adicionalmente comparar las cantidades de componente diana unido al soporte sólido en las etapas (a) y (c) con la cantidad de componente diana unido a dicho soporte sólido que no tiene dicho compuesto inmovilizado en él.
3. Procedimiento para evaluar la afinidad de unión de un componente diana de un analito a un compuesto que comprende
4. Procedimiento de la reivindicación 3, en el que la relación de las concentraciones en las que se inmoviliza el compuesto en el soporte sólido en las etapas (a) y (b) se selecciona de las relaciones de aproximadamente 1:2, aproximadamente 1:3, aproximadamente 1:4, aproximadamente 1:5, aproximadamente 1:6, aproximadamente 1:7, aproximadamente 1:8, aproximadamente 1:9 o aproximadamente 1:10.
5. Procedimiento de la reivindicación 3, en el que la relación de las concentraciones en las que el compuesto se inmoviliza en el soporte sólido en las etapas (a), (b) y (c) se selecciona de las relaciones de aproximadamente 1:2:4, aproximadamente 1:3:9, aproximadamente 1:4:16, aproximadamente 1:5:25, aproximadamente 1:6:36, aproximadamente 1:7:49, aproximadamente 1:8:64, aproximadamente 1:9:81 o aproximadamente 1:10:100.
6. Procedimiento de las reivindicaciones 3 a 5, que comprende adicionalmente poner en contacto una cuarta alícuota de dicho analito con un soporte sólido como en (a) que, sin embargo, no tiene dicho compuesto inmovilizado en él y determinar la cantidad de componente diana unido a dicho soporte sólido; donde la etapa (e) comprende adicionalmente comparar las cantidades de componente diana unido al soporte sólido en las etapas (a) y (b) y, si el procedimiento comprende la etapa (c), también la cantidad de componente diana unido al soporte sólido en la etapa (c) con la cantidad de componente diana unido a dicho soporte sólido que no tiene dicho compuesto inmovilizado en él.
7. Procedimiento para evaluar la afinidad de unión de un componente diana de un analito a un compuesto competidor que comprende
8. Procedimiento de la reivindicación 7, que comprende adicionalmente poner en contacto una cuarta alícuota de dicho analito con un soporte sólido como en (a), en el que el contacto se realiza, sin embargo, en ausencia de dicho compuesto competidor;
en el que la etapa (e) comprende adicionalmente comparar las cantidades de componente diana unido al soporte sólido en las etapas (a) y (b) y, si el procedimiento comprende la etapa (c), también la cantidad de componente diana unido al soporte sólido en la etapa (c) con la cantidad de componente diana unido a dicho soporte sólido en ausencia de dicho compuesto competidor.
9. Procedimiento de cualquiera de las reivindicaciones precedentes, en el que los componentes diana del analito se marcan con un marcador detectable.
10. Procedimiento de la reivindicación 9, en el cual dicho marcador detectable es diferente en cada alícuota.
11. Procedimiento de las reivindicaciones 9 ó 10, en el cual los componentes diana del analito son péptidos o proteínas, dicho marcaje se realiza mediante el procedimiento SILAC (marcaje de isótopos estables con aminoácidos en cultivo celular) y en el cual dicha determinación de acuerdo con la etapa (d) se realiza mediante análisis cuantitativo de proteína a través de espectrometría de masas.
12. Procedimiento de las reivindicaciones 10 u 11, en el cual la determinación de la etapa (d) se realiza combinando dichos componentes diana unidos en una muestra y detectando las cantidades de los componentes diana diferencialmente marcados en dicha muestra.
13. Procedimiento de la reivindicación 12, en el cual los componentes diana se eluyen del soporte sólido antes de combinarse en dicha muestra.
14. Procedimiento de cualquiera de las reivindicaciones precedentes, en el cual la comparación de la etapa (e) se usa para determinar la afinidad de unión del componente diana al compuesto.
15. Procedimiento de la reivindicación 14, en el cual la comparación de la etapa (e) se usa para determinar el valor CI50 de dicho compuesto competidor.
16. Procedimiento de las reivindicaciones 14 ó 15, en el que la comparación de la etapa (e) se usa para determinar el valor Kd de la unión de dicho compuesto inmovilizado y/o dicho compuesto competidor a dicho componente diana.
17. Procedimiento de la reivindicación 16, en el que dicho compuesto inmovilizado es un inhibidor de quinasa no selectivo o una combinación de inhibidores de quinasa no selectivos.
18. Procedimiento de cualquiera de las reivindicaciones precedentes, en el cual el compuesto está presente durante dichas etapas de contacto en un exceso molar en comparación con el componente diana.
19. Procedimiento de cualquiera de las reivindicaciones precedentes, en el cual dichas etapas de contacto se realizan simultáneamente.
20. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual el analito se selecciona del grupo que consiste en un proteoma, una mezcla de diferentes proteomas, un extracto o lisado celular, un extracto o lisado tisular, un sobrenadante de cultivo celular, un sobrenadante de cultivo tisular o un fluido corporal.
21. Procedimiento de acuerdo con la reivindicación 20, en el cual el proteoma está presente en o se deriva de una célula única o un cultivo celular, una mezcla de células, un tejido, un órgano o un organismo.
22. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual dicho compuesto unido al soporte sólido y/o dicho compuesto competidor se selecciona de enzimas, polipéptidos, péptidos, anticuerpos y fragmentos de los mismos, oligo o polisacáridos, proteoglicanos, entidades químicas, moléculas pequeñas, fármacos, metabolitos o profármacos.
23. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual dicho compuesto inmovilizado está presente en una concentración definida en el soporte sólido.
24. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual el soporte sólido se selecciona del grupo que consiste en filtros, portaobjetos de vidrio, superficies de silicio, perlas y una microserie química adaptada.
25. Procedimiento de la reivindicación 24, en el cual dichas perlas son perlas de sefarosa, opcionalmente epoxi-activadas o NHS-activadas o perlas de agarosa.
26. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual el compuesto inmovilizado se inmoviliza en el soporte sólido mediante adsorción, absorción, enlace iónico, enlace covalente, un grupo amino o grupo carboxi o grupo hidroxi, interacciones (strept)avidina-biotina o tiol-oro.
27. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual dicho marcador se selecciona del grupo que consiste en radiomarcadores, marcadores de tinción, marcadores que pueden detectarse con anticuerpos, marcadores enzimáticos, marcadores fosforescentes, marcadores fluorescentes, marcadores quimioluminiscentes, fosfatasas, avidina, estreptavidina, biotina, TAP, peroxidasas y marcadores que tienen una masa detectable.
28. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual dicho contacto se realiza esencialmente en condiciones fisiológicas.
29. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual dicho contacto se realiza usando un tampón adecuado y, opcionalmente, un cofactor tal como NAD+/NADH, GMPc, NADP+/NADPH, ATP, ADP o AMPc.
30. Procedimiento de acuerdo con cualquiera de las reivindicaciones 9, 10 y 12-29, en el cual la determinación de acuerdo con la etapa (d) comprende detectar el marcador mediante un método seleccionado de métodos de detección de radioactividad, métodos de detección de fluorescencia, métodos de detección de luminiscencia, métodos de detección de tinción, métodos de detección enzimática y espectrometría de masas.
31. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, comprendiendo dicho procedimiento evaluar simultáneamente la unión de una multitud de componentes diana del analito al compuesto inmovilizado y/o al compuesto competidor.
32. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que dicho procedimiento se realiza en su totalidad o al menos en parte de una manera de alto rendimiento.
Patentes similares o relacionadas:
INDICADOR BIOLÓGICO, del 22 de Noviembre de 2011, de HEALTH PROTECTION AGENCY: Uso de una cinasa termoestable como indicador para validar un proceso de tratamiento para reducir la cantidad o actividad de un agente biológico contaminante en una muestra; […]
ENSAYO GENÉRICO DE DETECCIÓN DE ACTIVIDAD QUINASA/FOSFATASA CON UNA ÚNICA LECTURA, del 21 de Noviembre de 2011, de F. HOFFMANN-LA ROCHE AG: Un método para detectar una actividad quinasa o actividad fosfatasa que comprende los pasos: a) incubar una muestra con actividad quinasa […]
USO DE UN AGENTE MODULADOR QUE ACTÚA SOBRE UN PRECURSOR DE FACTOR DE CRECIMIENTO CON EL FIN DE INHIBIR EL TRATAMIENTO DEL PRECURSOR DE FACTOR DE CRECIMIENTO, del 16 de Noviembre de 2011, de MAX-PLANCK-GESELLSCHAFT ZUR FORDERUNG DER WISSENSCHAFTEN E.V.: Uso de un agente modulador que actúa sobre un precursor de factor de crecimiento, que inhibe el tratamiento del precursor de factor de crecimiento, inhibiendo de esta […]
ANTICUERPO ANTI HER3 PARA EL DIAGNÓSTICO, PREVENCIÓN Y TRATAMIENTO DE ENFERMEDADES HIPERPROLIFERATIVAS, del 25 de Agosto de 2011, de MAX-PLANCK-GESELLSCHAFT ZUR FORDERUNG DER WISSENSCHAFTEN E.V.: Uso de un inhibidor de HER3 para la fabricación de un medicamento para el diagnóstico, prevención o tratamiento de una enfermedad hiperproliferativa […]
 ANTICUERPOS DE PAK FOSFOESPECÍFICOS Y KITS DE DIAGNÓSTICO, del 3 de Mayo de 2011, de SUGEN, INC.: Un procedimiento para seleccionar un mamífero susceptible al tratamiento con un modulador de la actividad de PAK4, que comprende: (i) determinar la relación […]
ANTICUERPOS DE PAK FOSFOESPECÍFICOS Y KITS DE DIAGNÓSTICO, del 3 de Mayo de 2011, de SUGEN, INC.: Un procedimiento para seleccionar un mamífero susceptible al tratamiento con un modulador de la actividad de PAK4, que comprende: (i) determinar la relación […]
 METODOS PARA EL TRATAMIENTO DE TRASTORNOS PROLIFERATIVOS CELULARES, del 2 de Noviembre de 2010, de ONCOLYTICS BIOTECH, INC.: Un método para determinar la susceptibilidad de una célula a infección con reovirus midiendo la señalización constitutiva de ras-MAP en dicha […]
METODOS PARA EL TRATAMIENTO DE TRASTORNOS PROLIFERATIVOS CELULARES, del 2 de Noviembre de 2010, de ONCOLYTICS BIOTECH, INC.: Un método para determinar la susceptibilidad de una célula a infección con reovirus midiendo la señalización constitutiva de ras-MAP en dicha […]
PROCEDIMIENTO DE IDENTIFICACION DE COMPUESTOS ANTITUMORALES INHIBIDORES DE LA DIMERIZACION DE LAS PROTEINAS ERK, del 18 de Octubre de 2010, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Procedimiento de identificación de compuestos antitumorales inhibidores de la dimerización de las proteínas ERK. La presente invención describe un procedimiento para identificar […]
COMPLEJO SOLUBLE QUE CONTIENE UNA GLICOPROTEÍNA DE SUPERFICIE RETROVIRAL Y FKPA O SLYD, del 13 de Enero de 2012, de F. HOFFMANN-LA ROCHE AG: Método de producción de un complejo soluble que contiene una proteína diana amiloidogénica y una chaperona de la clase peptidil-prolil-isomerasa seleccionada del grupo […]