Anticuerpos anti-CD30 recombinantes y usos de los mismos.
Un anticuerpo que (i) se enlaza immunoespecíficamente con CD30 y (ii) por sí mismo ejerce un efecto citostático o citotóxico en una línea celular de la enfermedad de Hodgkin,
donde dicho anticuerpo ejerce el efecto citostático o citotóxico en la línea celular de la enfermedad de Hodgkin en ausencia de una conjugación a un agente citostático o citotóxico, respectivamente, para el uso en el tratamiento de la enfermedad de Hodgkin.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/044811.
Solicitante: SEATTLE GENETICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 21823 30TH DRIVE, S.E. BOTHELL, WA 98021 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SIEGALL, CLAY B., FRANCISCO,JOSEPH,A, RISDON,GRANT, WAHL,ALAN,F.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K47/48
- A61K6/00 A61K […] › Preparaciones para técnica dental.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N1/15 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/09 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
PDF original: ES-2339333_T3.pdf
Fragmento de la descripción:
Anticuerpos anti-CD30 recombinantes y usos de los mismos.
1. Campo de la invención
La presente invención se refiere a anticuerpos y a composiciones para el tratamiento de la enfermedad de Hodgkin, comprendiendo la administración de un anticuerpo que enlaza con CD30. Tales anticuerpos incluyen formas recombinantes/variantes de los anticuerpos monoclonales AC10 y HeFi-1, y derivados de los mismos. Esta invención se refiere a una clase nueva de anticuerpos monoclonales dirigidos contra el receptor CD30 los cuales, en forma no modificada, son capaces de inhibir el crecimiento de las células de la enfermedad de Hodgkin que expresan CD30.
2. Antecedentes de la invención
Los regímenes de quimioterapia curativa para la enfermedad de Hodgkin representan uno de los avances más importantes en la oncología clínica. Los regímenes de quimioterapia multiagente han aumentado el índice de curación en más de un 80% para estos pacientes. Sin embargo, el 3% de los pacientes mueren por causas relacionadas con el tratamiento, y para los pacientes que no responden a la terapia estándar o recaen después del tratamiento de primera línea, la única modalidad de tratamiento disponible es de dosis altas de quimioterapia en combinación con transplantes de células madre. Este tratamiento se asocia a un 80% de incidencia de mortalidad, morbilidad significante y un nivel de supervivencia de cinco años inferior al 50% (véase p. ej., Engert, et al., 1999, Seminars in Hematology 36:282-289).
La causa primaria de recaída tumoral es el desarrollo de clones de células tumorales resistentes a los agentes quimioterapéuticos. La inmunoterapia representa una estrategia alternativa que puede evitar potencialmente la resistencia. Los anticuerpos monoclonales para la focalización de células tumorales malignas han sido el foco de varios enfoques inmunoterapéuticos. Para diferentes malignidades, los programas terapéuticos basados en anticuerpos son ahora una parte reconocida de la terapia estándar. El anticuerpo anti-CD20 creado genéticamente Rituxan®, por ejemplo, se aprobó a finales de 1997 para el tratamiento del NHL recurrente de bajo grado.
CD30 es una glicoproteína de membrana de 120 kilodaltons (Froese et al., 1987, J. Immunol. 139: 2081-87) y un elemento de la superfamilia de receptores de TNF. Esta familia incluye TNF-RI, TNF-RII, CD30, CD40, OX-40 y RANK, entre otros.
CD30 es un marcador probado de células malignas en la enfermedad de Hodgkin (HD) y el linfoma de célula grande anaplástico (ALCL), un subconjunto de linfomas diferentes de Hodgkin (NHL) (Dürkop et al., 1992, Cell 88:421-427). Originalmente identificado en células cultivadas de Reed Steinberg de Hodgkin (H-RS) usando el anticuerpo monoclonal Ki-1 (Schwab et al., 1982, Nature 299:65-67), CD30 se expresa con gran frecuencia en la superficie de la célula de todos los linfomas de HD y de la mayoría de ALCL, aún tiene una expresión muy limitada en tejidos normales para pequeños números de células linfoides en las áreas perifoliculares (Josimovic-Alasevic et al., 1989, Eur. J. Immunol. 19:157-162). Anticuerpos monoclonales específicos para el antígeno CD30 se han explorado como vehículos para la administración de fármacos citostáticos, toxinas de planta y radioisótopos en ambos modelos preclínicos y estudios clínicos (Engert et al., 1990, Cancer Research 50:84-88; Barth et al., 2000, Blood 95:3909-3914). En pacientes con HD, la focalización del antígeno CD30 podría conseguirse con dosis bajas del mAb anti-CD30, BerH2 (Falini et al., 1992, British Journal of Haematology 82:38-45). Aún más, a pesar de la exitosa focalización in vivo de las células tumorales malignas, ninguno de los pacientes experimentó regresión tumoral. En una prueba clínica posterior, una toxina (saporin) se conjugó químicamente con el anticuerpo BerH2 y los cuatro pacientes demostraron reducciones rápidas y sustanciales de masa tumoral (Falini et al., 1992, Lancet 339: 1195-1196).
Estas observaciones recalcan la validez del receptor CD30 como un antígeno objetivo. No obstante, todos los pacientes tratados con el conjugado de toxina mAb desarrollaron anticuerpos para la toxina. Una de las limitaciones más importante de las inmunotoxinas es su inmunogenicidad inherente que resulta en el desarrollo de anticuerpos para la molécula de la toxina y neutraliza sus efectos (Tsutsumi et al., 2000, Proc. Nat'l Acad. Sci. U.S.A. 97:8545-8553). Adicionalmente, la toxicidad del hígado y el síndrome de fuga vascular asociado a las inmunotoxinas limita de forma potencial la capacidad para administrar dosis curativas de estos agentes (Tsutsumi et al., 2000, Proc. Nat'l Acad. Sci. U.S.A. 97:8545-8553).
2.1 Anticuerpos monoclonales CD30
El CD30 se identificó originalmente por el anticuerpo monoclonal Ki-1 y se refirió inicialmente como el antígeno Ki-1 (Schwab et al., 1982, Nature 299:65-67). Este mAb se desarrolló contra las células de Hodgkin y de Reed Stemberg (H-RS), las células malignas de la enfermedad de Hodgkin (HD). Un segundo mAb, capaz de unir un epítopo resistente a la formalina, diferente del reconocido por Ki-1 se describió posteriormente (Schwarting et al., 1989 Blood 74:1678-1689). La identificación de cuatro anticuerpos adicionales resultó en la creación del grupo de CD30 en el Tercer Seminario sobre la Clasificación de Leucocitos (Third Leucocyte Typing Workshop) en 1986 (McMichael, A.., ed., 1987, Leukocyte Typing III (Oxford: Oxford University Press).
2.2 Terapias basadas en el anticuerpo monoclonal CD30
La utilidad de los mAbs CD30 en el diagnóstico y la estadificación de la HD llevados a su evaluación como herramientas potenciales para la inmunoterapia. En pacientes con HD, la focalización específica del antígeno CD30 se consiguió con dosis bajas (30-50 mg) del mAb anti-CD30 BerH2 (Falini et al., 1992, British Journal of Haematology 82:38-45). A pesar de la exitosa focalización in vivo de las células tumorales malignas H-RS, ninguno de los pacientes experimentó regresiones tumorales.
En base a estos resultados, se concluyó que la eficacia con la inmunoterapia prevista de mAb CD30 no podría conseguirse con anticuerpos inmodificados (Falini et al., 1992, Lancet 339:1195-1196). En una prueba clínica posterior, el tratamiento de cuatro pacientes con HD refractaria con una toxina, saporin, conjugada químicamente al mAb BerH2 demostró reducciones rápidas y sustanciales, aunque transitorias, de masa tumoral (Falini et al., 1992, Lancet 339:1195-1196). En los últimos años, los investigadores han trabajado para refinar los enfoques para tratar las células neoplásicas que expresan el CD30. Ejemplos incluyen el desarrollo de inmunotoxinas de cadena única recombinantes (Bart et al., 2000, Blood 95:3909-3914), mAbs bi-específicos anti CD16/CD30 (Renner et al., 2000, Cancer Immunol. Immunother. 49:173-180), y la identificación de nuevos mAbs anti-CD30 que previenen la liberación de moléculas CD30 de la superficie de la célula (Horn-Lohrens et al., 1995, Int. J. Cancer 60:539-544).
Este enfoque ha descartado el potencial de las mAbs anti-CD30 con actividad de señalización en el tratamiento de la enfermedad de Hodgkin.
2.3. Identificación de anticuerpos monoclonales anti-CD30 con actividad agonista
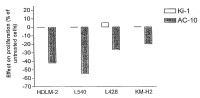
En la clonación y caracterización de la actividad biológica del ligando CD30 humano (CD30L), se describieron dos mAbs, M44 y M67, los cuales imitaban la actividad de la reticulación receptora inducida de CD30L (Gruss et al., 1994, Blood 83: 2045-2056). En ensayos in vitro, estos mAbs, en su forma inmovilizada, fueron capaces de estimular la proliferación de células T activadas y las líneas celulares de la enfermedad de Hodgkin de origen de células T, L540 y HDLM-2. Por otra parte, estos mAbs tuvieron poco efecto en las líneas celulares de Hodgkin con origen de célula B, L428 y KM-H2 (Gruss et al., 1994, Blood 83:2045-2056). En todos estos ensayos, la unión del receptor de CD30 por el mAb anti-CD30 Ki-1 tuvo poco efecto.
La actividad proliferativa de estos mAbs anti-CD30 agonistas en las líneas celulares de Hodgkin sugirió que las mAbs anti-CD30 que poseen actividad de señalización no tendrían ninguna utilidad en el tratamiento de HD.
Por otra parte, se ha mostrado recientemente que los mAbs anti-CD30 pueden inhibir el crecimiento de las células ALCL, incluyendo Karpas-299, induciendo a la detención del ciclo... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo que (i) se enlaza immunoespecíficamente con CD30 y (ii) por sí mismo ejerce un efecto citostático o citotóxico en una línea celular de la enfermedad de Hodgkin, donde dicho anticuerpo ejerce el efecto citostático o citotóxico en la línea celular de la enfermedad de Hodgkin en ausencia de una conjugación a un agente citostático o citotóxico, respectivamente, para el uso en el tratamiento de la enfermedad de Hodgkin.
2. El anticuerpo según la reivindicación 1, siendo el anticuerpo humano, humanizado o quimérico.
3. El anticuerpo según la reivindicación 2, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal AC10.
4. El anticuerpo según la reivindicación 2, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal HeFi-1.
5. El anticuerpo según la reivindicación 3, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:4, la SEC ID nº:6, y la SEC ID nº:8, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº: 12, la SEC ID nº:14 y la SEC ID nº:16.
6. El anticuerpo según la reivindicación 3, donde el anticuerpo comprende una región variable de cadena pesada que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:2, y una región variable de cadena ligera que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:10.
7. El anticuerpo según la reivindicación 6, donde el anticuerpo comprende una región variable de cadena pesada y una región variable de cadena ligera comprendiendo las secuencias de aminoácidos de la SEC ID nº: 2 y la SEC ID nº: 10, respectivamente.
8. El anticuerpo según la reivindicación 4, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:20, la SEC ID nº:22, y la SEC ID nº:24, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:28, la SEC ID nº:30 y la SEC ID nº:32.
9. El anticuerpo de cualquiera de las reivindicaciones 5 a 8, donde el anticuerpo se conjuga a un agente citotóxico.
10. El anticuerpo de cualquiera de las reivindicaciones 1 a 8, donde el efecto citostático o citotóxico se exhibe al emplear un método comprendiendo:
11. Una composición farmacéutica para el tratamiento de la enfermedad de Hodgkin comprendiendo:
12. La composición según la reivindicación farmacéutica 11, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal AC10.
13. La composición farmacéutica según la reivindicación 11, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal HeFi-1.
14. La composición farmacéutica según la reivindicación 12, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:4, la SEC ID nº:6, y la SEC ID nº:8, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:12, la SEC ID nº: 14 y la SEC ID nº:16.
15. La composición farmacéutica según la reivindicación 12, donde el anticuerpo comprende una región variable de cadena pesada que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:2, y una región variable de cadena ligera que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:10.
16. La composición farmacéutica según la reivindicación 15, donde el anticuerpo comprende una región variable de cadena pesada y una región variable de cadena ligera comprendiendo las secuencias de aminoácidos de la SEC ID nº:2 y la SEC ID nº:10, respectivamente.
17. La composición farmacéutica según la reivindicación 13, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:20, la SEC ID nº:22, y la SEC ID nº:24, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:28, la SEC ID nº:30 y la SEC ID nº:32.
18. La composición farmacéutica de cualquiera de las reivindicaciones 14 a 17, en la cual el anticuerpo se conjuga a un agente citotóxico.
19. La composición farmacéutica de cualquiera de las reivindicaciones 11 a 17, donde el efecto citostático o citotóxico se exhibe al realizar un método comprendiendo:
20. Uso de un anticuerpo que (i) se enlaza immunoespecíficamente a CD30 y (ii) por sí mismo ejerce un efecto citostático o citotóxico en una línea celular de la enfermedad de Hodgkin, donde dicho anticuerpo ejerce el efecto citostático o citotóxico en la línea celular de la enfermedad de Hodgkin en ausencia de una conjugación a un agente citostático o citotóxico, respectivamente, en la producción de un medicamento para el tratamiento de la enfermedad de Hodgkin.
21. El uso según la reivindicación 20, siendo el anticuerpo humano, humanizado o quimérico.
22. El uso según la reivindicación 21, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal AC10.
23. El uso según la reivindicación 21, donde el anticuerpo compite para unirse con CD30 con el anticuerpo monoclonal HeFi-1.
24. El uso según la reivindicación 22, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:4, la SEC ID nº:6, y la SEC ID nº:8, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:12, la SEC ID nº:14 y la SEC ID nº:16.
25. El uso según la reivindicación 22, donde el anticuerpo comprende una región variable de cadena pesada que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:2, y una región variable de cadena ligera que tiene al menos un 95% de identidad con la secuencia de aminoácidos de la SEC ID nº:10.
26. El uso según la reivindicación 25, donde el anticuerpo comprende una región variable de cadena pesada y una región variable de cadena ligera comprendiendo las secuencias de aminoácidos de la SEC ID nº: 2 y la SEC ID nº: 10, respectivamente.
27. El uso según la reivindicación 23, donde el anticuerpo comprende una región variable de cadena pesada comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:20, la SEC ID nº:22, y la SEC ID nº:24, y comprende una región variable de cadena ligera comprendiendo regiones de determinación complementarias teniendo las secuencias de aminoácidos de la SEC ID nº:28, la SEC ID nº:30 y la SEC ID nº:32.
28. El uso de cualquiera de las reivindicaciones 24 a 27, donde el anticuerpo se conjuga a un agente citotóxico.
29. El uso de cualquiera de las reivindicaciones 20 a 27, donde el efecto citostático o citotóxico se expone al emplear un método comprendiendo:
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]