Anticuerpo Anti-Glipicano 3 que tiene una cinética mejorada en plasma.
Un anticuerpo que comprende una región variable de la cadena pesada mostrada en el SEQ ID NO:
27 y unaregión variable de la cadena ligera mostrada en el SEQ ID NO: 29.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2008/002690.
Solicitante: CHUGAI SEIYAKU KABUSHIKI KAISHA.
Nacionalidad solicitante: Japón.
Dirección: 5-1 UKIMA 5-CHOME KITA-KU TOKYO 115-8543 JAPON.
Inventor/es: TSUNODA,Hiroyuki , IGAWA,Tomoyuki , ISHIGURO,Takahiro , KURAMOCHI,TAICHI, SHIRAIWA,HIROTAKE, TACHIBANA,TATSUHIKO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
- C12N1/15 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/09 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
PDF original: ES-2394471_T3.pdf
Fragmento de la descripción:
Anticuerpo Anti-Glipicano 3 que tiene una cinética mejorada en plasma.
Antecedentes de la Invención
Campo de la Invención La presente invención hace referencia a un método para mejorar la cinética en plasma (sangre) de anticuerpos antiglipicano 3, a una composición farmacéutica que comprende un anticuerpo anti-glipicano 3 que tiene una cinética en plasma mejorada como ingrediente activo, y a un método para preparar el mismo.
Descripción de la Técnica Relacionada Los anticuerpos son estables en el plasma y muestran pocos efectos secundarios y por estas razones se ha prestado atención a su uso como fármacos. Entre los numerosos isotipos de anticuerpos, se encuentran en el mercado un gran número de anticuerpos terapéuticos de isotipo IgG y en la actualidad también se está desarrollando un gran número de anticuerpos terapéuticos (Janice M. Reichert, Clark J. Rosensweig, Laura B. Faden, y Matthew C. Dewitz, Monoclonal antibody successes in the clinic, Nature Biotechnology (2005) 23, 1073-8; Pavlou A. K. y Belsey M. J., The therapeutic antibodies market to 2008, Eur. J. Pharm. Biopharm. (2005) 59 (3) , 38996; y Janice M. Reichert y Viia E. Valge-Archer, Development trends for monoclonal antibody cancer therapeutics, Nat. Rev. Drug Disc. (2007) 6, 349-356) . Se sabe que los anticuerpos anti-glipicano 3 muestran actividad antitumoral ejerciendo citotoxicidad contra, por ejemplo, células de cáncer de hígado y células de cáncer de pulmón (documento WO 2003/000883) . También se sabe que los productos conjugados anticuerpo-fármaco que comprenden un anticuerpo anti-glipicano 3 unido a una sustancia citotóxica muestran actividad anti-tumoral contra el cáncer de hígado, el cáncer de ovario, el melanoma, etcétera (Albina Nesterova, Paul J. Carter, y Leia M. Smith, Glypican 3 as a Novel Target for an Antibody-Drug Conjugate, AACR Abstract Núm. 656 (2007) , Los Angeles, CA, Abril, 4-18) .
Ademas, se están desarrollando tecnologías para intensificar las funciones efectoras para producir anticuerpos terapéuticos de segunda generación. Por ejemplo, se sabe que la actividad citotóxica dependiente de anticuerpos (ADCC) y la actividad citotóxica dependiente del complemento (CDC) son intensificadas por medio de una sustitución de aminoácido en la cual los aminoácidos que constituyen la región Fc de los anticuerpos de isotipo IgG (referidos como anticuerpos IgG) son remplazados por diferentes aminoácidos (Kim S. J., Park Y., y Hong H. J., Antibody engineering for the development of therapeutic antibodies, Mol. Cells (2005) 20 (1) , 17-29) . Cuando un anticuerpo anti-glipicano 3 es producido en células CHO con el transportador de fucosa suprimido, la fucosa no se une a las cadenas de azúcar ramificadas unidas al anticuerpo anti-glipicano 3. Dicho anticuerpo anti-glipicano 3 tiene una actividad ADCC significativamente más alta que el anticuerpo anti-glipicano 3 que contiene fucosa en la cadena ramificada de la cadena de azúcar, y se piensa que muestra una mayor actividad anti-tumoral como anticuerpo terapéutico (documento WO 2006/067913) .
Además de tales tecnologías para potenciar las funciones efectoras, también se conocen otras tecnologías en las cuales la vida media en plasma de un anticuerpo se incrementa o disminuye por una sustitución de aminoácido en los aminoácidos que constituyen la región Fc del anticuerpo (Hinton P. R., Xiong J. M., Johlfs M. G., Tang M. T., Keller S., y Tsurushita N., An engineered human IgG1 antibody with longer serum half-life, J. Immunol. (2006) 176 (1) , 346-56; y Ghetie V., Popov S., Borvak J., Radu C., Matesoi D., Medesan C., Ober R. J., y Ward E. S., Increasing the serum persistence of an IgG fragment by random mutagenesis, Nat. Biotechnol. (1997) 15 (7) , 63790) . Si se aplica una tecnología que prolonga la vida media en plasma de los anticuerpos a anticuerpos terapéuticos, se espera que la dosis del anticuerpo administrado terapéuticamente se reduzca y se amplíe su intervalo de administración, lo que permitirá la provisión de anticuerpos terapéuticos menos costosos con un elevado factor de conveniencia.
En términos específicos, la vida media en plasma se puede prolongar sustituyendo un aminoácido de la región Fc de un anticuerpo IgG por otro aminoácido dando como resultado una mejora en la afinidad del anticuerpo IgG por el receptor de Fc neonatal, que se sabe que es un receptor de recuperación para el anticuerpo IgG. Además, también se sabe que la vida media en plasma se incrementa mediante barajado de los dominios individuales (CH1, CH2, CH3) que constituyen la región constante del anticuerpo (Zuckier L. S., Chang C. J., Scharff M. D., y Morrison S. L., Chimeric human-mouse IgG antibodies with shuffled constant region exons demonstrate that multiple domains contribute to in vivo half-life, Cancer Res. (1998) 58 (17) , 3905-8) . No obstante, puesto que la secuencia de aminoácidos de la región constante del anticuerpo IgG está conservada en los seres humanos, un anticuerpo que tiene una sustitución de aminoácido artificial como se describe más arriba en los aminoácidos que constituyen la región constante puede causar efectos secundarios mostrando inmunogenicidad en el organismo humano. Por lo tanto se prefiere sustituir solamente un pequeño número de aminoácidos.
Las tecnologías que implican sustitución de aminoácidos en la región variable (también referida como región V) de los anticuerpos IgG referidas hasta la fecha incluyen la tecnología de humanización (Tsurushita N., Hinton P. R., y Kumar S., Design of humanized antibodies: from anti-Tac to Zenapax, Methods (2005) 36 (1) , 69-83) , la maduración de la afinidad conde los aminoácidos de la región determinante de la complementariedad (CDR) se sustituyen con el fin de incrementar la actividad de unión (Rajpal A., Beyaz N., Haber L., Cappuccilli G., Yee H., Bhatt R. R., Takeuchi T., Lerner R. A., y Crea R., A general method for greatly improving the affinity of antibodies by using combinatorial libraries, Proc. Natl. Acad. Sci. USA (2005) 102 (24) , 8466-71) y la sustitución de aminoácidos en los aminoácidos que constituyen la región marco (FR) para mejorar la estabilidad fisicoquímica (Ewert S., Honegger A., y Pluckthun A., Stability improvement of antibodies for extracellular and intracellular applications: CDR grafting to stable frameworks and structure-based framework engineering, Methods (2004) 34 (2) , 184-99) . A diferencia del caso con una sustitución de aminoácidos en la región constante (también referida como región C) , la sustitución de aminoácidos en la región variable se utiliza generalmente para mejorar las características (p. ej., estabilidad) y potenciar la función (p. ej., actividad de unión al antígeno) de los anticuerpos. Puesto que la secuencia de aminoácidos que constituye la CDR de los anticuerpos humanizados se obtiene de la secuencia de aminoácidos de una especie animal no humana, se piensa que el riesgo de generar inmunogenicidad introduciendo una sustitución de aminoácidos artificial en esta secuencia es menor que en las sustituciones de aminoácidos en una secuencia en otras regiones. Por otra parte, con respecto a una sustitución de aminoácidos artificial en la secuencia de que constituye la FR de los anticuerpos humanizados, se piensa que dicha sustitución posee poco riesgo de generar inmunogenicidad si la secuencia de aminoácidos de FR obtenida como consecuencia de la sustitución es la misma que cualquiera de la pluralidad de secuencias de aminoácidos de FR de anticuerpos humanos que están publicadas, por ejemplo, en la base de datos de Kabat (http://ftp.ebi.ac.uk/pub/databases/kabat/) , la base de datos IMGT (http://imgt.cines.fr/) , etcétera. Además, la inmunogenicidad se puede reducir volviendo a seleccionar una secuencia de anticuerpo humano que sea muy similar a la secuencia de aminoácidos de FR obtenida como consecuencia de la sustitución, entre la pluralidad de secuencias amino de FR de un anticuerpo humano que están publicadas en la base de datos de Kabat, la base de datos IMGT, etcétera (documento WO 1999/018212) .
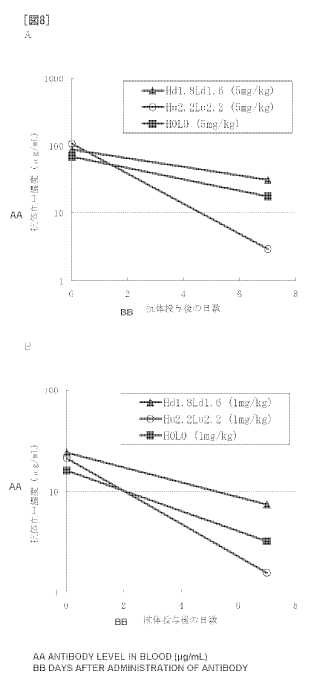
En contraste, los únicos métodos conocidos para mejorar la vida media en plasma de los anticuerpos IgG son, como se ha descrito más arriba, la sustitución de aminoácidos de los aminoácidos que constituyen la región Fc, que es una parte de la región constante, y no se ha informado hasta la fecha sobre métodos que ocasionen una mejora en la vida media en plasma de los anticuerpos IgG por medio de la sustitución de aminoácidos de los aminoácidos que constituyen la región variable, que se cree que conlleva poco riesgo de invocar inmunogenicidad. La razón de esto es, en parte, que se cree que la vida media en plasma de los anticuerpos IgG depende en gran manera del agotamiento dependiente de antígenos... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo que comprende una región variable de la cadena pesada mostrada en el SEQ ID NO: 27 y una región variable de la cadena ligera mostrada en el SEQ ID NO: 29.
2. El anticuerpo de acuerdo con la reivindicación 1 que comprende una región constante de un anticuerpo humano.
3. El anticuerpo de acuerdo con la reivindicación 2, donde la región constante comprende una secuencia mostrada en el SEQ ID NO: 32 o el SEQ ID NO: 33.
4. El anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde el anticuerpo tiene un contenido reducido de fucosa anclada a la región Fc del anticuerpo.
5. Una composición que comprende el anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 4 y un portador farmacéuticamente aceptable.
6. Un agente anticanceroso que comprende como ingrediente activo el anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 4.
7. El agente anticanceroso de acuerdo con la reivindicación 6, donde el cáncer es cáncer de hígado.
8. Un ácido nucleico que codifica un polipéptido para el anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 4.
9. Una célula anfitriona que comprende el ácido nucleico de acuerdo con la reivindicación 8.
10. La célula anfitriona de acuerdo con la reivindicación 9, donde la célula anfitriona es una célula animal carente de transportador de fucosa, una célula animal con la fucosil-transferasa suprimida, o una célula animal en la cual está modificada una modificación de la cadena de azúcar ramificada compleja.
11. Un método para preparar un anticuerpo que comprende cultivar la célula anfitriona de acuerdo con la reivindicación 9 ó 10 y recuperar un polipéptido del cultivo celular.
12. Un anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 3 para su uso en un método para el tratamiento del cáncer.
13. Un anticuerpo de acuerdo con la reivindicación 12, donde el cáncer es cáncer de hígado.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.