MÉTODO PARA PURIFICAR ADN PLÁSMIDO.
Un método para preparar una composición de ADN plasmídico de grado farmacéutico que comprende proporcionar un extracto celular que contiene ADN plasmídico,
en el que las células se han lisado mediante lisis alcalina y las membranas celulares y el ADN genómico han sido eliminados mediante una extracción o filtración inicial; y después realizar al menos tres etapas cromatográficas que comprenden, en el siguiente orden: cromatografía de intercambio iónico, cromatografía de afinidad de triple hélice y cromatografía de interacción hidrofóbica, en donde la composición preparada tenía menos de aproximadamente 0,0001 % contaminación por ADN de la célula anfitriona
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/005213.
Solicitante: AVENTIS PHARMA S.A..
Nacionalidad solicitante: Francia.
Dirección: 20, AVENUE RAYMOND ARON 92160 ANTONY FRANCIA.
Inventor/es: BLANCHE, FRANCIS, GAILLAC, DAVID, COUDER,Michel, MAESTRALI,Nicolas, GUILLEMIN,Thierry.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Abril de 2005.
Clasificación Internacional de Patentes:
- A61M25/00R2
Clasificación PCT:
- C12N1/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Lisis de microorganismos.
- C12N15/10 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Clasificación antigua:
- C12N1/06 C12N 1/00 […] › Lisis de microorganismos.
- C12N15/10 C12N 15/00 […] › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2359069_T3.pdf




Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
Esta invención se refiere a métodos para purificar ácidos nucleicos. La invención se refiere en particular a métodos para preparar ADN plasmídico (ADNp) altamente purificado, en particular a la producción y aislamiento de ADN plasmídico de grado farmacéutico. 5
ANTECEDENTES DE LA INVENCIÓN
Los avances en la biología molecular sugieren claramente que la terapia basada en plásmidos, en particular en los campos de vacunas y terapia génica humana, pueden ser la base de medios eficaces para tratar enfermedades. Sin embargo, un obstáculo significativo de esta tecnología es la preparación de ADN plasmídico en la suficiente cantidad y con la suficiente calidad como para utilizarse en clínica. Un método prometedor para administrar de manera segura y 10 eficaz un gen normal a células humanas es mediante ADN plasmídico. El ADN plasmídico es una forma cerrada, circular de ADN bacteriano en el que puede insertarse una secuencia de ADN de interés. Los ejemplos de secuencias de ADN de interés que pueden introducirse en células de mamífero incluyen un gen exógeno funcional o un gen mutante, secuencias antisentido, secuencias de ARNi o ARNids, ribozimas, por ejemplo, en el tratamiento de infecciones virales, cáncer o enfermedades relacionadas con la angiogénesis. Una vez administrado a la célula humana, el ADNp empieza 15 a replicarse y a producir copias de la secuencia de ADN insertada. Así, los científicos consideran el ADN plasmídico como un vehículo prometedor para administrar secuencias de ADN de interés a células humanas con el fin de tratar una variedad de estados patológicos.
Se necesitan grandes cantidades de ADN plasmídico para el desarrollo de las investigaciones para aplicar la tecnología basada en plásmidos en un contexto terapéutico. Debido a que el ADN plasmídico utilizado en terapia génica y en otras 20 aplicaciones clínicas es habitualmente producido por bacterias tales como Escherichia coli (E. coli), se necesitan métodos para separar de manera eficaz el ADN plasmídico del ADN genómico (ADNg) de la célula bacteriana, así como de endotoxinas y proteínas de la célula bacteriana. Por lo tanto, existe una necesidad creciente de procedimientos de purificación sencillos, robustos y escalables que puedan utilizarse para aislar grandes cantidades de ADN plasmídico a partir de células bacterianas. 25
Una etapa importante en cualquier procedimiento de purificación de plásmidos implica la lisis de las células bacterianas con el fin de liberar el contenido celular a partir del cual puede entonces aislarse el ADNp. De hecho, en primer lugar es necesario conseguir tres etapas de suspensión celular, lisis celular y neutralización y precipitación de los contaminantes del anfitrión. La resuspensión celular utiliza normalmente agitación manual o agitación magnética y un homogeneizador o mezclador impelente para resuspender las células en el tampón de resuspensión. La lisis celular puede realizarse 30 mediante agitación manual o agitación magnética con el fin de mezclar las células resuspendidas con la disolución de lisis (que consiste en álcali diluido (base) y detergentes); después mantener la mezcla a temperatura ambiente (20-25 grados Celsius) o en hielo durante un periodo de tiempo, tal como 5 minutos, para completar la lisis. Como se ha indicado anteriormente, ni la agitación manual ni la agitación magnética son escalables. La tercera etapa es la neutralización y precipitación de los contaminantes del anfitrión. El lisado de la segunda etapa se mezcla normalmente 35 con una disolución de neutralización fría mediante agitación suave o agitación magnética para acidificar el lisado antes de ponerlo en hielo durante 10-30 minutos para facilitar la desnaturalización y precipitación del ADN cromosómico de alto peso molecular, proteínas del anfitrión y otras moléculas del anfitrión. Ni la agitación manual ni la agitación magnética son escalables.
Generalmente, la pared celular se digiere mediante tratamiento con lisozima durante poco tiempo o mediante 40 tratamiento con acetato alcalino o de potasio (KOAc). Generalmente, también se añade ARNasa para degradar los ARN de la suspensión bacteriana. Estas etapas químicas pueden resultar eficaces para lisar las células a pequeña escala. Sin embargo, el incremento de la viscosidad hace muy difícil el procesamiento a gran escala.
Un método alternativo sencillo y rápido para preparar plásmidos comprende tratar las bacterias con lisozima, hervirlas a aproximadamente 100°C en un tampón apropiado durante 20 a 40 segundos formando un grumo insoluble de ADN 45 genómico, proteína y restos celulares permaneciendo el plásmido en disolución con ARN como contaminante principal. Después, se añade una disolución mezclada de NaOH y dodecilsulfato sódico (SDS) con el fin de disolver la membrana citoplásmica. NaOH desnaturaliza parcialmente los ADN y degrada parcialmente los ARN y SDS actúa para disolver la membrana y desnaturalizar las proteínas. Sucesivamente, el complejo SDS-proteína y los restos celulares se precipitan mediante la adición de acetato de potasio 5N (pH 4,8). En este momento, el pH es importante tanto para neutralizar el 50 NaOH utilizado en dicha manipulación como para renaturalizar el plásmido. Posteriormente, se aplica una centrifugación para eliminar los precipitados, obteniéndose así los plásmidos deseados en el sobrenadante. Sin embargo, esta técnica no es apropiada para aumentar la escala hasta fermentaciones bacterianas de gran volumen y se pretende que sea para fermentaciones de menos de cinco litros. Esta serie de manipulaciones también requiere una mezcla lenta y firme, con el fin de evitar que el ADN cromosómico bacteriano se rompa en fragmentos pequeños y agregue, produciendo la 55 contaminación del plásmido y dificultando la realización del procesamiento a gran escala.
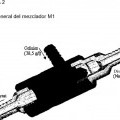
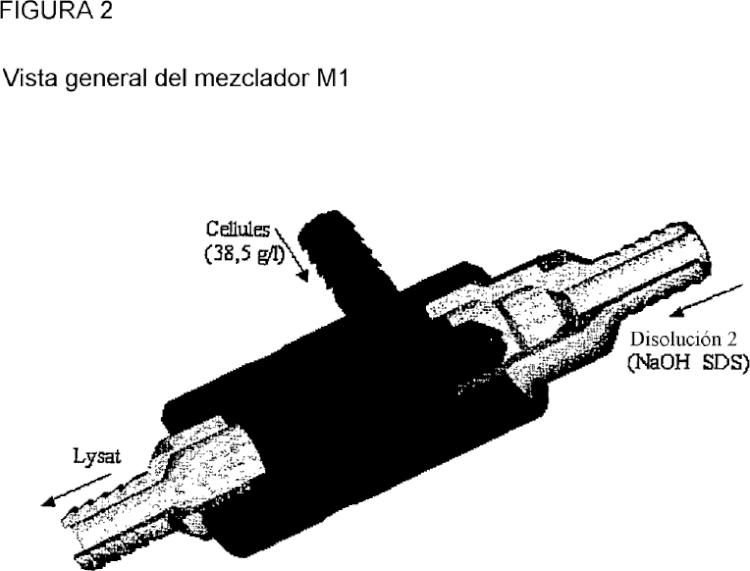
Un método alternativo habitual para lisar las células, conocido como lisis alcalina, consiste en mezclar una suspensión de células bacterianas (disolución 1) con una disolución de lisis alcalina (disolución 2). La disolución 2 consiste en un detergente, por ejemplo, dodecil sulfato sódico (SDS) para lisar las células bacterianas y liberar el material intracelular y un álcali, por ejemplo, hidróxido sódico para desnaturalizar las proteínas y ácidos nucleicos de las células (particularmente ADNg y ARN). Al lisarse las células y desnaturalizarse el ADN, la viscosidad de la disolución aumenta 5 en gran medida. Después de la desnaturalización, se añade una disolución ácida, por ejemplo, acetato de potasio (disolución 3), para neutralizar el hidróxido sódico induciendo la renaturalización de los ácidos nucleicos. Los fragmentos largos de ADNg se vuelven a asociar al azar y forman redes que precipitan como flóculos, atrapando proteínas, lípidos y otros ácidos nucleicos. La sal de potasio del dodecilsulfato también precipita eliminando las proteínas a las que está asociada. Las dos hebras de ADNp (ADN plasmídico), se entrelazan entre sí, se reasocian normalmente para volver a 10 formar el plásmido inicial que permanece en disolución.
La técnica de lisis se realiza en modo discontinuo, es decir, en el que se mezclan diferentes disoluciones mediante la adición secuencial de las disoluciones a recipientes o tanques. Debido a que el lisado alcalino es un fluido viscoelástico que es muy difícil de manipular, una dificultad con este método se produce durante el mezclado de las diferentes disoluciones. Debido a que el esfuerzo de cizalla produce la fragmentación del ADNg, lo que hace que sea muy difícil de 15 separar del ADNp, se necesitan métodos para evitar la aplicación de esfuerzos de cizalla al fluido. Además, el ADNp largo (es decir, mayor de aproximadamente 10 pares de kilo bases) también es susceptible al daño por cizalla durante el proceso de mezclado. Después de que la disolución que contiene la suspensión celular se ha mezclado con la disolución de lisis, se mezcla el lisado alcalino viscoelástico con la disolución de neutralización. De nuevo, este proceso de mezclado resulta problemático debido a las propiedades viscoelásticas de la disolución. 20
Además, otra dificultad para aumentar la escala del proceso de lisis discontinuo implica la eficacia del mezclado de los diferentes fluidos cuando se intentan limitar los esfuerzos de cizalla para evitar la fragmentación del ADNg. Como se ha indicado previamente, el comportamiento cromatográfico del ADN genómico fragmentado es muy similar al del ADNp, de manera que se vuelve prácticamente imposible deshacerse del ADNg mediante los procedimientos de purificación... [Seguir leyendo]
Reivindicaciones:
1. Un método para preparar una composición de ADN plasmídico de grado farmacéutico que comprende proporcionar un extracto celular que contiene ADN plasmídico, en el que las células se han lisado mediante lisis alcalina y las membranas celulares y el ADN genómico han sido eliminados mediante una extracción o filtración inicial; y después realizar al menos tres etapas cromatográficas que comprenden, en el siguiente orden: cromatografía de intercambio 5 iónico, cromatografía de afinidad de triple hélice y cromatografía de interacción hidrofóbica, en donde la composición preparada tenía menos de aproximadamente 0,0001 % contaminación por ADN de la célula anfitriona.
2. El método de la reivindicación 1, en el que la primera etapa cromatográfica realizada está precedida de una filtración del lisado.
3. El método de la reivindicación 1, en el que la primera etapa cromatográfica realizada está precedida de la eliminación 10 del flóculo.
4. El método de la reivindicación 1, en el que la composición tiene menos de aproximadamente 0,0001% de ARN contaminante de la célula anfitriona.
5. El método de la reivindicación 1, en el que la composición tiene menos de aproximadamente 0,0001% de proteínas contaminantes de la célula anfitriona. 15
6. El método de la reivindicación 4, en el que la composición tiene menos de aproximadamente 0,0001% de proteínas contaminantes de la célula anfitriona.
7. El método de la reivindicación 1, en el que la composición tiene menos de aproximadamente 0,1EU/mg de endotoxinas.
8. El método de la reivindicación 6, en el que la composición tiene menos de aproximadamente 0,1EU/mg de 20 endotoxinas.
9. El método de cualquiera de las reivindicaciones 1, en el que la composición tiene menos de o aproximadamente 0,1 EU/mg de endotoxinas, menos de o aproximadamente 0,00008% de proteínas contaminantes de la célula anfitriona, menos de o aproximadamente 0,00008% de ARN contaminante de la célula anfitriona y menos de o aproximadamente 0,00008% de ADN genómico contaminante de la célula anfitriona. 25
10. El método de la reivindicación 1, en el que la composición tiene menos de o aproximadamente 0,00005% de ADN genómico contaminante de la célula anfitriona.
11. El método de la reivindicación 1, en el que la composición tiene menos de o aproximadamente 0,00008% de ADN genómico contaminante de la célula anfitriona.
12. El método de cualquiera de las reivindicaciones 1, en el que la composición tiene menos de o aproximadamente 0,1 30 EU/mg de endotoxinas y menos de o aproximadamente 0,00005% de proteínas contaminantes de la célula anfitriona.
13. El método de la reivindicación 12, en el que la composición tiene menos de o aproximadamente 0,00002% de ARN contaminante de la célula anfitriona y menos de o aproximadamente 0,00008% de ADN genómico contaminante de la célula anfitriona.
14. El método de la reivindicación 1, en el que la composición tiene menos de o aproximadamente 0,1 EU/mg de 35 endotoxinas y menos de o aproximadamente 0,00002% de ARN contaminante de la célula anfitriona.
15. El método de cualquiera de las reivindicaciones 1, en el que la composición tiene menos de o aproximadamente 0,1 EU/mg de endotoxinas y menos de o aproximadamente 0,00005% de proteínas contaminantes de la célula anfitriona.
16. El método de cualquiera de las reivindicaciones 1 ó , en el que la composición no tiene más de 0,00002% de ARN contaminante de la célula anfitriona y no más de 0,00005% de proteínas contaminantes de la célula anfitriona. 40
17. El método de una de las reivindicaciones 1-16, que es susceptible de aumentar de escala para la fabricación a gran escala.
18. El método según una cualquiera de las reivindicaciones 1 a 17, que comprende además una etapa de esterilización por filtración, formulación y llenado de viales con el ADN plasmídico purificado.
19. El método según una cualquiera de las reivindicaciones 1 a 17, en el una o más de las etapas cromatográficas se 45 realiza en un soporte sólido que comprende cualquier material orgánico, inorgánico o compuesto, soporte poroso,
superporoso o no poroso, adecuado para separaciones cromatográficas, que está derivatizado con poli(alquenglicoles), alcanos, alquenos, alquinos, arenos u otras moléculas que confieren un carácter hidrofóbico al soporte.
20. El método según una cualquiera de las reivindicaciones 1 a 17, en el que una o más de las etapas cromatográficas se realiza como cromatografía de desplazamiento, cromatografía de lecho móvil simulado, cromatografía en lecho continuo, cromatografía líquida de proteínas rápida o cromatografía líquida de alta resolución. 5
21. El método según cualquiera de las reivindicaciones 1 a 17, en el que la cromatografía de interacción hidrofóbica se realiza en un lecho fijo o en un lecho expandido.
Patentes similares o relacionadas:
 SISTEMA DE CATÉTER, del 21 de Marzo de 2011, de PFRIMMER NUTRICIA GMBH: Sistema de catéter , que comprende: una sonda gástrica para la descompresión gástrica o drenaje de fluidos del estómago, que comprende un tubo de drenaje que […]
SISTEMA DE CATÉTER, del 21 de Marzo de 2011, de PFRIMMER NUTRICIA GMBH: Sistema de catéter , que comprende: una sonda gástrica para la descompresión gástrica o drenaje de fluidos del estómago, que comprende un tubo de drenaje que […]
 SISTEMA DE CATETER, del 5 de Julio de 2010, de PFRIMMER NUTRICIA GMBH: Catéter para proporcionar comunicación fluida con el intestino delgado de un paciente para el suministro nutricional durante la alimentación enteral, que comprende:
un tubo […]
SISTEMA DE CATETER, del 5 de Julio de 2010, de PFRIMMER NUTRICIA GMBH: Catéter para proporcionar comunicación fluida con el intestino delgado de un paciente para el suministro nutricional durante la alimentación enteral, que comprende:
un tubo […]
 INJERTO DE STENT, del 18 de Enero de 2010, de UROVISION GESELLSCHAFT FUR MEDIZINISCHEN TECHNOLOGIE TRANSFER MBH: Stent para la introducción e implantación en cavidades corporales humanas o animales con un extremo distal de introducción y un extremo proximal […]
INJERTO DE STENT, del 18 de Enero de 2010, de UROVISION GESELLSCHAFT FUR MEDIZINISCHEN TECHNOLOGIE TRANSFER MBH: Stent para la introducción e implantación en cavidades corporales humanas o animales con un extremo distal de introducción y un extremo proximal […]
 CATETER QUE TIENE UNA PRESTACION DE CURVATURA MEJORADA MEDIANTE TRATAMIENTO TERMICO, del 8 de Enero de 2010, de BOSTON SCIENTIFIC LIMITED: Un catéter intravascular, que comprende: un cuerpo cilíndrico alargado que incluye un lumen que tiene una abertura proximal en el extremo proximal del cuerpo cilíndrico […]
CATETER QUE TIENE UNA PRESTACION DE CURVATURA MEJORADA MEDIANTE TRATAMIENTO TERMICO, del 8 de Enero de 2010, de BOSTON SCIENTIFIC LIMITED: Un catéter intravascular, que comprende: un cuerpo cilíndrico alargado que incluye un lumen que tiene una abertura proximal en el extremo proximal del cuerpo cilíndrico […]
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]