INMUNOSUPRESIÓN MEDIANTE CHAPERONINA 10.
Una composición farmacéutica que comprende: una cantidad farmacéuticamente eficaz de chaperonina 10 con la secuencia de aminoácidos recogida en SEQ ID NO:
1, y un vehículo, excipiente o diluyente farmacéuticamente aceptable
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/AU2003/001467.
Solicitante: CBIO LIMITED.
Nacionalidad solicitante: Australia.
Dirección: BRISBANE TECHNOLOGY PARK, 85 BRANDL STREET EIGHT MILE PLAINS, QLD 4113 AUSTRALIA.
Inventor/es: MORTON, HALLE, CAVANAGH, ALICE CHRISTINA, HILL,Geoffrey R. , BANOVIC,Tatjana.
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Noviembre de 2003.
Clasificación Internacional de Patentes:
- A61K38/17A2
Clasificación PCT:
- A61K31/436 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo el sistema heterocíclico un ciclo de seis eslabones teniendo el oxígeno como heteroátomo del ciclo, p. ej. rapamicina.
- A61K31/519 A61K 31/00 […] › condensadas en orto o en peri con heterociclos.
- A61K38/13 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Ciclosporinas.
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
Clasificación antigua:
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- A61P37/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunosupresores, p. ej. medicamentos para el tratamiento del rechazo en injertos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
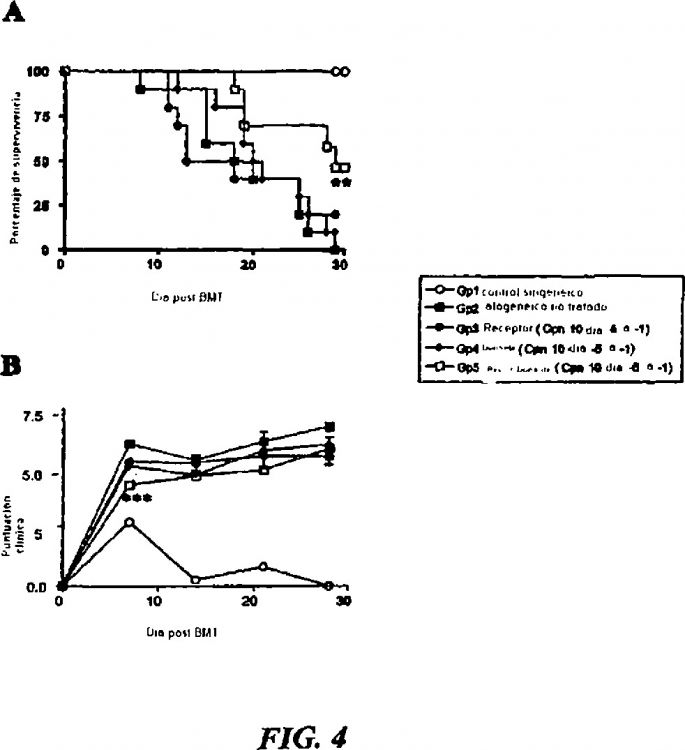
Fragmento de la descripción:
Inmunosupresión mediante chaperonina 10.
Campo de la invención
Esta invención se refiere a una composición farmacéutica que comprende: una cantidad farmacéuticamente eficaz de chaperonina 10 con la secuencia de aminoácidos recogida en SEQ ID NO:1, y un vehículo excipiente o diluyente farmacéuticamente aceptable.
Antecedentes de la invención
La enfermedad de injerto frente a hospedante (GVHD - siglas en inglés) es un estado que puede desarrollarse cuando se han introducido en un individuo células inmunológicamente competentes, por ejemplo durante el trasplante de médula ósea o de células madre. La GVHD se refiere al proceso inmunológico en el que las células recientemente trasplantadas despliegan una respuesta de rechazo contra el tejido hospedante. La GVHD puede desarrollarse después del trasplante o la transfusión de tejido de la médula ósea, células madre hematopoyéticas, productos de la sangre no irradiados y órganos sólidos que contienen tejido linfoide.
Existen dos tipos de GVHD, la aguda y la crónica. La GVHD aguda se desarrolla en el espacio de los tres primeros meses tras el trasplante, y los síntomas clínicos incluyen dermatitis, enteritis y hepatitis. La GVHD crónica se desarrolla, habitualmente, tres meses después del trasplante y es un síndrome autoinmune que afecta a múltiples órganos y tejidos, tales como la piel, tracto gastrointestinal y el hígado.
Células T donantes son las responsables de provocar el desarrollo de la GVHD. Células T donantes reconocen los antígenos de las células hospedantes como extraños y responden proliferando y liberando citoquinas que, a su vez, pueden activar a células del sistema inmune innato.
El trasplante alogeneico de la médula ósea o el trasplante de células hematopoyéticas sigue siendo la terapia curativa más eficaz para el tratamiento de malignidades hematológicas, tales como leucemia, mieloma, linfoma y anemia aplástica. La GVHD aguda grave es la causa principal de la mortalidad y la morbidez durante el trasplante de la médula ósea. La GVHD crónica también puede dar como resultado la muerte, y los supervivientes están a menudo gravemente discapacitados.
Fármacos inmunosupresores juegan un gran papel en la prevención, el tratamiento terapéutico y el control de la GVHD aguda y crónica. Los fármacos se pueden administrar al paciente antes y después del trasplante. Los fármacos actuales utilizados en el tratamiento terapéutico de la GVHD incluyen ciclosporina, metotrexato, tacrolimus, sacrolimus, micofenolato de mofetilo y esteroides. Los regímenes de inmunosupresión implican, a menudo, la administración de una combinación de fármacos para el efecto máximo.
Chaperonina 10 (cpn 10) está presente en una diversidad de organismos, desde bacterias a seres humanos, y es un miembro de la familia de proteínas de choque térmico (chaperonas) que se encuentran entre las proteínas más evolutivamente estables que existen. Las moléculas de chaperona están implicadas en el plegamiento post-traducción, la fijación como objetivo y la reunión de otras proteínas (Hartman et al., 1992, Proc. Natl. Acad. Sci. USA: 89, 3394-8), pero no forman parte, por sí mismas, de la estructura reunida final (Ellis et al., 1991, Annu. Rev. Biochem. 60, 321-47). Estas proteínas juegan papeles esenciales en las células normales, pero su producción está suprarregulada durante el estrés celular (p. ej. disrupción metabólica, infección, inflamación, transformación).
Inesperadamente, se descubrió que chaperonina 10 tiene la misma secuencia de aminoácidos que el factor temprano del embarazo (EPF - siglas en inglés) (Morton et al., publicación internacional WO 95/15338). El EPF es una sustancia asociada al embarazo que aparece en el suero materno en el espacio de 6-24 h tras la fertilización (Morton et al., 1974, Nature 249; 459-460 y Morton et al., 1976. Proc. R. Soc. Lond., 193; 413-9). Está presente durante al menos la primera mitad del embarazo y es esencial para el desarrollo continuado y la supervivencia del embrión (Morton et al., 1987, Current Topics in Developmental Biology 23; 73-92). Resulta ahora claro que el EPF tiene muchas funciones fisiológicas y su producción no está confinada al embarazo.
Se ha informado que el EPF puede actuar como un inmunosupresor, liberar factores supresores a partir de linfocitos (Rolfe et al., 1988, Clin. Exp. Immunol. 73, 219-225) y aumentar las propiedades inhibidoras de la roseta de un suero inmunosupresor anti-linfocitos (Morton et al., 1974 y 1976, véase antes). El EPF puede suprimir la reacción de hipersensibilidad de tipo retardado a trinitroclorobenceno en ratones (Noonan et al., 1979, Nature, 278, 649-51), suprimir la proliferación de linfocitos inducida por mitógenos (Athanasas-Platsis, 1993, Tésis de Doctorado, Universidad de Queensland) y suprimir la producción de IFN-γ mediante células T CD4+.
Sin embargo, no ha habido evidencia directa alguna en cuanto a si el EPF o cpn10 pueden tener un potencial como un agente inmunosupresor en los trasplantes y, en particular, en la prevención de la GVHD. Chaperonina 60, una proteína de choque térmico relacionada, que también puede actuar como un inmunosupresor, no ha demostrado poseer efectos terapéuticos algunos en la GVHD. De hecho, la técnica anterior enseña que proteínas de choque térmico pueden tener efectos adversos sobre el trasplante (Ogita et al., 2000, Transplantation, 69, 2273-2277).
El documento WO 95/15338 describe una chaperonina 10 recombinante y su uso para tratar injerto de piel en ratas y en ratones in vivo, con el fin de prolongar la supervivencia de los injertos y de reducir el rechazo de los injertos trasplantados.
Morton H et al., muestran el uso de cpn 10 recombinante (factor temprano del embarazo (EPF)) in vivo como un medicamento testado en ratas en cuanto a su papel en la prolongación de los tiempos de supervivencia de injertos de piel (Morton H et al., "Production of a recombinant form of early pregnancy factor that can prolong allogeneic skin graft survival time in rats". IMMUNOLOGY AND CELL BIOLOGY, vol. 78, nº 6, diciembre de 2000 (12-2000), páginas 603-607).
Objeto de la invención
Los autores de esta invención han reconocido que los fármacos inmunosupresores, actualmente utilizados para el tratamiento terapéutico y el control de la GVHD tienen los siguientes defectos importantes:
Por lo tanto, existe una enorme demanda del desarrollo de un nuevo fármaco para tratar y controlar la GVHD que tenga menos efectos secundarios que los tratamientos actualmente disponibles y que sea más eficaz en pacientes que muestren una resistencia a los actuales fármacos en el mercado.
Los autores de la presente invención han descubierto, de forma inesperada, que cpn 10 posee un enorme potencial clínico como una nueva terapia en el tratamiento y control de la GVHD.
Sumario de la invención
En esta memoria se describe el uso de cpn 10 en el trasplante, en particular para el tratamiento y/o la prevención de la enfermedad de injerto frente a hospedante.
También...
Reivindicaciones:
1. Una composición farmacéutica que comprende: una cantidad farmacéuticamente eficaz de chaperonina 10 con la secuencia de aminoácidos recogida en SEQ ID NO:1, y un vehículo, excipiente o diluyente farmacéuticamente aceptable.
2. La composición farmacéutica de la reivindicación 1, que comprende, además, al menos otro agente inmunosupresor.
3. La composición farmacéutica de la reivindicación 2, en la que el otro agente inmunosupresor se selecciona del grupo que consiste en ciclosporina, tacrolimus, sirolimus, micofenolato de mofetilo y metotrexato.
4. Un polipéptido aislado que contiene la secuencia de aminoácidos recogida en SEQ ID NO:1.
Patentes similares o relacionadas:
COMPOSICIÓN PARA EL TRATAMIENTO DEL DOLOR Y/O LA INFLAMACIÓN, del 22 de Febrero de 2012, de BCN PEPTIDES, S.A. DIVERDRUGS, S.L: Composiciones para el tratamiento del dolor y/o la inflamación que comprenden al menos un péptido de fórmula general (I)R1-AA-R2(I)sus estereoisómeros, […]
ENTRENAMIENTO COGNITIVO AUMENTADO, del 6 de Febrero de 2012, de COLD SPRING HARBOR LABORATORY: Un agente de aumento de CREB para su uso en un procedimiento para tratar pérdida de función cognitiva del procedimiento dependiente de traumatismo, […]
MÉTODOS Y COMPUESTOS PARA TRATAR LA DIABETES, del 9 de Diciembre de 2011, de BIOCRINE AB: Uso de una cantidad eficaz del tetrámero de transtiretina para la fabricación de un medicamento para tratar la diabetes de tipo I o para prevenir la […]
USO DE LA PROTEÍNA RGS-14 PARA POTENCIAR LA MEMORIA, del 15 de Septiembre de 2011, de UNIVERSIDAD DE MALAGA: Uso de la proteína RGS-14 para potenciar la memoria.La administración de la proteína RGS-14, también conocida como regulador de la proteína-G señalizadora 14, en cerebro provoca […]
USO DE UN GEN ASOCIADO A LA DIFERENCIACIÓN DEL MELANOMA (MDA-7) PARA INVERTIR UN FENOTIPO CANCEROSO, del 5 de Septiembre de 2011, de THE TRUSTEES OF COLUMBIA UNIVERSITY IN THE CITY OF NEW YORK: Uso de un ácido nucleico que comprende un gen asociado a la diferenciación del melanoma (mda-7) para la preparación de una composición farmacéutica para […]
DETERMINANTES MOLECULARES DE LA OSTEOPATÍA POR MIELOMA Y USO DE LOS MISMOS, del 11 de Julio de 2011, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ARKANSAS: Método ex vivo para determinar el potencial de desarrollar una osteopatía lítica en un paciente con mieloma múltiple, comprendiendo el método la etapa […]
TRATAMIENTO DE LA INSUFICIENCIA RENAL AGUDA CON TROMBOMODULINA SOLUBLE, del 7 de Junio de 2011, de ELI LILLY AND COMPANY INDIANA UNIVERSITY RESEARCH AND TECHNOLOGY CORPORATION: Trombomodulina soluble para usar en el tratamiento de un sujeto humano que tiene insuficiencia renal aguda, en el que dicha trombomodulina soluble […]
COMPLEJOS DE CASEÍNA, del 10 de Mayo de 2011, de DSM IP ASSETS B.V.: Un complejo que comprende (i) un compuesto abarcado por la fórmula general en donde A significa un enlace sencillo o doble de carbono-carbono, pudiendo estar este […]