METODO Y COMPOSICION PARA SOLUBILIZAR UN COMPUESTO BIOLOGICAMENTE ACTIVO CON BAJA SOLUBILIDAD EN AGUA.
Procedimiento para solubilizar una sustancia farmacológica con baja solubilidad en agua,
es decir una sustancia farmacológica que requiere más de 30 partes de agua para disolver 1 parte de la sustancia farmacológica, que comprende mezclar
A) una composición que está contenida en un primer recipiente, que comprende dicha sustancia farmacológica disuelta en
i) al menos un disolvente miscible con agua, o alternativamente
ii) un liofilizado o polvo amorfo de la sustancia farmacológica preparado a partir de una disolución de dicha sustancia farmacológica, con
B) una composición, que se conserva en un segundo recipiente, que comprende una dispersión liposomal
Tipo: Resumen de patente/invención. Número de Solicitud: W0203371EP.
Solicitante: PHARES PHARMACEUTICAL RESEARCH N.V.
Nacionalidad solicitante: Antillas Holandesas.
Dirección: P.O. BOX 6052, EMANCIPATIE BOULEVARD 31,CURACAO, NETHERLANDS ANTILLES.
Inventor/es: VAN HOOGEVEST, PETER, LEIGH,STEVE, LEIGH,MATHEW LOUIS STEVEN, TIEMESSEN,HENRICUS.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Agosto de 2009.
Clasificación Internacional de Patentes:
- A61K9/107D
- A61K9/127P2
Clasificación PCT:
- A61K9/107 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Emulsiones.
- A61K9/127 A61K 9/00 […] › Liposomas.
Clasificación antigua:
Fragmento de la descripción:
Método y composición para solubilizar un compuesto biológicamente activo con baja solubilidad en agua.
La presente invención se refiere a un kit y a un método para solubilizar un compuesto biológicamente activo con baja solubilidad en agua tal como se define en las reivindicaciones.
En esta memoria descriptiva, se aplican las siguientes definiciones:
Un problema importante en la administración de compuestos biológicamente activos se refiere a la escasa solubilidad acuosa de los compuestos. El problema se aplica en particular a compuestos lipófilos que se administran mediante inyección parenteral o intravenosa. Debido a su baja solubilidad, el compuesto puede precipitar antes o después de una infusión o inyección i.v. y provocar obstrucción capilar. Como resultado de la precipitación o agregación, pueden no estar disponibles concentraciones suficientes del fármaco para unirse a las lipoproteínas con el fin de transportarse a los órganos o receptores diana. Por tanto, es necesario solubilizar los compuestos lipófilos para obtener los efectos terapéuticos necesarios.
En la técnica anterior se usan comúnmente etanol y disoluciones acuosas de detergentes tales como Cremophor® EL o polisorbato 80 para solubilizar compuestos lipófilos. Alternativamente, pueden complejarse con hidroxipropil-beta-ciclodextrinas o disolverse en un sistema de emulsión de aceite/agua. Sin embargo, la precipitación del fármaco al diluir el disolvente orgánico es un problema y la anafilaxia tras la inyección con Cremophor® EL no es un problema desconocido. Las emulsiones de aceite en agua se restringen a compuestos con suficiente solubilidad en aceite. Además, los compuestos pueden acelerar la inestabilidad física de las emulsiones de aceite en agua y algunas pueden no ser estables para resistir a la esterilización por calor o el almacenamiento. Los liposomas que comprenden vesículas de fosfolípidos se usan algunas veces para administrar compuestos escasamente solubles en agua tal como la anfotericina. La baja toxicidad y la alta tolerabilidad de los fosfolípidos hacen de los liposomas un vehículo atractivo para administrar compuestos lipófilos. Sin embargo, un uso comercial más amplio de las partículas lipídicas que contienen fármacos lipófilos requiere procedimientos de fabricación problemáticos y costosos para asociar los fármacos lipófilos con los lípidos. Ejemplos de tales procedimientos incluyen homogeneización a alta presión y/o alto cizallamiento, dilución controlada con disolventes orgánicos, filtración de flujo cruzado para producir suspensiones liposomales acuosas que contienen el fármaco (véase por ejemplo, Isele, U.; Van Hoogevest, P.; Hilfiker, R.; Capraro, HG.; Schieweck, K. y Leuenberger, H., Large-Scale Production of Liposomes Containing Monomeric Zinc Phthalocyanine by Controlled Dilution of Organic Solvents, J. Pharm. Sci. (1994), 83,1608-1616) Incluso si los problemas de producción pueden superarse, la mayoría de los fármacos y fosfolípidos son química o físicamente inestables en agua en estado solubilizado y será necesario liofilizarlos para su almacenamiento. El problema en este caso es que los liposomas liofilizados pueden necesitar lípidos sintéticos o semisintéticos costosos con temperaturas de transición de fase altas para mantener la estabilidad física al reconstituir, aumentando adicionalmente los costes ya elevados.
En numerosas referencias de la técnica anterior se describe el uso de fosfolípidos para solubilizar compuestos con baja solubilidad en agua:
La preparación de coprecipitados de lípido-fármaco usando fosfolípidos de diacilo para aumentar el comportamiento de disolución de solvatos farmacológicos escasamente solubles en agua, y la posibilidad de modificar la liberación del fármaco de tales dispersiones incorporando pequeñas cantidades (< 0,05%) de polivinilpirrolidona se describe en J. Pharm. Sci. 81, 283-286 (1992). Las composiciones se preparan esencialmente mediante coprecipitación y da como resultado la incorporación de lípido en la estructura cristalina del solvato. El disolvente residual atrapado en los cristales de solvato se ofrece como una posible razón de la solubilidad mejorada del compuesto escasamente soluble en agua. No se describe una preparación in situ de una formulación farmacológica inyectable.
El documento WO86/05694 describe el uso de ácidos grasos no esterificados y monoglicéridos junto con cantidades menores de un lípido de monoacilo (lisofosfatidilcolina) para formar partículas sólidas que muestran una absorción oral mejorada para diversos compuestos lipófilos. Se explica que la absorción oral mejorada se debe a las propiedades únicas de la mezcla. No se describe una preparación in situ de una formulación farmacológica inyectable.
El documento US-A-5.091.188 da a conocer composiciones inyectables y métodos para hacer los polvos insolubles o escasamente solubles más estables, estabilizando las superficies externas con una o más capas de fosfolípidos para impedir la aglomeración de las partículas del fármaco durante el almacenamiento. El fármaco no está en dispersión molecular y no se describe una preparación in situ de una formulación inyectable.
El documento WO 99/49846 da a conocer composiciones y procedimientos que proporcionan partículas estables de tamaño submicrométrico y micrométrico de fármacos insolubles en agua junto con fosfolípidos, un modificador de superficie cargado y un copolímero de bloque adherido a la superficie para impedir que las partículas experimenten crecimiento de partícula, agregación o floculación en suspensión. Las partículas no están en dispersión molecular con las moléculas lipídicas. Se necesita un mezclado de alto cizallamiento por medio de múltiples pasadas a través de un microfluidizador para reducir el tamaño de las partículas de fármaco. No hay mención de una preparación extemporánea de una formulación farmacológica inyectable.
El...
Reivindicaciones:
1. Procedimiento para solubilizar una sustancia farmacológica con baja solubilidad en agua, es decir una sustancia farmacológica que requiere más de 30 partes de agua para disolver 1 parte de la sustancia farmacológica, que comprende mezclar
2. Procedimiento según la reivindicación 1, en el que el segundo recipiente comprende una dispersión de liposomas que es ópticamente clara permitiendo que al menos el 40% de la luz se transmita a una longitud de onda de 660 nm usando una cubeta o célula de transmisión de 1 cm.
3. Procedimiento según la reivindicación 1 ó 2, en el que el disolvente miscible con agua en el primer recipiente se selecciona del grupo que consiste en etanol, etanol al 96%, glicerol absoluto, propilenglicol, lactato de etilo, polietilenglicol 300, polietilenglicol 400, 1,3-butanodiol, éster dietílico del ácido succínico, citrato de trietilo, sebacato de dibutilo, dimetilacetamida, DMSO, glicerinformal, glicofurol (tetraglicol), isopropanol, éster butílico del ácido láctico, N-metilpirrolidona, Solketol, carbonato de propileno, diacetato de propilenglicol, alcohol tetrahidrofurfurílico, monoetil éter de dietilenglicol y triacetina.
4. Procedimiento según la reivindicación 1 ó 2, en el que la dispersión liposomal en el segundo recipiente comprende liposomas que tienen un tamaño de partícula promedio que es menor de 1000 nm.
5. Procedimiento según la reivindicación 4, en el que la dispersión liposomal en el segundo recipiente comprende liposomas que tienen un tamaño de partícula promedio que es menor de 300 mn.
6. Procedimiento según la reivindicación 1, en el que el primer recipiente comprende al menos un excipiente seleccionado del grupo que consiste en lípidos de membrana de mono y diacilo tales como fosfatidilcolina de huevo, fosfatidilcolina de soja o fosfatidilglicerol de soja, ácidos grasos y sales de los mismos, polisorbato 80, poloxámero y Cremophor® EL.
7. Procedimiento según la reivindicación 1, en el que la dispersión liposomal en el segundo recipiente comprende fosfolípidos seleccionados del grupo que consiste en fosfatidilcolina, fosfatidiletanolamina, esfingomielina, ácido fosfatídico, fosfatidilinositol, fosfatidilserina y fosfatidilglicerol, glicolípidos, gangliósidos y cerebrósidos.
8. Procedimiento según la reivindicación 6 ó 7, en el que el fosfolípido es de fórmula
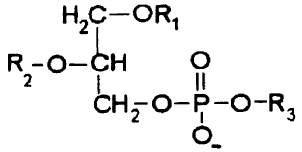
en la que R1 representa acilo C10-C20; R2 representa hidrógeno o acilo C10-C20; R3 representa hidrógeno, 2-trimetilamino-1-etilo, 2-amino-1-etilo, alquilo C1-C4, alquilo C1-C5 sustituido con carboxilo, alquilo C2-C5 sustituido con carboxilo e hidroxilo, alquilo C2-C5 sustituido con carboxilo y amino, un grupo inositol o un grupo glicerilo o una sal de los mismos.
9. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que los contenidos de los recipientes primero y segundo se mezclan entre sí in situ, justo antes de la administración parenteral, proporcionado así una composición que es ópticamente clara y está libre de precipitados o sustancia farmacológica no asociada y está lista para su administración parenteral inmediata.
10. Procedimiento según la reivindicación 9, en el que los recipientes se seleccionan del grupo que consiste en ampolla, vial con tapón y tapa de goma, jeringa de una sola y doble cámara, bolsa o botella de infusión, adecuados para la administración parenteral.
11. Procedimiento según una cualquiera de las reivindicaciones 1 a 10, en el que el polvo amorfo contenido en el primer recipiente se prepara mediante precipitación y/o liofilización de una disolución de dicha sustancia farmacológica en un disolvente.
12. Kit para solubilizar una sustancia farmacológica con baja solubilidad en agua, que comprende
estando diseñado dicho kit para mezclar los contenidos de los dos recipientes con el fin de obtener una forma de administración de dicha sustancia farmacológica, adecuada para la aplicación parenteral, oral, pulmonar y tópica a un organismo vivo.
13. Kit según la reivindicación 10, en el que los contenidos de los recipientes primero y segundo se cargan de manera aséptica en viales estériles o se esterilizan al final.
14. Uso del procedimiento según la reivindicación 1 en estudios de células in-vitro.
Patentes similares o relacionadas:
INHIBIDORES DEL PERISTALTISMO DEL MÚSCULO LISO, del 16 de Enero de 2012, de NIHON PHARMACEUTICAL CO., LTD: Emulsión que contiene L-mentol, una grasa o aceite y un tensioactivo, que tiene un tamaño de partícula de aceite promedio inferior a 100 nm y en la que la transmitancia […]
NANOEMULSIÓN TRANSLÚCIDA, SU PROCEDIMIENTO DE FABRICACIÓN Y SUS UTILIZACIONES EN LOS ÁMBITOS COSMÉTICO, DERMATOLÓGICO Y/U OFTALMOLÓGICO, del 9 de Diciembre de 2011, de L'OREAL: Nanoemulsión que lleva una fase oleosa dispersa en una fase acuosa que tiene glóbulos de aceite cuyo tamaño medio numérico es inferior a 100 nanómetros, […]
COMPOSICIÓN FARMACÉUTICA PARENTERAL Y SU PROCEDIMIENTO DE PREPARACIÓN, del 13 de Julio de 2011, de PHYSICA PHARMA: Composición farmacéutica bajo forma de emulsión acuosa que comprende un principio activo sensiblemente insoluble en el agua, con exclusión del Propofol, y un sistema solubilizante […]
MICELAS INVERSAS BASADAS EN FITOESTEROLES Y ACILGLICEROLES Y USO TERAPÉUTICO DE LAS MISMAS, del 9 de Junio de 2011, de MEDESIS PHARMA SA: Sistema micelar inverso que se obtiene mediante el método siguiente: a) poner en contacto i) fitoesterol, ii) acilglicerol, iii) agua y iv) al […]
 COMPOSICIONES DE 25-HIDROXI VITAMINA D3, del 18 de Mayo de 2011, de DSM IP ASSETS B.V.: Una composición de aceite microencapsulado que comprende una composición de aceite comestible que comprende 25-hidroxi Vitamina D3 disuelta […]
COMPOSICIONES DE 25-HIDROXI VITAMINA D3, del 18 de Mayo de 2011, de DSM IP ASSETS B.V.: Una composición de aceite microencapsulado que comprende una composición de aceite comestible que comprende 25-hidroxi Vitamina D3 disuelta […]
ADYUVANTE DE EMULSIÓN FLUOROCARBONADA PARA TERAPIA DE HIFU Y SU USO, del 22 de Marzo de 2011, de CHONGQING HAIFU (HIFU) TECHNOLOGY CO., LTD: Un agente potenciador para uso en el tratamiento con ultrasonido focalizado de alta intensidad (HIFU), en el que el agente potenciador comprende una fase discontinua […]
 COMPOSICIÓN DE MICELAS INVERSAS PARA SUMINISTRAR CATIONES METÁLICOS QUE COMPRENDEN UN DIGLICÉRIDO Y UN FITOSTEROL Y MÉTODO DE PREPARACIÓN, del 7 de Marzo de 2011, de MEDESIS PHARMA: Un procedimiento para preparar micelas inversas con un núcleo acuoso menor o igual a 100 nm, que comprende: (a) poner en contacto (i) un esterol, (ii) […]
COMPOSICIÓN DE MICELAS INVERSAS PARA SUMINISTRAR CATIONES METÁLICOS QUE COMPRENDEN UN DIGLICÉRIDO Y UN FITOSTEROL Y MÉTODO DE PREPARACIÓN, del 7 de Marzo de 2011, de MEDESIS PHARMA: Un procedimiento para preparar micelas inversas con un núcleo acuoso menor o igual a 100 nm, que comprende: (a) poner en contacto (i) un esterol, (ii) […]
EMULSIÓN DE ACEITE EN AGUA QUE COMPRENDE AINE Y HALUROS DE AMONIO CUATERNARIOS, del 17 de Febrero de 2011, de NOVAGALI PHARMA S.A.: Una emulsión de aceite en agua oftálmica que comprende un fármaco antiinflamatorio no esteroideo y un haluro de amonio cuaternario en el que el átomo de […]