EMULSIÓN DE ACEITE EN AGUA QUE COMPRENDE AINE Y HALUROS DE AMONIO CUATERNARIOS.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07112104.
Solicitante: NOVAGALI PHARMA S.A..
Nacionalidad solicitante: Francia.
Dirección: 1 RUE PIERRE FONTAINE 91000 EVRY FRANCIA.
Inventor/es: LAMBERT,GREGORY, GARRIGUE,JEAN-SEBASTIEN, RABINOVICH-GUILATT,LAURA, LALLEMAND,FREDERIC.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Julio de 2007.
Fecha Concesión Europea: 15 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- A61K47/18D
- A61K9/00M16
- A61K9/107D
Clasificación PCT:
- A61K31/196 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › estando el grupo amino unido directamente a un ciclo, p. ej. ácido antranílico, ácido mefenámico, diclofenac, clorambucilo.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/107 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Emulsiones.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
[Campo de la invención]
Esta invención se refiere a medicamentos, incluyendo composiciones oftálmicas que comprenden fármacos antiinflamatorios no esteroideos (AINE), más preferentemente a emulsiones oftálmicas que son útiles para el tratamiento de patologías oculares. Esta invención se refiere también a emulsiones de aceite en agua que comprenden AINE y que además incluyen al menos un compuesto de amonio cuarternario como agente catiónico.
[Antecedentes]
El uso tópico de AINE en el tratamiento de enfermedades oftálmicas se describió por primera vez en el documento US 4.445.151. Esta patente de Estados Unidos divulga formulaciones eficaces con NaH2PO4H2O, Na2PO4H2O, NaCl, cloruro de benzalconio (BAK) y agua esterilizada. Sin embargo, se encontró que estas formulaciones no tenían la estabilidad requerida para la vida útil de almacenamiento en formulaciones.
La solución oftálmica Ocufen, un medicamento no patentado lanzado en 1988, es el primer AINE (flurbiprofeno) aprobado por la FDA para uso oftálmico, e incorpora tiomersal como sistema conservante. Tiomersal es un compuesto organomercúrico irritante (aproximadamente 49% de mercurio en peso), y se conoce por sus efectos secundarios teratógenos. Por tanto, se necesitan nuevas generaciones de formulaciones oftálmicas que estén libres de tiomersal.
La patente de Estados Unidos 5.110.493 divulga soluciones oftálmicas mejoradas y estables (pero no emulsiones) que incluyen AINE y usan BAK como conservante. Esta formulación comprende de 0,001% a 10% de AINE, de 0,001% a 1% de conservante tal como BAK, de 0,001% a 1% de tensioactivo tal como oxtoxinol 40, excipientes y agua. Esta formulación mostró que era estable durante el menos la vida útil de almacenamiento mínima razonable para dichos productos. Sin embargo, la biodisponibilidad es baja: se divulga que los intervalos de dosificación típicos para esta formulación para tratar un estado patológico del ojo varían de aproximadamente 2 a 10 gotas de solución al 0,1% de AINE por día.
Esto aumenta el problema de biodisponibilidad de fármacos instilados por vía tópica tales como AINE. La mayoría de estos AINE presentan complejos problemas de formulación ocular debido a limitaciones de solubilidad acuosa. Por tanto, se han realizado intentos por mejorar la biodisponibilidad ocular de AINE diseñando nuevos sistemas de liberación coloidal basados, bien en nanopartículas, y en emulsiones submicrométricas cargadas positiva o negativamente. Ejemplos de tales emulsiones se divulgan en Klang et al (Journal of Controlled Release, 1999, 57:19-27): AINE 0,1%, MCT 8,5%, Lipoid E80 1,2%, estearilamina 0,3%, alfa-tocoferol 0,02%, poloxámero 188 1%, glicerol 2,25% y agua. El solicitante trabajó en diferentes emulsiones oftálmicas para AINE con el fin de obtener una emulsión que tuviera una mejor estabilidad y proporcionara una mejor biodisponibilidad ocular de los AINE.
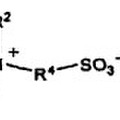
Por tanto, el solicitante trabajó en compuestos de amonio cuaternario de cadena larga tales como BAK, y apreció que la longitud de la cadena de alquilo era importante en lo que se refiere a la función desarrollada por los compuestos de amonio cuaternario en una emulsión de aceite en agua que contenía AINE: actuando sobre la longitud de la cadena de alquilo se conseguía mejorar o reducir el poder catiónico de los compuestos de amonio cuaternario. Sin pretender quedar limitado por ninguna teoría, el solicitante observó al trabajar con emulsiones de aceite en agua que contenían AINE, que los compuestos de amonio cuaternario de cadena de alquilo larga se localizaban preferentemente en la interfase aceite/agua de las emulsiones, dando lugar a (1) emulsiones con mayor potencial zeta, (2) emulsiones más estables.
Además, el solicitante observó que una emulsión que comprende AINE y un haluro de amonio cuaternario en el que el átomo de nitrógeno está sustituido con uno o más grupos alquilo que tienen al menos 12, preferentemente 14 ó 16, más preferentemente 16 átomos de carbono, proporciona una mejor biodisponibilidad ocular comparada con otras formulaciones, lo cual es importante y da como resultado el diseño de emulsiones terapéuticas que tienen un contenido de aceite menor que 6%, preferentemente igual o menor que 5%, siendo así menos irritantes que la emulsión de la técnica anterior. Por tanto, el objeto de esta invención es mejorar una emulsión de aceite en agua que comprende un fármaco antiinflamatorio no esteroideo y un haluro de amonio cuaternario en el que el átomo de nitrógeno está sustituido con uno o más grupos alquilo que tienen al menos 12 átomos de carbono, preferentemente 14 ó 16 átomos de carbono.
De acuerdo con la invención, dicha emulsión es útil con fines oftálmicos.
[Descripción de la invención] En el significado de esta invención, “Emulsiones catiónicas” son emulsiones que tienen un potencial zeta
positivo, preferentemente un potencial zeta mayor que 10 mV;
“alquilo de cadena larga” son restos alquilo que tienen al menos 12 átomos
de carbono, preferentemente al menos 14 átomos de carbono, más
preferentemente al menos 16 átomos de carbono;
cloruro de n-alquil dimetil bencil amonio también se denomina cloruro de
benzalconio (en lo sucesivo denominado también como BAK o BAC)
“BAK C12” se refiere a cloruro de benzododecinio (CAS 139-07-1);
“BAK C14” se refiere a cloruro de miristalconio (CAS 139-08-2);
“BAK C16” se refiere a cloruro de cetalconio (CAS 122-18-9);
“MCT” significa triglicéridos de cadena media, del inglés “Medium Chain
Triglycerides”; para la experimentación, el MCT usado fue TCM™ (Societe
des Oleagineux, Francia).
“Flurbiprofeno” se refiere a un compuesto seleccionado de ácido 2-((3fluoro-4-fenil)fenil)propanoico y sus sales, de preferencia la sal sódica, y sus hidratos y flurbiprofeno anhídrido; el término “ flurbiprofeno” en el significado de esta invención también incluye derivados de flurbiprofeno, en especial derivados ácidos de flurbiprofeno en los que la función ácido está protegida por un grupo protector adecuado, o derivados amida de flurbiprofeno. El término “flurbiprofeno” en el significado de esta invención puede designar (1) flurbiprofeno racémico, es decir, una mezcla de (S)-flurbiprofeno y (R)flurbiprofeno, e incluye no solo una mezcla de (S)-flurbiprofeno y (R)flurbiprofeno en una relación molar de 50:50, sino también una mezcla de (S)flurbiprofeno y (R)-flurbiprofeno en una relación molar de 20:80 a 80:20, de preferencia de 30:70 a 70:30, (2) o formas enantioméricas puras o enriquecidas, tales como por ejemplo (R)-flurbiprofeno o S-flurbiprofeno, de preferencia S-flurbiprofeno, así como sales farmacéuticamente aceptables.
Esta invención se refiere así a una emulsión oftálmica de aceite en agua que comprende al menos un AINE y al menos un haluro de amonio cuaternario, más preferentemente cloruro o bromuro de amonio, en el que el átomo de nitrógeno del grupo amonio está sustituido con al menos uno o solo un grupo alquilo que tiene al menos 12 átomos de carbono, más preferentemente con un grupo alquilo que tiene al menos 14 átomos de carbono, más preferentemente con un grupo alquilo que tiene al menos 16 átomos de carbono.
De acuerdo con una realización, el fármaco antiinflamatorio no esteroideo se elige de entre ketorolaco, salicilato, indometacina, ibuprofeno, diclofenaco, flurbiprofeno, suprofeno, piroxicam, inhibidores de la COX2, diclofenaco, nimesulida, nepafenaco, incluyendo cualquiera de sus derivados, profármacos y sales.
De forma ventajosa, dicho fármaco antiinflamatorio no esteroideo es flurbiprofeno.
De acuerdo con una realización, la emulsión de aceite en agua terapéutica de la invención comprende 0,001% a 10%, preferentemente 0,01% a 1%, más preferentemente 0,02% a 0,05% de un fármaco antiinflamatorio no esteroideo, preferentemente flurbiprofeno, en peso respecto al peso total de la emulsión.
De acuerdo con una realización, el haluro de amonio cuaternario es un haluro de alquil-C16 amonio cuaternario, preferentemente cloruro de alquil-C16 bencil dimetil amonio.
De forma ventajosa, el haluro de amonio es BAK C12, BAK C14, BAK C16 o una de sus mezclas. De acuerdo con...
Reivindicaciones:
1. Una emulsión de aceite en agua oftálmica que comprende un fármaco antiinflamatorio no esteroideo y un haluro de amonio cuaternario en el que el átomo de nitrógeno está sustituido con uno o más grupos alquilo que tienen al menos 12 átomos de carbono.
2. Una emulsión de aceite en agua de acuerdo con la reivindicación 1, en la que dicho fármaco antiinflamatorio no esteroideo se elige de ketorolaco, salicilato, indometacina, ibuprofeno, diclofenaco, flurbiprofeno, suprofeno, piroxicam, inhibidores de la COX2, diclofenaco, nimesulida, nepafenaco.
3. Una emulsión de aceite en agua de acuerdo con la reivindicación 1, en la que dicho fármaco antiinflamatorio no esteroideo es flurbiprofeno.
4. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 3, que comprende 0,001% a 10% de un agente antiinflamatorio no esteroideo, preferentemente 0,01% a 1%, más preferentemente 0,02% a 0,5% p/p de la emulsión.
5. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en la que dicho haluro de amonio cuaternario es un haluro de alquil-C16 amonio cuaternario.
6. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en la que dicho haluro de amonio cuaternario es cloruro o bromuro de bencil dimetil amonio, en el que el átomo de nitrógeno está sustituido con un grupo alquilo que tiene al menos 12 átomos de carbono.
7. Una emulsión de aceite en agua de acuerdo con la reivindicación 6, en la que dicho haluro de amonio cuaternario es cloruro de alquil-C16 bencil dimetil amonio.
8. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en la que dicho haluro de amonio cuaternario es un cloruro o bromuro de trimetil amonio, en el que el átomo de nitrógeno está sustituido además con un grupo alquilo que tiene al menos 12 átomos de carbono.
9. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 8, que comprende además una fase oleosa que comprende MCT, aceite de ricino o aceite mineral, tensioactivos elegidos preferentemente entre al menos uno de tiloxapol, poloxámero, tocoferol, succinato de polietilenglicol, monolaurato de sorbitán y polisorbato, y opcionalmente antioxidantes y/o agentes de isotonicidad elegidos
preferentemente entre al menos uno de glicerol y manitol.
10. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 9, que comprende 0,001 a 0,1% de haluro de amonio.
11. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 10, teniendo dicha emulsión un potencial zeta positivo.
12. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 11, teniendo dicha emulsión un tamaño de gotitas de 100 a 500 nm.
13. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 12, estando dicha emulsión conservada.
14. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 12, estando dicha emulsión no conservada.
15. Una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 14, que comprende además un agente inmunosupresor, preferentemente ciclosporina.
16. Medicamento que comprende una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 15.
17. Medicamento de acuerdo con la reivindicación 16, en una forma de dosificación unitaria.
18. Medicamento de acuerdo con la reivindicación 16 ó 17, en el que la emulsión es estéril.
19. Uso de una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 15 para la fabricación de un medicamento para el tratamiento de una enfermedad ocular causada por, asociada con, o acompañada por procesos inflamatorios.
20. Uso de una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 15 para la fabricación de un medicamento que se va a aplicar antes de una intervención quirúrgica o inmediatamente después de un traumatismo con el fin de prevenir inflamación o de prevenir el desarrollo de un proceso inflamatorio.
21. Uso de una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 15 para la fabricación de un medicamento para el tratamiento de inflamación o para la limitación de un proceso inflamatorio.
22. El uso de acuerdo con cualquiera de las reivindicaciones 19 a 21, en el que dicho medicamento se administra menos de cuatro veces al día, preferentemente menos de dos veces al día y más preferentemente
menos de una vez al día.
23. Procedimiento para fabricar un preconcentrado de una emulsión de aceite en agua de acuerdo con una cualquiera de las reivindicaciones 1 a 15, teniendo dicho preconcentrado un contenido en aceite igual o superior al 20% v/v, comprendiendo el procedimiento las etapas de emulsión/mezcla de la fase oleosa con una fase acuosa y con componente(s) tensioactivo(s), estando disuelto el fármaco antiinflamatorio no esteroideo en la fase oleosa.
24. Preconcentrado de una emulsión de aceite en agua terapéutica, que tiene un contenido en aceite igual o superior al 20% v/v, que comprende un fármaco antiinflamatorio no esteroideo y un haluro de amonio cuaternario en el que el átomo de nitrógeno está sustituido con uno o más grupos alquilo que tienen al menos 12 átomos de carbono, pudiéndose obtener dicho preconcentrado emulsionando/mezclando la fase oleosa con una fase acuosa y con componente(s) tensioactivo(s), estando disuelto el fármaco antiinflamatorio no esteroideo en la fase oleosa.
25. Un procedimiento para fabricar una emulsión de aceite en agua oftálmica de acuerdo con una cualquiera de las reivindicaciones 1 a 15, que comprende
(1) fabricar un preconcentrado de una emulsión de aceite en agua, teniendo dicho preconcentrado un contenido en aceite de al menos 3% v/v, preferentemente igual o superior a 10% v/v, más preferentemente igual o superior a 20% v/v, incluso más preferentemente igual o superior a 30% v/v, que comprende las etapas de emulsionar/mezclar un aceite adecuado para uso oftálmico seleccionado del grupo que comprende aceite mineral, aceite de ricino y MCT, con una fase acuosa y con componente(s) tensioactivo(s) y
(2) diluir un volumen del preconcentrado resultante con 2 a 50 volúmenes de agua, que opcionalmente contiene un cloruro de amonio cuaternario, preferentemente BAK C16.
Patentes similares o relacionadas:
COMPOSICIÓN FARMACÉUTICA ESTABLE DE TIMOLOL, DORZOLAMIDA Y BRIMONIDINA, del 18 de Noviembre de 2011, de JIMENEZ-BAYARDO, ARTURO: Composición farmacéutica estable para el tratamiento de la hipertensión ocular del tipo que comprende las moléculas activas Maleato de Timolol, Tartrato de Brimonidina […]
PREPARACIONES PERCUTANEAMENTE ABSOBIBLES, del 12 de Abril de 2011, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación no acuosa percutáneamente absorbible que comprende un fármaco ácido en forma de sal y una o más sales de adición de compuestos de amonio
COMPOSICIONES Y DISPOSITIVOS HEMOSTÁTICOS, del 15 de Febrero de 2011, de ETHICON, INC.: Composición hemostática que comprende: un líquido biocompatible, partículas de un polímero biocompatible adecuado para su uso en hemostasia […]
 SISTEMAS DE USO TOPICO DE EMULSION MULTIVESICULAR, del 8 de Abril de 2010, de HEALTHPOINT, LTD.: Composición de aplicación tópica que está compuesta de una emulsión multivesicular derivada de un emulsionante de sal de amina cuaternaria […]
SISTEMAS DE USO TOPICO DE EMULSION MULTIVESICULAR, del 8 de Abril de 2010, de HEALTHPOINT, LTD.: Composición de aplicación tópica que está compuesta de una emulsión multivesicular derivada de un emulsionante de sal de amina cuaternaria […]
DISPERSIONES Y SOLUCIONES ACUOSAS DE COMPUESTOS DIFICILES DE DISOLVER Y PROCEDIMIENTOS PARA SU PREPARACION, del 3 de Noviembre de 2009, de TEVA PHARMACEUTICAL INDUSTRIES, INC.: Procedimiento para preparar una solución o suspensión acuosa de un compuesto difícil de disolver en agua que comprende: preparar una solución de por lo menos un compuesto […]
 COMPOSICIONES OFTÁLMICAS CON UN TENSIOACTIVO ANFÓTERO Y ÁCIDO HIALURÓNICO, del 2 de Enero de 2012, de BAUSCH & LOMB INCORPORATED: Una composición oftálmica que comprende:
0,5 ppm a 2 ppm de poli(hexametileno biguanida);
0,002% p a 0,04% p de ácido hialurónico;
0,5 ppm a 3 ppm de cloruro […]
COMPOSICIONES OFTÁLMICAS CON UN TENSIOACTIVO ANFÓTERO Y ÁCIDO HIALURÓNICO, del 2 de Enero de 2012, de BAUSCH & LOMB INCORPORATED: Una composición oftálmica que comprende:
0,5 ppm a 2 ppm de poli(hexametileno biguanida);
0,002% p a 0,04% p de ácido hialurónico;
0,5 ppm a 3 ppm de cloruro […]
AGENTES PARA EL TRATAMIENTO DE LA RETINOPATÍA GLAUCOMATOSA Y DE LA NEUROPATÍA ÓPTICA, del 30 de Diciembre de 2011, de NOVARTIS AG: Composición para el tratamiento de la retinopatía glaucomatosa o de la neuropatía óptica en un sujeto en la que la composición proporciona una concentración […]
PREPARADOS LÍQUIDOS ACUOSOS Y PREPARADOS LÍQUIDOS ACUOSOS FOTOESTABLES, del 30 de Diciembre de 2011, de SENJU PHARMACEUTICAL CO., LTD.: Un preparado líquido acuoso que comprende una sal de adición de ácido del ácido (+)-(S)-4-[4-[(4-clorofenil)(2- piridil)metoxi]piperidino] butírico y un cloruro metálico soluble […]