SALES MALEATO DE UN DERIVADO DE QUINAZOLINA UTIL COMO AGENTE ANTIANGIOGENICO.
Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina,
en la Forma A cristalina, donde dicha sal tiene un patrón de difracción de rayos x de polvo con por lo menos un pico en 2-teta = 21,5º más o menos 0,5º 2-teta o en 2-teta = 16,4º más o menos 0,5º 2-teta
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2004/005359.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: ASTRAZENECA AB03367050101157-1X EP,151 85 SODERTALJE.
Inventor/es: MCCABE,JAMES.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07D403/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 403/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos por el grupo C07D 401/00. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- A61K31/505 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirimidinas; Pirimidinas hidrogenadas, p. ej. trimetoprima.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D403/12 C07D 403/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación antigua:
- A61K31/505 A61K 31/00 […] › Pirimidinas; Pirimidinas hidrogenadas, p. ej. trimetoprima.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- C07D403/12 C07D 403/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
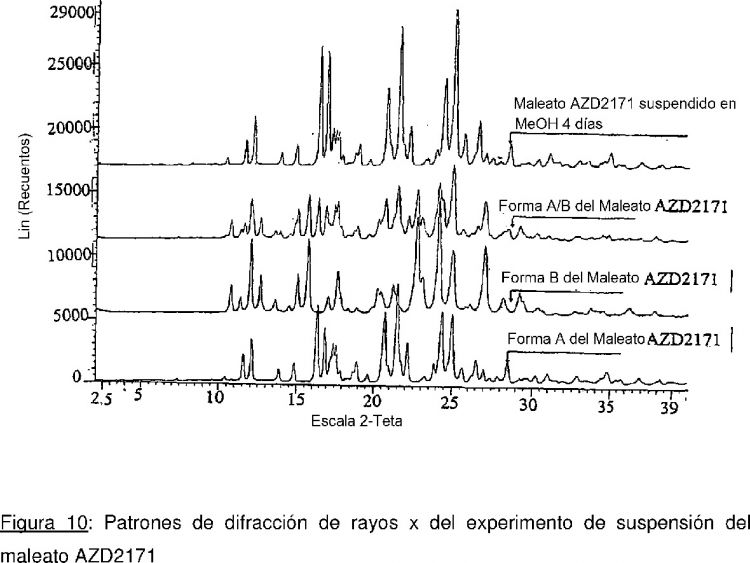
Fragmento de la descripción:
Sales maleato de un derivado de quinazolina útil como agente antiangiogénico.
La presente invención se refiere a formas cristalinas particulares de sal de maleato AZD2171, a procedimientos para su preparación, a composiciones farmacéuticas que las contienen como ingrediente activo y a su uso en la elaboración de medicamentos para uso en la producción de permeabilidad antiangiogénica y/o vascular que reduce los efectos en animales de sangre caliente, tales como seres humanos para el tratamiento de estados de enfermedad asociados con angiogénesis y/o aumento de la permeabilidad vascular.
La angiogénesis normal juega un importante papel en diversos procesos, que incluyen el desarrollo embrionario, la cicatrización de las heridas y varios componentes de la función reproductora femenina. La angiogénesis indeseable o patológica ha sido asociada a estados de enfermedad que incluyen la retinopatía diabética, la soriasis, el cáncer, la artritis reumatoide, el ateroma, el sarcoma de Kaposi y el hemangioma (Fan et al, 1995, Trends Pharmacol. Sci. 16: 57-66; Folkman, 1.995, Nature Medicine 1: 27-31). Se cree que la alteración de la permeabilidad vascular juega un papel tanto en procesos fisiológicos normales como patológicos (Cullinan-Bove et al, 1993, Endocrinology 133: 829-837; Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324). Se han identificado varios polipéptidos con actividad promotora del crecimiento celular endotelial in vitro, que incluyen factores de crecimiento de fibroblastos ácidos y básicos (aFGF y bFGF) y el factor A de crecimiento endotelial vascular (VEGF). En virtud de la expresión restringida de sus receptores, la actividad de factor de crecimiento del VEGF, en contraste con la de los FGF, es relativamente específica hacia las células endoteliales. Pruebas recientes indican que el VEGF es un importante estimulador tanto de la angiogénesis normal como patológica (Jakeman et al, 1993, Endocrinology, 133: 848-859; Kolch et al, 1995, Breast Cancer Research and Treatment, 36:139-155) y de la permeabilidad vascular (Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024). El antagonismo de la acción del VEGF por secuestro del VEGF con anticuerpo puede dar como resultado la inhibición del crecimiento tumoral (Kim et al, 1993, Nature 362: 841-844).
Las tirosina cinasas receptoras (RTK, por sus siglas en inglés) son importantes en la transmisión de señales bioquímicas a través de la membrana plasmática de las células. Estas moléculas transmembranales consisten de manera característica en un dominio extracelular de unión al ligando conectado mediante un segmento de la membrana plasmática a un dominio intracelular con actividad tirosina cinasa. La unión del ligando al receptor da como resultado la estimulación de la actividad de la tirosina cinasa asociada al receptor, que conduce a la fosforilación de los restos de tirosina tanto en el receptor como en otras moléculas intracelulares. Estos cambios en la fosforilación de la tirosina inician una cascada de señales que conduce a una variedad de respuestas celulares. Hasta la fecha, se han identificado al menos diecinueve subfamilias distintas de RTK, definidas por la homología de secuencias de aminoácidos. Una de estas subfamilias está actualmente comprendida por el receptor de tirosina cinasa de tipo fms, Flt-1, el receptor que contiene el dominio de inserción de cinasa, KDR -1 (también referido como Flk-1) y otro receptor de tirosina cinasa de tipo fms, Flt-4. Se ha demostrado que dos de estas RTK relacionadas, Flt-1 y KDR, se unen a VEGF con gran afinidad (De Vries et al., 1992, Science 255: 989-991; Terman et al., 1.992, Biochem. Biophys. Res. Comm. 1.992, 187: 1579-1586). La fijación de VEGF a estos receptores expresados en células heterólogas se ha asociado con cambios en el estado de fosforilación de la tirosina de las proteínas celulares y en los flujos de calcio.
El VEGF es un estímulo clave para la vasculogénesis y la angiogénesis. Esta citocina induce un fenotipo de crecimiento vascular rápido induciendo la proliferación de células endoteliales, la expresión y migración de proteasa, y la posterior organización de las células para formar un tubo capilar (Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., y Connolly, D.T., Science (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., y Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. y Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996.). Además, el VEGF induce una significativa permeabilidad vascular (Dvorak, H.F., Detmar, M., Claffey, K.P., Nagy, J.A., van de Water, L., y Senger, D.R., (Int. Arch. Allergy Immunol., 107: 233-235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. y Williams, B. J. Physiol. (Lond.), 533: 263-272, 2001), promoviendo la formación de una red vascular inmadura, hiperpermeable, que es característica de la angiogénesis patológica.
Se ha demostrado que la activación del KDR solo es suficiente para promover todas las respuestas fenotípicas principales al VEGF, incluyendo proliferación, migración y supervivencia de células endoteliales, y la inducción de permeabilidad vascular (Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Büttner, M., Rziha, H-J., y Dehio, C., EMBO J., 18: 363-374, 1999; Zeng, H., Sanyal, S. y Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001; Gille, H., Kowalski, J., Li, B., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. y Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001).
Los compuestos que inhiben los efectos de VEGF tienen valor en el tratamiento de estados de enfermedad asociados con angiogénesis y/o aumento de la permeabilidad vascular tales como cáncer (incluyendo leucemia, mieloma múltiple y linfoma), diabetes, soriasis, artritis reumatoidea, sarcoma de Kaposi, hemangioma, nefropatías agudas y crónicas, ateroma, restenosis arterial, enfermedades autoinmunitarias, inflamación aguda, formación excesiva de cicatrices y adherencias, endometriosis, linfoedema, hemorragia uterina disfuncional y enfermedades oculares con proliferación de vasos de la retina, incluyendo degeneración macular.
Los derivados de quinazolina que son inhibidores de tirosina cinasa VEGF se describen en el documento WO 00/47212. El compuesto AZD2171 se ejemplifica en el documento WO 00/47212, (véase Ejemplo 240), y es 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina de la fórmula I:
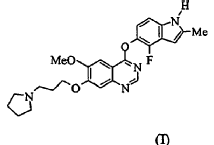
El AZD2171 muestra una excelente actividad en los ensayos in vitro (a) enzimáticos y (b) HUVEC que se describen en el documento WO 00/47212 y a continuación en este documento. Los valores IC50 del AZD2171 respecto a la inhibición de las actividades tirosina cinasa aisladas de KDR (VEGFR-2) y Flt-1 (VEGFR-1) en el ensayo enzimático fueron < 2 nM y 5
Se prefieren formas más estables de un compuesto farmacéuticamente activo, por ejemplo formas cristalinas más estables, para la formulación y procesamiento a escala comercial. Esto se debe a la mayor estabilidad de la forma utilizada, el menor riesgo de que se convierta en otra forma durante los procedimientos de formulación, tales como compresión. Esto a su vez provee mayor predicción de las propiedades de la formulación final, como índice de disolución de los comprimidos, biodisponibilidad del ingrediente activo. El uso de una forma más estable del ingrediente activo nos permite un mayor control de las propiedades físicas de la formulación.
La base libre AZD2171 (4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina) es un monohidrato cristalino bajo condiciones ambiente. El análisis de calorimetría de barrido...
Reivindicaciones:
1. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma A cristalina, donde dicha sal tiene un patrón de difracción de rayos x de polvo con por lo menos un pico en 2-teta = 21,5º más o menos 0,5º 2-teta o en 2-teta = 16,4º más o menos 0,5º 2-teta.
2. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma A cristalina, según la reivindicación 1 donde dicha sal tiene un patrón de difracción de rayos x de polvo con por lo menos dos picos específicos en 2-teta = 21,5º y 16,4º, en donde dichos valores pueden ser más o menos 0,5º 2-teta.
3. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-S-il)oxi)-6-metoxi-7-(3-(pirrolidan-1-il)propoxi)quinazolina, en la Forma A cristalina, según la reivindicación 1, donde dicha sal tiene un patrón de difracción de rayos x de polvo con picos específicos en 2-teta - 21,5, 16,4, 24,4, 20,7, 25,0, 16,9, 12,1, 22,2, 17,4 y 17,6º, donde dichos valores pueden ser más o menos 0,5º 2-teta.
4. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma A cristalina, según la reivindicación 1, donde dicha sal tiene un patrón de difracción de rayos x de polvo sustancialmente igual al patrón de difracción de rayos x que se muestra en la Figura 5.
5. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma B cristalina, donde dicha sal tiene un patrón de difracción de de rayos x de polvo con por lo menos un pico en 2-teta = 24,2º más o menos 0,5º 2-teta o en 2-teta = 22,7º más o menos 0,5º 2-teta.
6. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma B cristalina, según la reivindicación 5, donde dicha sal tiene un patrón de difracción de rayos x de polvo con por lo menos dos picos específicos en 2-teta = 24,2º y 22,7º en donde dichos valores pueden ser más o menos 0,5º 2-teta.
7. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma B cristalina, según la reivindicación 5, donde dicha sal tiene un patrón de difracción de rayos x de polvo con picos específicos en 2-teta = 24,2, 22,7, 15,7, 12,0, 27,1, 25,0, 17,7, 15,0, 23,1 y 12,6º, donde dichos valores pueden ser más o menos 0,5º 2-teta.
8. Una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina, en la Forma B cristalina, según la reivindicación 5, donde dicha sal tiene un patrón de difracción de rayos x de polvo sustancialmente igual al patrón de difracción de rayos x que se muestra en la Figura 8.
9. Una composición farmacéutica que comprende una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina en la Forma A cristalina, según una cualquiera de las reivindicaciones 1 a 4, en asociación con un excipiente o vehículo farmacéuticamente aceptable.
10. Una composición farmacéutica que comprende una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina en la Forma B cristalina, según una cualquiera de las reivindicaciones 5 a 8, en asociación con un excipiente o vehículo farmacéuticamente aceptable.
11. Un procedimiento para la preparación de una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina en la Forma A cristalina, según se reivindica en una cualquiera de las reivindicaciones 1 a 4, que comprende:
12. Un procedimiento para la preparación de una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina en la Forma A cristalina, según se reivindica en una cualquiera de las reivindicaciones 1 a 4, que comprende:
13. Un procedimiento para la preparación de una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina en la Forma B cristalina, según se reivindica en una cualquiera de las reivindicaciones 5 a 8, que comprende:
14. Uso de una sal de maleato de 4-((4-fluoro-2-metil-1H-indol-5-il)oxi)-6-metoxi-7-(3-(pirrolidin-1-il)propoxi)quinazolina según una cualquiera de las reivindicaciones 1 a 8 en la elaboración de un medicamento para uso en la producción de un efecto antiangiogénico y/o reductor de la permeabilidad vascular en un animal de sangre caliente tal como un ser humano.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de 4,6-diamino-pirimidina como inhibidores de Bmi-1 para el tratamiento del cáncer, del 8 de Julio de 2020, de PTC THERAPEUTICS, INC. (100.0%): Un compuesto de Fórmula (III): **(Ver fórmula)** o una forma del mismo, en donde R1 es heteroarilo bicíclico o heterociclilo bicíclico sustituido, en un […]
Compuestos de pirimidina como inhibidores de quinasas, del 1 de Julio de 2020, de Icahn School of Medicine at Mount Sinai: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal del mismo, donde: R1 es CN, S(O)jAr1 o S(O)k(alquilen C1-6)Ar1; j es 0, 1 o 2; k es 0, 1 o 2; […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]