COMPOSICION FARMACEUTICA EN FORMA DE UN HIDROGEL PARA LA ADMINISTRACION TRANSDERMAL DE SUSTANCIAS ACTIVAS.
Uso de un hidrogel que contiene un diéster del ácido carbónico,
un alcohol alquílico C2-C4, al menos una sustancia activa y una matriz polímera, para la preparación de un contraceptivo transdermal
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07075742.
Solicitante: BAYER SCHERING PHARMA AKTIENGESELLSCHAFT.
Nacionalidad solicitante: Alemania.
Dirección: MULLERSTRASSE 178,13353 BERLIN.
Inventor/es: FRANKE, PATRICK.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Abril de 2004.
Fecha Concesión Europea: 12 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K31/265 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › de ácidos carbónicos, tiocarbónicos, tiocarboxílicos, p. ej. ácido tioacético, ácido xantogénico, ácido tritiocarbónico.
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61K31/565 A61K 31/00 […] › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K47/24 A61K 47/00 […] › que contienen átomos distintos al carbono, hidrógeno, oxígeno, halógenos, nitrógeno o azufre, p. ej. ciclometicona o fosfolípidos.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/00M3
Clasificación PCT:
- A61K31/265 A61K 31/00 […] › de ácidos carbónicos, tiocarbónicos, tiocarboxílicos, p. ej. ácido tioacético, ácido xantogénico, ácido tritiocarbónico.
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61K31/565 A61K 31/00 […] › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K45/06 A61K 45/00 […] › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K47/10 A61K 47/00 […] › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K47/24 A61K 47/00 […] › que contienen átomos distintos al carbono, hidrógeno, oxígeno, halógenos, nitrógeno o azufre, p. ej. ciclometicona o fosfolípidos.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
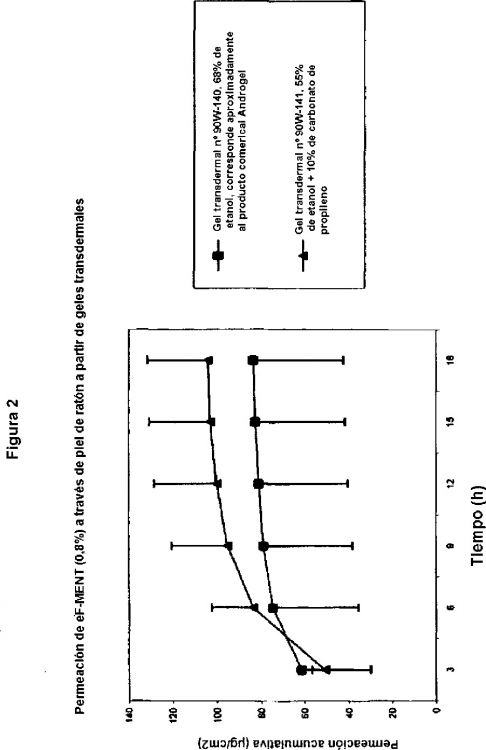
Fragmento de la descripción:
Composición farmacéutica en forma de un hidrogel para la administración transdermal de sustancias activas.
La invención se refiere al uso de un hidrogel, que contiene sustancias activas (sustancias medicamentosas), en particular hormonas esteroides y sus derivados para la preparación de un contraceptivo transdermal. Una forma de realización preferida se refiere al uso de un hidrogel, que contiene carbonato de propileno, etanol y 7a-metil-11ß-fluoro-19-nortestosterona (eF-MENT), para la preparación de un contraceptivo transdermal. La invención se refiere, asimismo, al uso de una composición farmacéutica en forma de un hidrogel, para la preparación de un contraceptivo transdermal, que, en particular, presenta propiedades físicas, en especial una resistencia incrementada al sudor y, por lo tanto, puede ser aplicada de manera particularmente bien sobre la piel.
La administración sistémica de hormonas esteroides puede tener lugar, básicamente, por vía oral con ayuda de formas medicamentosas adecuadas. Sin embargo, a menudo y en el caso de una administración por vía oral, está disminuida la biodisponibilidad, dado que las sustancias activas son metabolizadas en el hígado antes de que accedan a la circulación sanguínea sistémica (el denominado "metabolismo de primer paso"). Además, por norma general, a las formas medicamentosas, en el caso de administración por vía oral, se les exige requisitos particulares, ya que la entrega de las hormonas esteroides debería tener lugar de la forma más uniforme posible a lo largo de un prolongado espacio de tiempo. Con el fin de eludir la administración por vía oral de las hormonas esteroides se desarrollaron determinados derivados de esteroides que se adecuan en especial para la inyección. A este respecto, se puede remitir, por ejemplo, a las memorias de patentes WO 99/67270 y WO 99/67271. Otra posibilidad de administrar las hormonas esteroides de forma continua y eludiendo el efecto de primer paso estriba en el uso de implantes adecuados. Implantes para la administración de andrógenos y sus derivados se dan a conocer, por ejemplo, en las siguientes memorias de patentes: EP-A 970 704, WO 97/30656, WO 99/13883, WO 00/28967, US 5.733.565, K. Sundaram et al., Annuals of Medicine, 1993, 25(2), 199; R.A. Anderson et al., J. Clin. Endocrin & Metab. 1999, 84(10) 3556 y J. Suvisaari et al., Contraception, 1999, 60(5), 299. Sin embargo, estos implantes tienen el inconveniente de que deben ser incorporados en el paciente por el médico mediante una intervención quirúrgica y deben ser retirados de nuevo. Intervenciones quirúrgicas de este tipo conllevan siempre un cierto riesgo de infección.
Además, en la población existe, por principio, una repulsa a métodos de administración de este tipo, en particular cuando hay disponibles procedimientos alternativos para la administración sistémica.
Con el fin de eludir los inconvenientes farmacológicos de la administración por vía oral, por una parte, y, por otra, los inconvenientes de la penetración de la piel, invasiva y puramente mecánica, con ayuda de instrumentos médicos (agujas de inyección, bisturís) se desarrollaron procedimientos, con ayuda de los cuales se difunde la sustancia activa de forma continua a lo largo de un determinado espacio de tiempo a través de la piel y accede, así, al torrente sanguíneo sistémico.
La piel, con una superficie de aproximadamente 20.000 cm2, representa el órgano mayor del cuerpo humano y recibe cerca de un tercio de todo el abastecimiento de sangre en el organismo (véase Y. W. Chien, Logics of transdermal controlled drug administration, Drug Dev. Ind. Pharm. 1983, 9, 497). En primer término, ejerce funciones protectoras: evita la penetración de sustancias extrañas y microorganismos y la pérdida de sustancias endógenas de importancia vital, tales como agua y electrolitos. Sin embargo, la piel no forma barrera totalmente impermeable alguna para sustancias exógenas, de manera que las sustancias activas pueden ser absorbidas por vía transcutánea en el organismo por diferentes vías. La permeabilidad percutánea se ve decisivamente afectada por el lugar de aplicación y el grosor del estrato córneo, el cual representa la barrera principal para sustancias extrañas. Mientras que la hidrocortisona, como sustancia modelo, es absorbida de forma reducida en las superficies de las manos y en las plantas de los pies, la tasa de absorción a través de la piel de la región trasera de la oreja y el escroto está incrementada en hasta 40 veces en comparación con el antebrazo (véase H. Asche, Konzept und Aufbau transdermaler therapeutischer Systeme, Schweiz. Rundsch. Med. Prax. 1985, 74, 3).
Con el fin de que una sustancia activa pueda actuar de forma transdermal, debe difundirse en cantidad suficiente a través de la epidermis de la piel y ser absorbida por la circulación sanguínea. En este caso, la epidermis ejerce una intensa función de barrera la cual ha de atribuirse, por una parte, a que la sustancia activa en cuestión debe pasar, sucesivamente, capas hidrófilas, lipófilas y luego de nuevo hidrófilas pero, por otra parte, también el bajo contenido en agua en el estrato córneo dificulta la difusión de sustancias activas.
La permeación de la capa córnea, requerida para un efecto sistémico y también para el efecto de la mayoría de las sustancias activas a aplicar externamente, tiene lugar, en el caso de una piel no dañada, por vía transepidermal (intercelular o transcelular) y a través de poros (transglandular o transfolicular) (véase, K. Karzel et al., Mechanismen transkutaner Resorption - Pharmakologische und biochemische Aspekte. Arzneim.- Forsch. Drug Res. 1989, 39, 1487).
Desde un punto de vista terminológico, la penetración de una sustancia activa debe diferenciarse de la permeación de una sustancia activa: penetración significa que la sustancia activa accede al interior de la piel, mientras que en el caso de la permeación, la sustancia activa accede, a través de la piel, al torrente circulatorio. Para la administración sistémica de sustancias activas a través de la circulación sanguínea es necesario, por lo tanto, una permeación.
Para la administración transdermal se desarrollaron emplastos con contenido en sustancia activa, con cuya ayuda pueden acceder las sustancias activas a la circulación sanguínea sistémica. La sustancia activa accede por difusión al tejido situado por debajo de la piel y es entregada a los vasos sanguíneos, de modo que puede desplegar sistémicamente su actividad.
Sin embargo, los emplastos con contenido en sustancia activa tienen el inconveniente de que durante el tiempo de la administración de la sustancia activa quedan aplicados sobre la piel de forma perceptible y visible. Además, la lámina de cubrición del emplasto crea condiciones de oclusión. La hinchazón de la piel, determinada por lo anterior, puede conducir a condiciones alteradas de la difusión para la sustancia activa. La sustancia activa es entregada de forma incompleta a la piel en la mayoría de los tipos de emplasto. La retirada de los emplastos supone para el paciente dolores, dado que la vellosidad corporal se adhiere a las superficies adhesivas del emplasto y, por consiguiente, los pelos pueden ser arrancados, junto con sus raices, al retirar el emplasto. Además, los emplastos transdermales tienen el inconveniente de que los adhesivos utilizados provocan en los pacientes, a menudo, alergias e irritaciones cutáneas. También, el pegado y la retirada repetida de los emplalstos con contenido en sustancia activa, en el caso de aplicación múltiple en las mismas zonas de la piel, puede conducir con el tiempo a rubefacciones de la piel e irritaciones.
Un inconveniente esencial de los emplastos con contenido en sustancia activa estriba también en que están limitados en su superficie de contacto con respecto a la piel. Sin embargo, dado que para la actividad de muchas sustancias activas son necesarias concentraciones en plasma comparativamente elevadas, pero éstas sólo pueden alcanzarse en el caso de una administración de la sustancia activa en una gran superficie de la piel, los emplastos con contenido en sustancia activa topan rápidamente en sus límites. Este es particularmente el caso cuando una determinada sustancia activa muestra un comportamiento desfavorable en la permeación, el cual solamente puede ser compensado por un contacto con la piel en una superficie correspondientemente grande. En general, se puede partir del hecho de que los emplastos con un tamaño mayor que 50 cm2 ya sólo son adecuados para su aplicación bajo determinadas condiciones. Dado que en el caso de emplastos...
Reivindicaciones:
1. Uso de un hidrogel que contiene un diéster del ácido carbónico, un alcohol alquílico C2-C4, al menos una sustancia activa y una matriz polímera, para la preparación de un contraceptivo transdermal.
2.Uso según la reivindicación 1, caracterizado porque el diéster del ácido carbónico es un compuesto de la fórmula general (I)
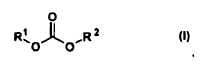
en donde
(i) R1 y R2, independientemente uno de otro, son alquilo C1-C6, alquenilo C2-C6, alquinilo C2-C6, cicloalquilo C4-C6, heterocicloalquilo C1-C6, fenilo, heteroarilo C1-C6, fenil-alquilo C1-C4 o heteroarilalquilo C2-C10, en donde los grupos alquilo, alquenilo y alquinilo puede estar interrumpidos, eventualmente, en cada caso hasta tres veces con átomos de oxígeno y/o átomos de azufre, o
(ii) R1 y R2, independientemente uno de otro, tienen uno de los significados arriba mencionados y están unidos entre sí a través de un enlace C-C.
3. Uso según la reivindicación 2, caracterizado porque el diéster del ácido carbónico es un compuesto de la fórmula general (II)
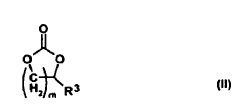
en donde el índice m es un número de 1 a 3 y R3 es hidrógeno o alquilo C1-C4.
4. Uso según la reivindicación 3, caracterizado porque m es 1 y R3 es metilo.
5. Uso según una de las reivindicaciones precedentes, caracterizado porque el alcohol alquílico C2-C4 es etanol.
6. Uso según una de las reivindicaciones precedentes, caracterizado porque la sustancia activa es un esteroide.
7. Uso según la reivindicación 6, caracterizado porque el esteroide es un andrógeno.
8. Uso según la reivindicación 6, caracterizado porque el esteroide es un compuesto de la fórmula general (III)
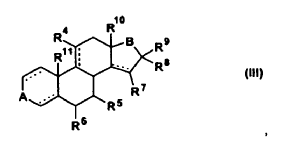
en donde
R4 es hidrógeno, flúor, cloro, alquilo C1-C3 o un grupo hidroxilo eventualmente acetilado,
R5, R6, R7, R8, R9, R10 y R11, independientemente uno de otro, son hidrógeno o alquilo C1-C3,
las líneas discontinuas, independientemente una de otra, son un enlace opcional y
A y B, independientemente uno de otro, son un grupo carbonilo o un grupo
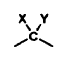
en donde X es un grupo hidroxilo o sus ésteres de un ácido carboxílico con 1-8 átomos de carbono, e Y es hidrógeno o alquilo C1-C3.
9. Uso según la reivindicación 8, caracterizado porque R7, R8 y R9 son hidrógeno.
10. Uso según la reivindicación 6, caracterizado porque el esteroide es un compuesto de la fórmula general (IV)
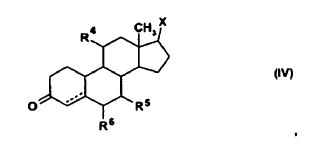
en donde X es un grupo hidroxilo o sus ésteres de un ácido carboxílico con 1-4 átomos de carbono, R4 es hidrógeno, flúor o un grupo hidroxilo, R5 y R6, independientemente uno de otro, son hidrógeno, metilo o etilo y la línea discontinua es un enlace opcional.
11. Uso según la reivindicación 6, caracterizado porque el esteroide es un compuesto de la fórmula general (V)
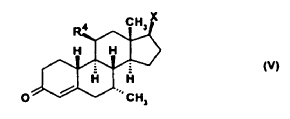
en donde R4 es flúor o hidrógeno y X es un grupo hidroxilo o sus ésteres del ácido acético.
12. Uso según la reivindicación 11, caracterizado porque X es un grupo hidroxilo.
13. Uso según una de las reivindicaciones 6 a 12, caracterizado porque el esteroide está presente en combinación con al menos otra sustancia activa.
14. Uso según una de las reivindicaciones precedentes, caracterizado porque la matriz polímera comprende un polímero acrílico.
15. Uso según la reivindicación 14, caracterizado porque el polímero acrílico comprende un crospolímero de acrilato/acrilato de alquilo C10-C30.
16. Uso según una de las reivindicaciones precedentes, caracterizado porque la matriz polímera comprende un derivado de celulosa.
17. Uso según una de las reivindicaciones precedentes, caracterizado porque contiene 0,01-5,0% en peso de eF-MENT, 0,1-1,5% en peso de crospolímero de acrilato/acrilato de alquilo C10-C30, 0-1,0% en peso de poli(ácido acrílico), 0-2,0% en peso de un derivado de celulosa, 5,0-20,0% en peso de carbonato de propileno, 0,01-5,0% en peso de glicerina, 0,01-5,0% en peso de ciclometicona, 0,01-5,0% en peso de miristato de isopropilo, 20,0-50,0% en peso de agua purificada, 30,0-60,0% en peso de etanol y tris-(hidroximetil)-aminometano hasta pH 5-7.
Patentes similares o relacionadas:
Unidad de dosificación orodispersable que contiene un componente de estetrol, del 29 de Abril de 2020, de Estetra SPRL: Una unidad de dosificación farmacéutica sólida orodispersable que tiene un peso entre 30 y 1.000 mg, y dicha unidad de dosificación consiste […]
Suministro transdérmico, del 8 de Abril de 2020, de AGILE THERAPEUTICS, INC: Un método anticonceptivo, que comprende: (A) aplicar de manera consecutiva múltiples dispositivos de tratamiento de suministro de hormonas transdérmico a la piel […]
Sistema de administración de fármacos por vía transmucosa oral, del 1 de Abril de 2020, de Abon Pharmaceuticals, LLC: Una forma de dosificación transmucosa oral que comprende (a) un vehículo primario monofásico que comprende (i) un agente de inhibición […]
Un dispositivo intravaginal, y un método para reducir la velocidad de difusión de ingredientes activos en dicho dispositivo intravaginal, del 11 de Marzo de 2020, de Qpharma AB: Un anillo intravaginal (1,1',1'') que comprende al menos un primer ingrediente farmacéuticamente activo y al menos una primera capa hecha de al menos un primer material […]
Composiciones de fulvestrant y métodos de uso, del 25 de Diciembre de 2019, de SHIMODA BIOTECH (PTY) LTD: Una formulación que comprende a) una ciclodextrina; y b) un compuesto de la fórmula (I): **(Ver fórmula)** o una sal del mismo o hidrato del anterior; y c) un vehículo […]
Antagonistas de CYP2J2 en el tratamiento del dolor, del 2 de Octubre de 2019, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Un antagonista selectivo de la citocromo P450 epoxigenasa 2J2 (CYP2J2) para uso en la prevención o tratamiento del dolor neuropático periférico inducido por quimioterapia […]
Composiciones y métodos de administración dérmica, del 2 de Octubre de 2019, de AGILE THERAPEUTICS, INC: Una composición para la administración transdérmica de levonorgestrel, que comprende: a) un portador que comprende un adhesivo sensible […]
Uso de un estrógeno en la fabricación de una composición que contiene estrógeno para el tratamiento de la vaginitis atrófica, del 27 de Septiembre de 2019, de NOVO NORDISK HEALTH CARE AG: Uso de un estrogeno en la preparacion de una composicion que contiene estrogeno para el tratamiento de la vaginitis atrofica en mujeres, donde se administra de aproximadamente […]