Nanopartículas de paclitaxel y albúmina en combinación con bevacizumab contra el cáncer.
En combinación: a) una cantidad eficaz de una composición que comprende nanopartículas que comprenden taxano y una proteína vehículo,
y b) una cantidad eficaz de un anticuerpo anti-VEGF, para usar en un método de tratamiento de un cáncer en un individuo, en donde la cantidad eficaz de taxano en la composición de nanopartículas es entre aproximadamente 45 mg/m2 y aproximadamente 350 mg/m2 y la cantidad eficaz del anticuerpo anti-VEGF es de mayor que 1 mg/kg a aproximadamente 10 mg/kg, en donde el cáncer es melanoma.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/023446.
Solicitante: ABRAXIS BIOSCIENCE, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 11755 Wilshire Boulevard, Suite 2100 Los Angeles, CA 90025 ESTADOS UNIDOS DE AMERICA.
Inventor/es: DESAI, NEIL P., SOON-SHIONG, PATRICK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/337 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos de cuatro eslabones, p. ej. taxol.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P35/04 A61P […] › A61P 35/00 Agentes antineoplásicos. › específicos para la metástasis.
PDF original: ES-2469716_T3.pdf
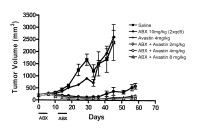
Fragmento de la descripción:
Nanopartïculas de paclitaxel y albïmina en combinaciïn con bevacizumab contra el cïncer
Campo tïcnico La presente invenciïn se refiere a mïtodos y composiciones para el tratamiento de enfermedades proliferativas, que comprenden la administraciïn de una combinaciïn de un taxano y al menos otro u otros agentes terapïuticos, asï como otras modalidades de tratamiento ïtiles en el tratamiento de enfermedades proliferativas. En particular, la invenciïn se refiere al uso de nanopartïculas que comprenden paclitaxel y albïmina (tales como Abraxaneï) en combinaciïn con otros agentes quimioterapïuticos o radiaciïn, que se pueden usar para el tratamiento del cïncer.
Antecedentes La falta de respuesta de un nïmero significativo de tumores a la terapia con fïrmaco y/o radiaciïn es un problema grave en el tratamiento del cïncer. De hecho, esta es una de las razones principales de por quï muchas de las formas mïs prevalentes del cïncer humano todavïa resisten la intervenciïn quimioterapïutica eficaz, a pesar de algunos avances en el campo de la quimioterapia.
El cïncer ahora se trata principalmente con una o una combinaciïn de 3 tipos de terapias: cirugïa, radiaciïn y quimioterapia. La cirugïa es un procedimiento tradicional en el que todo o una parte de un tumor se extrae del cuerpo. En general la cirugïa sïlo es eficaz para el tratamiento de las etapas tempranas del cïncer. Aunque a veces la cirugïa es eficaz para eliminar tumores localizados en algunos sitios, por ejemplo, en mama, colon y piel, no se puede usar en el tratamiento de tumores localizados en otras zonas inaccesibles para los cirujanos, ni en el tratamiento de afecciones neoplïsicas diseminadas tales como la leucemia. Para mïs del 50% de los individuos con cïncer, cuando son diagnosticados ya no son candidatos para un tratamiento quirïrgico eficaz. Los procedimientos quirïrgicos pueden aumentar la metïstasis tumoral por la circulaciïn sanguïnea durante la cirugïa. La mayorïa de los individuos con cïncer no mueren de cïncer en el momento del diagnïstico o cirugïa, sino que mueren por la metïstasis y la recaïda del cïncer.
Otras terapias a menudo tambiïn son ineficaces. La terapia con radiaciïn sïlo es eficaz para individuos que se presentan con la enfermedad clïnicamente localizada en etapas tempranas y medias del cïncer, y no es eficaz para las etapas tardïas del cïncer con metïstasis. En general la radiaciïn se aplica en una zona definida del cuerpo del sujeto que contiene tejido proliferativo anormal, con el fin de maximizar la dosis absorbida por el tejido anormal y minimizar la dosis absorbida por el tejido normal de alrededor. Sin embargo, es difïcil (si no imposible) administrar selectivamente radiaciïn terapïutica en el tejido anormal. Por lo tanto, el tejido normal prïximo al tejido anormal tambiïn estï expuesto a dosis potencialmente daïinas de radiaciïn a lo largo del curso del tratamiento. Tambiïn hay algunos tratamientos que requieren la exposiciïn del cuerpo entero del sujeto a la radiaciïn, en un procedimiento entramado “irradiaciïn total del cuerpo” o “ITC”. La eficacia de las tïcnicas radioterapïuticas para destruir las cïlulas proliferativas anormales estï entonces equilibrada con los efectos citotïxicos asociados en las cïlulas normales cercanas. Debido a esto, las tïcnicas de radioterapia tienen un ïndice terapïutico inherentemente estrecho, lo que da como resultado el tratamiento inadecuado de la mayorïa de los tumores. Incluso las tïcnicas radioterapïuticas mejores pueden producir la reducciïn tumoral incompleta, recaïda del tumor, aumento de la carga tumoral e inducciïn de tumores resistentes a la radiaciïn.
La quimioterapia implica la alteraciïn de la reproducciïn celular o metabolismo celular. La quimioterapia puede ser eficaz, pero tiene efectos secundarios graves, por ejemplo, vïmitos, glïbulos blancos (WBC) bajos, pïrdida de pelo, pïrdida de peso y otros efectos tïxicos. Debido a los efectos secundarios extremadamente tïxicos, muchos individuos con cïncer no pueden terminar con ïxito un rïgimen de quimioterapia completo. Los efectos secundarios inducidos por la quimioterapia tienen un impacto importante en la calidad de vida del individuo y pueden influir drïsticamente en el cumplimiento del tratamiento. Ademïs, los efectos secundarios adversos asociados con los agentes quimioterapïuticos en general son la principal toxicidad limitante de dosis (TLD) en la administraciïn de estos fïrmacos. Por ejemplo, la mucositis es una toxicidad limitante de dosis principal para varios agentes anticancerïgenos, incluyendo los agentes citotïxicos antimetabolitos 5-FU, metrotexato y antibiïticos antitumorales tales como la doxorubicina. Muchos de estos efectos secundarios inducidos por la quimioterapia, si son graves, pueden conducir a la hospitalizaciïn, o requerir el tratamiento con analgïsicos para tratar el dolor. Algunos individuos con cïncer mueren por la quimioterapia debido a la poca tolerancia a la quimioterapia. Los efectos secundarios extremos de los fïrmacos anticancerïgenos son causados por la poca especificidad por la diana de dichos fïrmacos. Los fïrmacos circulan por la mayorïa de los ïrganos normales de los individuos asï como por los tumores diana previstos. La poca especificidad por la diana que causa efectos secundarios tambiïn disminuye la eficacia de la quimioterapia debido a que sïlo una fracciïn del fïrmaco es dirigida de forma correcta. La eficacia de la quimioterapia disminuye ademïs por la poca retenciïn de los fïrmacos anticancerïgenos dentro de los tumores diana.
Debido a la gravedad y extensiïn de neoplasmas, tumores y cïncer, hay una gran necesidad de tratamientos eficaces de dichas enfermedades o trastornos que superen los inconvenientes de la cirugïa, quimioterapia y tratamiento con radiaciïn.
Problemas de los agentes quimioterapïuticos El problema de la resistencia a fïrmacos es una razïn de la importancia aïadida a la quimioterapia de combinaciïn, ya que la terapia tiene que evitar tanto que surjan cïlulas resistentes como matar cïlulas preexistentes que ya son resistentes al fïrmaco.
La resistencia a fïrmacos es el nombre que se da cuando una enfermedad no responde a un tratamiento con un fïrmaco o fïrmacos. La resistencia a fïrmacos puede ser intrïnseca, que significa que la enfermedad no ha respondido nunca al fïrmaco o fïrmacos, o puede ser adquirida, que significa que la enfermedad deja de responder a un fïrmaco o fïrmacos a los que la enfermedad ha respondido previamente. La multirresistencia a fïrmacos (MDR) es un tipo especïfico de resistencia a fïrmacos que se caracteriza por una resistencia cruzada de una enfermedad a mïs de un fïrmaco funcional y/o estructuralmente no relacionados. La multirresistencia al fïrmacos en el campo del cïncer se discute con gran detalle en “Detoxification Mechanisms and Tumor Cell Resistance to Anticancer Drugs, ” de Kuzmich and Tew, en particular la secciïn VII “The Multidrug-Resistant Phenotype (MDR) , ” Medical Research Reviews, Vol. 11, No. 2, 185-217, (Secciïn VII en las pïginas 208-213) (1991) ; y en “Multidrug Resistance and Chemosensitization: Therapeutic Implications for Cancer Chemotherapy, ” de Georges, Sharom and
Ling, Advances in Pharmacology, Vol. 21, 185-220 (1990) .
Una forma de multirresistencia a fïrmacos (MDR) es mediada por una bomba de eflujo dependiente de energïa de 170-180 kD unida a membrana denominada glicoproteïna P (P-gp) . Se ha mostrado que la glicoproteïna P tiene una funciïn principal en la resistencia intrïnseca y adquirida de una serie de fïrmacos productos naturales hidrïfobos contra tumores humanos. Los fïrmacos que actïan como sustratos y por lo tanto son detoxificados por la P-gp
incluyen los alcaloides de la vinca (vincristina y vinblastina) , antraciclinas (adriamicina) y epipodofilotoxinas (etopïsido) . Aunque la MDR asociada a P-gp es un determinante principal en la resistencia de cïlulas tumorales a agentes quimioterapïuticos, estï claro que el fenïmeno de la MDR es multifactorial e implica una serie de mecanismos diferentes.
Una complicaciïn principal de la quimioterapia del cïncer y de la quimioterapia antiviral es el daïo a las cïlulas de la mïdula ïsea o la supresiïn de su funciïn. Especïficamente, la quimioterapia daïa o destruye cïlulas precursoras hematopoyïticas, que se encuentran principalmente en la mïdula ïsea y el bazo, deteriorando la producciïn de nuevas cïlulas sanguïneas (granulocitos, linfocitos, eritrocitos, monocitos, plaquetas, etc.) . El tratamiento de los individuos con cïncer con 5-fluorouracilo, por ejemplo, reduce el nïmero de leucocitos (linfocitos y/o granulocitos)... [Seguir leyendo]
Reivindicaciones:
1. En combinaciïn: a) una cantidad eficaz de una composiciïn que comprende nanopartïculas que comprenden taxano y una proteïna vehïculo, y b) una cantidad eficaz de un anticuerpo anti-VEGF, para usar en un mïtodo de tratamiento de un cïncer en un individuo, en donde la cantidad eficaz de taxano en la composiciïn de nanopartïculas es entre aproximadamente 45 mg/m2 y aproximadamente 350 mg/m2 y la cantidad eficaz del anticuerpo anti-VEGF es de mayor que 1 mg/kg a aproximadamente 10 mg/kg, en donde el cïncer es melanoma.
2. En combinaciïn: a) una cantidad eficaz de una composiciïn que comprende nanopartïculas que comprenden taxano y una proteïna vehïculo, y b) una cantidad eficaz de un anticuerpo anti-VEGF, para usar en un mïtodo de inhibiciïn de la metïstasis tumoral en un individuo, en donde la cantidad eficaz de taxano en la composiciïn de nanopartïculas es entre aproximadamente 45 mg/m2 y aproximadamente 350 mg/m2 y la cantidad eficaz del anticuerpo anti-VEGF es de mayor que 1 mg/kg a aproximadamente 10 mg/kg.
3. La combinaciïn para usar segïn la reivindicaciïn 2, en donde la metïstasis tumoral es metïstasis a los ganglios linfïticos, o al pulmïn, o metïstasis del cïncer de mama.
4. La combinaciïn para usar segïn la reivindicaciïn 2 ï 3, en donde se inhibe al menos aproximadamente 40% o al menos 80% de la metïstasis.
5. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde la cantidad eficaz de anticuerpo anti-VEGF es de aproximadamente 6 mg/kg, aproximadamente 8 mg/kg, o aproximadamente 10 mg/kg.
6. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde la cantidad eficaz del taxano en la composiciïn de nanopartïculas es entre aproximadamente 80 mg/m2 y aproximadamente 150 mg/m2 de taxano en la composiciïn de nanopartïculas, o en donde la cantidad eficaz de taxano en la composiciïn de nanopartïculas es entre aproximadamente 200 mg/m2 y aproximadamente 350 mg/m2 de taxano en la composiciïn de nanopartïculas.
7. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde la composiciïn de nanopartïculas y el anticuerpo anti-VEGF se administran de forma secuencial al individuo.
8. La combinaciïn para usar de la reivindicaciïn 1, en donde la composiciïn de nanopartïculas se administra durante al menos un ciclo antes de la administraciïn del anticuerpo anti-VEGF.
9. La combinaciïn para usar segïn la reivindicaciïn 8, en donde a la administraciïn de la composiciïn de nanopartïculas le sigue la administraciïn de un anticuerpo anti-VEGF durante al menos aproximadamente 3 semanas.
10. La combinaciïn para usar segïn una cualquiera de las reivindicaciones 1 a 6, en donde la composiciïn de nanopartïculas y el anticuerpo anti-VEGF se administran al mismo tiempo.
11. La combinaciïn para usar segïn una cualquiera de las reivindicaciones 1 a 6, en donde la composiciïn de nanopartïculas y el anticuerpo anti-VEGF se administran simultïneamente.
12. La combinaciïn para usar segïn una cualquiera de las reivindicaciones 1 a 6, en donde la composiciïn de nanopartïculas y el anticuerpo anti-VEGF se administran en la misma composiciïn.
13. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde el anticuerpo anti-VEGF es bevacizumab.
14. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde el taxano es paclitaxel.
15. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde el diïmetro medio de las nanopartïculas en la composiciïn no es mayor que aproximadamente 200 nm.
16. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde la proteïna vehïculo es albïmina.
17. La combinaciïn para usar segïn la reivindicaciïn 16, en donde la proteïna vehïculo es albïmina humana o albïmina de suero humano.
18. La combinaciïn para usar segïn la reivindicaciïn 16 ï 17, en donde la relaciïn en peso de la albïmina y el taxano en la composiciïn de nanopartïculas es menor de aproximadamente 9:1.
19. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde la composiciïn de nanopartïculas estï exenta de Cremaphor.
20. La combinaciïn para usar segïn una cualquiera de las reivindicaciones 16 a 19, en donde la composiciïn de nanopartïculas comprende taxano recubierto con albïmina.
21. La combinaciïn para usar segïn una cualquiera de las reivindicaciones precedentes, en donde el individuo es un ser humano.
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Aril éteres y usos de los mismos, del 22 de Julio de 2020, de Peloton Therapeutics, Inc: Un compuesto de formula Vd: **(Ver fórmula)** ç o una sal farmaceuticamente aceptable del mismo, en donde: R1 es arilo o heteroarilo; […]