Modificación química de proteínas para mejorar la biocompatibilidad y la bioactividad.
Una preparación que comprende una proteína mono-succinilada en donde las únicas proteínas modificadas químicamente son aquellas que presentan un grupo succinilo y al menos un 90% de la preparación se encuentra modificada químicamente,
en donde dicha proteína mono-succinilada se modifica exclusivamente en el N-terminal; en donde la proteína es leptina, G-CSF, o el análogo G-CSF (C17A) .
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06025664.
Solicitante: AMGEN INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE THOUSAND OAKS, CA 91320-1799 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KINSTLER, OLAF B., GEGG,COLIN JR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/17 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K47/48
- A61P3/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › Anorexiantes; Medicamentos para el tratamiento de la obesidad.
- A61P43/00 A61P […] › Medicamentos para usos específicos, no previstos en los grupos A61P 1/00 - A61P 41/00.
- A61P7/00 A61P […] › Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular.
- C07K1/107 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › por modificación química de los péptidos precursores.
- C07K14/53 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor estimulante de colonias (CSF).
- C07K14/535 C07K 14/00 […] › CSF de granulocitos; CSF de granulocitos-macrófagos.
- C07K14/575 C07K 14/00 […] › Hormonas.
PDF original: ES-2417131_T3.pdf
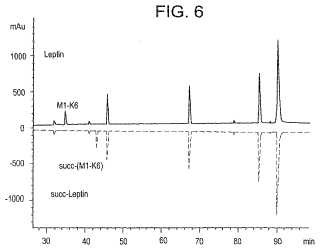
Fragmento de la descripción:
Modificación química de proteínas para mejorar la biocompatibilidad y la bioactividad
Área de la invención La presente invención hace referencia, en líneas generales, a la modificación química de proteínas biológicamente activas o análogos de las mismas (el término “proteína” tal como se utiliza en la presente patente es sinónimo de “polipéptido” o “péptido”, a menos que se indique lo contrario) . De manera más específica, la presente invención describe métodos novedosos para modificaciones químicas de un sitio específico de varias proteínas, y las composiciones resultantes.
Antecedentes de la invención Debido a recientes avances en las tecnologías de ingeniería celular y genética, las proteínas que se conoce que muestran varias acciones farmacológicas in vivo, se pueden producir en grandes cantidades para sus aplicaciones farmacéuticas. Tales proteínas incluyen la eritropoyetina (EPO) , factor estimulante de colonias de granulocitos (G-CSF) , interferones (alfa, beta, gamma, consenso) , proteína de unión al factor de necrosis tumoral (TNFbp) , antagonista de los receptores de la interleucina-1 (IL-1ra) , factor neurotrófico derivado del cerebro (BDNF) , factor del crecimiento de queratinocitos (KGF) , factor de las células madre (SCF) , factor de diferenciación del crecimiento de megacariocitos (MGDF) , osteoprogeterina (OPG) , factor neurotrófico derivado de la línea de células gliales (GDNF) y proteína de la obesidad (proteína OB) . La proteína OB puede ser denominada también como leptina en la presente patente.
El factor estimulante de colonias de granulocitos (G-CSF) es una glicoproteína que induce la diferenciación de las células precursoras hematopoyéticas de los neutrófilos, y estimula la actividad de los neutrófilos maduros. El G-CSF recombinante humano (rhG-CSF, por sus siglas en inglés) , expresado en E.coli, contiene 175 aminoácidos, tiene un peso molecular de 18.978 Da, y es biológicamente activo. Actualmente, el Filgrastim, un G-CSF recombinante, se encuentra disponible para su uso terapéutico.
La estructura del G-CSF bajo diversas condiciones se ha estudiado ampliamente, Lu et al., J. Biol. Chem. Vol. 267, 8770-8777 (1992) , y la estructura tridimensional del rhG-CSF ha sido determinada recientemente mediante cristalografía de rayos X. El G-CSF es un miembro de una clase de factores de crecimiento que comparten un motivo estructural común de un haz de cuatro hélices a, con dos conexiones de cruce; Hill et al., P.N.A.S. USA, Vol. 90, 5167-5171 (1993) . Esta familia incluye el factor estimulante de colonias de granulocitos y macrófagos o GM-CSF (por sus siglas en inglés) , la hormona del crecimiento, interleucina-2, interleucina-4, e interferón B. La extensión de la estructura secundaria es sensible al pH del disolvente, donde la proteína adquiere un grado aún mayor del contenido helicoidal alfa en un pH ácido; Lu et al., Arch. Biochem. Biophys., 286, 81-92 (1989) .
La leptina es activa in vivo tanto en ratones mutantes ob/ob (ratones obesos debido a un defecto en la producción del producto génico OB) , como además en ratones normales de tipo salvaje. La actividad biológica se manifiesta, entre otras cosas, en la pérdida de peso. Véase en general, Barinaga, "Obese" Protein Slims Mice, Science 269: 475-476 (1995) y Friedman, "The Alphabet of Weight Control, " Nature 385: 119-120 (1997) . Se conoce, por ejemplo, que en los ratones mutantes ob/ob, la administración de leptina da como resultado una disminución en los niveles de insulina en suero, y en los niveles de glucosa en suero. También se conoce que la administración de leptina da como resultado una disminución en la grasa corporal. Esta característica se observó tanto en ratones mutantes ob/ob, como además en ratones normales no obesos. Pelleymounter et al., Science 269: 540-543 (1995) ; Halaas et al., Science 269: 543-546 (1995) . Ver también, Campfield et al., Science 269: 546-549 (1995) (La administración periférica y central de dosis de microgramos de leptina redujo la ingesta de alimentos y el peso corporal de ratones ob/ob y ratones con obesidad inducida por la dieta, pero no en los ratones obesos db/db.)
Los experimentos preliminares de pérdida de peso inducida por leptina en modelos animales, predicen la necesidad de una formulación de leptina de alta concentración con una administración crónica para tratar de manera eficaz la obesidad en humanos. Las dosis en un rango de miligramos de proteína por kilogramo de peso corporal, tal como , 5
o 1, 0 mg/kg/día o inferior, resultan deseables para la inyección de cantidades terapéuticamente efectivas en mamíferos de gran tamaño, tales como por ejemplo humanos. Un aumento en la concentración de proteínas es, por tanto, necesario para evitar la inyección de grandes volúmenes, lo cual puede resultar incómodo o posiblemente doloroso para el paciente.
Desafortunadamente, para la preparación de una composición farmacéutica para la inyección en humanos, se ha observado que la secuencia de aminoácidos de la leptina es insoluble en pH fisiológico en concentraciones relativamente elevadas, tales como por encima de aproximadamente 2 mg de proteína activa/por mililitro de líquido. La pobre solubilidad de la leptina bajo condiciones fisiológicas parece contribuir a la formación de precipitados de leptina en el sitio de inyección, de manera dependiente de la concentración, cuando se administran dosis elevadas en una formulación con pH bajo. Asociada a los precipitados de leptina observados, se encuentra, en el sitio de inyección, una respuesta inflamatoria que incluye un infiltrado celular mixto caracterizado por la presencia de eosinófilos, macrófagos y células gigantes.
Hasta la fecha, no se informado sobre preparaciones estables de proteína OB humana en concentraciones de al menos, aproximadamente, 2 mg/ml en pH fisiológico, y además, ni tampoco sobre concentraciones estables de proteína OB humana activa de al menos, aproximadamente, 50 mg/ml o superior. El desarrollo de las formas de leptina que permitirían dosis elevadas sin los problemas mencionados anteriormente, sería de un gran beneficio. Es, por lo tanto, un objeto de la presente invención proporcionar formas mejoradas de leptina mediante la modificación química específica de un sitio de la proteína.
Existen varios métodos de modificación química de proteínas de utilidad terapéutica sobre los que se ha informado. Uno de tales métodos, la succinilación, implica la conjugación de una o más fracciones de succinilo con una proteína biológicamente activa. Las aproximaciones a la succinilación clásicas emplean, tradicionalmente, condiciones de reacción alcalinas con un gran exceso de anhídrido succínico. Los conjugados resultantes de succinilo-proteína se modifican de manera habitual en múltiples sitios, a menudo muestran estructuras terciarias y cuaternarias modificadas, y ocasionalmente se encuentran inactivas. Las propiedades de varias proteínas succiniladas se describen en Holcenberg et al., J. Biol. Chem, 250:4165-4170 (1975) , y en WO 88/01511 (y referencias citadas en la misma) , publicado el 10 de marzo, 1988. Es importante destacar que ninguna de las citadas referencias describe métodos en donde la proteína biológicamente activa se encuentre monosuccinilada exclusivamente en el N-terminal de la proteína, y en donde la composición resultante muestre una solubilidad mejorada y una toxicidad del sitio de inyección mejorada.
El ácido dietilentriaminopentaacético (DTPA) y ácido etilendiaminotetraacético (de ahora en adelante denominado como EDTA2) , se han utilizado habitualmente para introducir sitios de quelación de metales en proteínas con el propósito de radiomarcado. De manera similar a la succinilación, la modificación con DTPA y/o EDTA2 ocurre habitualmente en múltiples sitios por toda la molécula y cambia la carga y el punto isoeléctrico de la proteína modificada. Hasta la fecha, no se ha informado sobre monómeros y dímeros de proteína-EDTA2 y/o –DTPA que muestren una solubilidad mejorada y una toxicidad en el sitio de inyección mejorada.
Resumen de la invención La presente invención hace referencia a una preparación que comprende una proteína mono-succinilada en donde las únicas proteínas modificadas son aquellas que tienen un grupo succinilo y al menos un 90% de la preparación se encuentra químicamente modificada, en donde dicha proteína mono-succinilada se encuentra modificada exclusivamente en el N-terminal; en donde la proteína es leptina, o G-CSF, o su análogo G-CSF (C17A) . De manera inesperada, la modificación química de un sitio de la leptina, demostró tener ventajas de bioavilidad y biocompatibilidad que no se han visto... [Seguir leyendo]
Reivindicaciones:
1. Una preparación que comprende una proteína mono-succinilada en donde las únicas proteínas modificadas químicamente son aquellas que presentan un grupo succinilo y al menos un 90% de la preparación se encuentra modificada químicamente, en donde dicha proteína mono-succinilada se modifica exclusivamente en el N-terminal; en donde la proteína es leptina, G-CSF, o el análogo G-CSF (C17A) .
2. La preparación de acuerdo con la reivindicación 1, en donde al menos el 95% de la preparación se encuentra modificada químicamente.
3. La preparación de acuerdo con la reivindicación 1, en donde al menos el 99% de la preparación se encuentra modificada químicamente.
4. La preparación de acuerdo a la reivindicación 1, en donde dicha proteína es leptina.
5. La preparación de acuerdo a la reivindicación 1, en donde dicha proteína es G-CSF, o el análogo G-CSF (C17A) .
6. Un método para la realización de una preparación que comprende una proteína monosuccinilada, en donde las únicas proteínas modificadas químicamente son aquellas que presentan un grupo succinilo y al menos un 90% de la preparación se encuentra modificada químicamente, que comprende las etapas de:
(a) hacer reaccionar una proteína con anhídrido succínico en un exceso molar de 3-7 veces para formar una mezcla de reacción;
(b) agitar dicha mezcla de reacción 2-16 horas a 4 ºC;
(c) dializar dicha mezcla de reacción contra 20mM de Tris-HCl, pH 7, 2; y
(d) aislar dicha proteína monosuccinilada de la mezcla de reacción, en donde dicha proteína monosuccinilada se encuentra modificada exclusivamente en el N-terminal.
7. Un método de acuerdo con la reivindicación 6, que además comprende tras la etapa (b) , las etapas de:
(1) elevar el pH de dicha mezcla de reacción a 8, 5 utilizando 5N NaOH; y
(2) agitar dicha mezcla de reacción 1-2 horas más a 4 ºC.
8. El método de acuerdo con la reivindicación 6, que además comprende tras la etapa (b) las etapas de:
(1) añadir hidroxilamina sólida a dicha mezcla de reacción mientras se mantiene el pH por encima de 6, 5, hasta que dicha hidroxilamina se disuelve por completo;
(2) elevar el pH a 8, 5 utilizando 5N NaOH;
(3) agitar dicha mezcla 1-2 horas más a 4 ºC;
(4) elevar el pH de dicha mezcla de reacción a 8, 5 utilizando 5N NaOH; y
(5) agitar dicha mezcla de reacción 1-2 horas más a 4 ºC.
9. Una composición farmacéutica que comprende una proteína monosuccinilada de acuerdo con cualquiera de las reivindicaciones 1 a 3.
10. Una composición farmacéutica de acuerdo con la reivindicación 9, en donde dicha proteína es leptina.
11. Una composición farmacéutica de acuerdo con la reivindicación 9, en donde dicha proteína es G-CSF, o el análogo G-CSF (C17A) .
Patentes similares o relacionadas:
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Derivado de dihidroindolizinona, del 1 de Julio de 2020, de ONO PHARMACEUTICAL CO., LTD.: (3S)-3-[2-(6-amino-2-fluoro-3-piridinil)-4-fluoro-1H-imidazol-5-il]-7-[5-cloro-2-(1H-tetrazol-1-il)fenil]-2,3-dihidro- (1H)-indolizinona, una…
Inhibidor de fibrosis, del 1 de Julio de 2020, de NIPPON SHINYAKU CO., LTD.: Composición farmacéutica que comprende un derivado heterocíclico seleccionado de ácido 2-{4-[N-(5,6-difenilpirazin-2-il)-N-isopropilamino]butiloxi}acético […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]