Métodos para el tratamiento de la artritis reumatoide.
Composición farmacéutica que comprende un anticuerpo anti-IL-1ß o un fragmento del mismo,
para uso en el tratamiento de la artritis reumatoide, en donde el anticuerpo o el fragmento de anticuerpo se une a IL-1ß humana con una constante de disociación de 1 pM o menor, en donde el anticuerpo o el fragmento del mismo compite en la unión con un anticuerpo que tiene la región variable de la cadena ligera de SEQ ID NO: 5 y la región variable de la cadena pesada de SEQ ID NO: 6, en donde la administración de una dosis inicial del anticuerpo o del fragmento de anticuerpo está seguida por la administración de una o varias dosis posteriores, en donde la dosis inicial y cada una de las dosis posteriores se administran en un intervalo desde una vez a la semana hasta una vez cada seis meses y en donde el anticuerpo o el fragmento de anticuerpo se va a administrar con una dosis de al menos 0,01 mg/kg a 1 mg/kg de anticuerpo o de fragmento de anticuerpo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/046441.
Solicitante: XOMA TECHNOLOGY LTD..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2910 Seventh Street Berkeley, CA 94710.
Inventor/es: SOLINGER,ALAN M, OWYANG,ALEXANDER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P19/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para problemas de las articulaciones, p.ej. artritis, artrosis.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
PDF original: ES-2398693_T3.pdf
Fragmento de la descripción:
Métodos para el tratamiento de la artritis reumatoide.
Campo de la invención La presente descripción se refiere a métodos para el tratamiento y/o la prevención de la artritis reumatoide. Tales métodos pueden utilizarse para tratar a un individuo que la padece o para prevenir la aparición de la misma en un individuo que tiene riesgo de padecerla.
Antecedentes de la invención La presente descripción se refiere a métodos para el tratamiento y/o la prevención de la artritis reumatoide (AR) en un individuo. Tales métodos se pueden utilizar para tratar a un individuo mamífero, tal como por ejemplo un ser humano, que padece artritis reumatoide o para prevenir la aparición de la misma en un individuo vulnerable. La AR es una enfermedad autoinmune crónica, multisistémica que puede ser debilitante y reduce la esperanza de vida. El sello distintivo de la enfermedad es una artritis inflamatoria persistente, por lo general de las articulaciones periféricas, que puede conducir a la destrucción del cartílago, la erosión del hueso y la pérdida de integridad articular. Además de los signos articulares de la AR, los pacientes presentan frecuentemente manifestaciones extraarticulares de la enfermedad, que incluyen nódulos subcutáneos reumatoides, debilidad muscular y atrofia, vasculitis y pleuritis. El curso de la AR es muy variable, ya que algunos pacientes experimentan su potencial destructivo y muestran una acusada incapacidad funcional, mientras que otros experimentan una enfermedad leve de corta duración.
Un examen microscópico del revestimiento sinovial de las articulaciones de pacientes con AR revela un estado inflamatorio agudo y crónico que se caracteriza por la infiltración con predominio de linfocitos T CD4+. Se ha afirmado que el agotamiento de los linfocitos T mediante el drenaje del conducto torácico, la irradiación linfoide o los fármacos citotóxicos son eficaces en el tratamiento de la AR. Los linfocitos T producen un número de citocinas que favorecen la proliferación de linfocitos B y la diferenciación en células formadoras de anticuerpos/ presentadoras de antígenos. Un signo común, aunque no es específico, de dos tercios de los pacientes es la presencia de factores reumatoides, autoanticuerpos dirigidos contra la IgG. La producción de factores reumatoides puede conducir a la formación de complejos inmunes, la activación resultante del complemento y la intensificación del proceso inflamatorio (Lipsky, 1998) . En la AR, el mecanismo de la enfermedad parece implicar la activación de los linfocitos T a través de antígenos todavía desconocidos. Estos antígenos pueden ser agentes infecciosos u otras moléculas endógenas que ya no son reconocidas como automoléculas. Los linfocitos T CD4+ activados con antígenos estimulan los monocitos, macrófagos y fibroblastos sinoviales para producir las citocinas IL-1, IL-6 y TNF-α. Estas citocinas proinflamatorias se consideran responsables de la persistencia del proceso inflamatorio en la articulación, incluyendo la destrucción del cartílago y la erosión del hueso periarticular. La inhibición de TNF-α e IL-1, ha demostrado que reduce la inflamación y retarda la destrucción de la articulación (Keystone y Strond, 2005) .
La IL-1 es una citocina proinflamatoria secretada por una variedad de diferentes tipos de células, que incluyen los monocitos y los macrófagos. La familia génica de la IL-1 comprende las citocinas agonistas IL 1 alfa (IL-1α e IL-1β) , y el antagonista natural del receptor (IL-1Ra) . IL-1α e IL-1β se producen como precursores. ProIL-1α es funcionalmente activa y debido a la falta del péptido líder, permanece en el citoplasma, mientras que proIL-1β es inactiva y se secreta y se activa después de la escisión con una proteasa intracelular específica. En la enfermedad, IL-1β se encuentra en la circulación mientras que IL-1α rara vez se detecta; se libera solo en estados de enfermedad grave, muy probablemente como consecuencia de la muerte celular (Dinarello, 1996) . Cuando se libera como parte de una reacción inflamatoria, IL-1β produce una gama de efectos biológicos, principalmente a través de la inducción de otros mediadores inflamatorios, tales como corticotropina, factor plaquetario 4, prostaglandina E2 (PGE-2) , IL-6 e IL-8. La IL-1β induce efectos inflamatorios locales y sistémicos a través de la activación del receptor de IL-1 que se encuentra en casi todos los tipos de células nucleadas (Dinarello, 2005) . La IL-1β se une al receptor de IL-1 (IL-1R) , induciendo un cambio conformacional que permite la unión de la proteína accesoria al complejo IL-1β/IL-1R. Por lo tanto, la formación de este complejo induce la señalización intracelular a través de IL-1R (Dinarello, 1996) .
La IL-1 está presente en el tejido sinovial y en los fluidos de pacientes con artritis reumatoide y estimula la producción de mediadores tales como prostaglandina E (2) , óxido nítrico, citocinas, quimiocinas y moléculas de adhesión que están implicadas en la inflamación articular. Además, la IL-1 estimula la síntesis y la actividad de metaloproteinasas de la matriz y otras enzimas implicadas en la destrucción del cartílago en la artritis reumatoide y la osteoartritis. Los efectos de la IL-1 se inhiben in vitro e in vivo mediante inhibidores naturales, tales como el antagonista del receptor de IL-1 (IL-1Ra) y receptores solubles. IL-1Ra pertenece a la familia IL-1 de las citocinas y se une a receptores de IL-1 pero no induce ninguna respuesta intracelular. IL-1Ra inhibe el efecto de la IL-1 bloqueando su interacción con receptores de la superficie celular. Los inhibidores de IL-1 se han utilizado en modelos experimentales de artritis reumatoide que apoyan el papel de la IL-1 en la patogénesis de la enfermedad.
Anakinra es una forma recombinante del bloqueador natural de IL-1, IL-1Ra. Anakinra se ha utilizado de forma extensa para la indicación aprobada de la AR, y también ha mostrado una actividad clínica significativa sobre la artritis idiopática juvenil sistémica (AIJs) y, en menor grado, sobre los otros subtipos de artritis idiopática juvenil (AIJ) .
En la bibliografía reciente también se ha mostrado la actividad de anakinra sobre otros trastornos sistémicos mediados con la IL-1 (enfermedad multisistémica inflamatoria neonatal [NOMID], enfermedad de Muckle-Wells y síndrome familiar autoinflamatorio por frío) , así como la osteoartritis de rodilla (Goupille, et al., 2003) . Sin embargo, la dosificación frecuente de medicamentos inyectables, como anakinra, es en general no deseable y puede dar lugar a problemas con la conformidad del paciente, disminuyendo de este modo aún más la eficacia de esta modalidad de tratamiento o limitando su conveniencia. Por lo tanto, sigue existiendo una necesidad de medios eficaces para tratar la AR, en particular composiciones y métodos de tratamiento que no requieran inyecciones frecuentes (por ejemplo, diariamente) .
Los actuales fármacos antirreumáticos modificadores de la enfermedad (FARMEs) son eficaces para controlar los síntomas inflamatorios. Los modificadores de la respuesta biológica, (BRMs) más nuevos ofrecen mejoras en el control de la enfermedad, pero con riesgos de seguridad adicionales. Estos riesgos aumentan con el uso prolongado, y algunos de los BRMs pierden su eficacia con el tiempo. En una evaluación reciente de 500 pacientes con AR realizada por la “Arthritis Foundation”, se encontró que dos tercios de los pacientes con AR siguen sufriendo dolor diario, rigidez o cansancio a pesar del tratamiento con FARMEs o BRMs (Gruver, 2004) . Sigue existiendo una necesidad insatisfecha de terapias para la AR que sean seguras y proporcionen un control a largo plazo de la enfermedad.
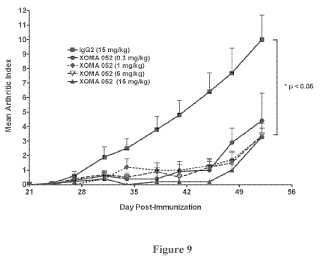
La presente descripción proporciona composiciones y métodos para el tratamiento de la artritis reumatoide. Los métodos descritos en este documento comprenden, por ejemplo, la administración de un anticuerpo anti-IL-1β de alta afinidad o un fragmento del mismo con regímenes de dosificación tal y como se describen en esta memoria. Los métodos que se dirigen directamente al ligando de IL-1β con un anticuerpo, particularmente anticuerpos que muestran una afinidad elevada, pueden proporcionar ventajas sobre otros posibles métodos de tratamiento, tales como antagonistas del receptor de IL-1β (por ejemplo, Anakinra) . Un desafío para los agentes terapéuticos que se basan en antagonistas del receptor de IL-1 es la necesidad de que tales agentes terapéuticos ocupen un gran número de receptores, lo que es una tarea inmensa, ya que estos receptores se expresan ampliamente en todas las células excepto los glóbulos rojos (Dinarello, Curr. Opin. Pharmacol. 4:378-385, 2004) . En la mayoría... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende un anticuerpo anti-IL-1β o un fragmento del mismo, para uso en el tratamiento de la artritis reumatoide, en donde el anticuerpo o el fragmento de anticuerpo se une a IL-1β humana con una constante de disociación de 1 pM o menor, en donde el anticuerpo o el fragmento del mismo compite en la unión con un anticuerpo que tiene la región variable de la cadena ligera de SEQ ID NO: 5 y la región variable de la cadena pesada de SEQ ID NO: 6, en donde la administración de una dosis inicial del anticuerpo o del fragmento de anticuerpo está seguida por la administración de una o varias dosis posteriores, en donde la dosis inicial y cada una de las dosis posteriores se administran en un intervalo desde una vez a la semana hasta una vez cada seis meses y en donde el anticuerpo o el fragmento de anticuerpo se va a administrar con una dosis de al menos 0, 01 mg/kg a 1 mg/kg de anticuerpo o de fragmento de anticuerpo.
2. Composición farmacéutica para el uso de acuerdo con la reivindicación 1, en donde el anticuerpo o el fragmento se va a administrar como una dosis fija, independientemente de una relación entre dosis y peso del individuo.
3. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-2, en donde el anticuerpo o el fragmento anti-IL-1β se va a administrar mediante inyección subcutánea, intravenosa o intramuscular.
4. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-3, en donde la administración de dicha dosis o varias dosis posteriores se efectúa en una cantidad de dosis que es la misma, inferior o superior a la dosis inicial.
5. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-4, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir una mejora en uno o varios de los criterios esenciales de respuesta ACR.
6. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-5, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir al menos un 20% de mejora en la puntuación de ACR 50.
7. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 5-6, en donde la mejora es de 3 meses o más.
8. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-7, en donde la dosis de anticuerpo o de fragmento es suficiente para conseguir una disminución de la infiltración inflamatoria.
9. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-7, en donde la dosis de anticuerpo o de fragmento es suficiente para conseguir una disminución de la pérdida de cartílago.
10. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-7, en donde la dosis de anticuerpo o de fragmento es suficiente para conseguir una disminución de la resorción ósea.
11. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-7, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir una mejora en la puntuación radiográfica.
12. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-11, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir al menos una disminución del 20% en los niveles de CRP.
13. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-11, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir al menos una disminución del 20% en ESR.
14. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-11, en donde la dosis del anticuerpo o del fragmento es suficiente para conseguir al menos una disminución del 20% en CRP y al menos una disminución del 20% en ESR.
15. Composición farmacéutica para el uso de acuerdo con las reivindicaciones 1-14, en donde dicho método está asociado con al menos un método de tratamiento adicional, comprendiendo dicho método de tratamiento adicional administrar al menos una composición farmacéutica que comprende un agente activo distinto de un anticuerpo o un fragmento de IL-1β.
16. Composición farmacéutica para el uso de acuerdo con cualquiera de las reivindicaciones 1-15, en donde el anticuerpo o el fragmento del mismo comprende una región variable de la cadena ligera de SEQ ID NO: 5 y la región variable de la cadena pesada de SEQ ID NO: 6.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Combinación de anticuerpo anti-CD20 e inhibidor selectivo de PI3 quinasa, del 15 de Julio de 2020, de TG Therapeutics Inc: Un metodo in vitro para inhibir la proliferacion de una poblacion celular que comprende poner en contacto la poblacion con una combinacion que comprende […]