Anticuerpos para el receptor PD-1 humano de muerte programada.
Un anticuerpo o fragmento de anticuerpo que se une a PD-1 humano,
que comprende:
Nos. de SEQ ID de CDRs de cadena ligera: 15, 16 y 17 y Nos. de SEQ ID de CDRs: 18, 19 y 20;
en el que dicho anticuerpo o fragmento de anticuerpo bloquea la unión de PD-L1 humano y PD-L2 humano a PD-1 humano.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/007463.
Solicitante: Merck Sharp & Dohme B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: Waarderweg 39 2031 BN Haarlem PAISES BAJOS.
Inventor/es: CARVEN,GREGORY JOHN, VAN EENENNAAM,HANS, DULOS,GRADUS JOHANNES.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
PDF original: ES-2437327_T3.pdf
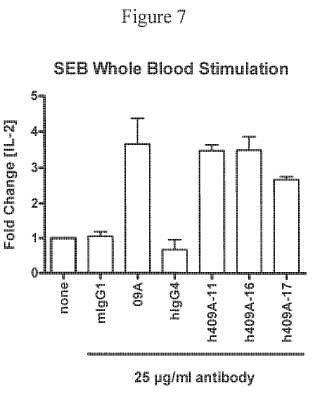
Fragmento de la descripción:
Anticuerpos para el receptor PD-1 humano de muerte programada
Antecedentes de la invención El receptor 1 de muerte programada (PD-1) es un receptor inmunoinhibidor que se expresa principalmente sobre células T y B activadas. Se ha comprobado que la interacción con sus ligandos atenúa las respuestas de células T tanto in vivo como in vitro. Se ha comprobado que el bloqueo de la interacción entre PD-1 y uno de sus ligandos, PD-L1, mejora la inmunidad de las células-CD8+ T específicas de tumores y puede, por tanto, ser útil en la eliminación de células tumorales por medio del sistema inmunológico.
PD-1 (codificado por el gen Pdcd1) es un miembro de la superfamilia de inmunoglobulinas relacionado con CD28, y CTLA-4. Se ha comprobado que PD-1 regula negativamente la señalización del receptor de antígeno tras el engranaje de sus ligandos (PD-L1 y/o PD-L2) . Se ha resuelto la estructura de PD-1 murino así como también la estructura de co-cristal de PD-1 de ratón con PD-L1 humano (Zhang, X. y col., Immunity 20:337-347 (2004) ; Lin y col., Proc. Natl. Acad. Sci. USA. 105:3011-6 (2008) ) . PD-1 los miembros de familia similares son glucoproteínas de transmembrana de tipo I que contienen un dominio de tipo Ig variable (tipo V) responsable de la unión de ligandos y una cola citoplasmática que es responsable de la unión de moléculas de señalización. La cola citoplasmática de PD1 contiene dos motivos de señalización basados en tirosina, un ITIM (motivo de inhibición basado en tirosina de inmunoreceptor) y un ITSM (motivo de cambio basado en tirosina de inmunoreceptor) .
Tras la estimulación de células T, PD-1 engancha la tirosina fosfatasa SHP-2 al motivo ITSM dentro de su cola citoplasmática, conduciendo a la desfosforilación de las moléculas efectoras tales como CD3 zeta, PKC teta y ZAP70, que se ven implicadas en la cascada de señalización de células CD3 T. El mecanismo por medio del cual PD-1 modula a la baja las respuestas de las células T es similar, pero distinto del correspondiente a CTLA-4, ya que ambas moléculas regulan un conjunto de solapamiento de proteínas de señalización (Parr y et col., Mol. Cell Biol. 25: 9543-9553) . Bennett y colaboradores han mostrado que la inhibición mediada por PD-1 de la señalización de células T únicamente es eficaz cuando las señales tanto de activación como de inhibición se producen sobre la misma superficie, lo que indica que el mecanismo de señalización de PD-1 se determina según un patrón de espaciotiempo (Bennett F. y col., J Immunol. 170:711-8 (2003) ) .
Se ha mostrado que PD-1 se expresa sobre linfocitos activados (células T CD4+ y CD8+ periféricas, células B y monocitos) y también se ha mostrado la expresión durante el desarrollo tímico sobre células T CD4-CD8- (doble negativo) así como también en células NK-T.
Los ligandos para PD-1 (PD-L1 y PD-L2) se expresan de forma constitutiva o se pueden inducir en una variedad de tipos celulares, incluyendo los tejidos no hematopoyéticos así como también varios tipos de tumores. PD-L1 se expresa sobre células B, T, mieloides y dendríticas (DCs) , pero también sobre células periféricas, tales como células endoteliales microvasculares y órganos no linfoides tales como corazón, pulmón, etc. Por el contrario, PD-L2 únicamente se encuentra en macrófagos y DCs. El patrón de expresión de los ligandos PD-1 sugiere un papel de PD-1 en el mantenimiento de la tolerancia periférica y puede servir para regular las respuestas auto-reactivas de células T y B en la periferia. Ambos ligandos son receptores de transmembrana de tipo I que contienen por un lado dominios de tipo IgV y por otro, dominios de tipo IgC en la región extracelular. Ambos ligandos contienen regiones citoplasmáticas sin motivos de señalización conocidos.
Hasta la fecha, numerosos estudios han mostrado que la interacción de PD-1 con sus ligandos conduce a la inhibición de la proliferación de linfocitos in vitro e in vivo. Se ha visto que la alteración de la interacción PD-1/PD-L1 aumenta la proliferación de células T y la producción de citoquinas y la progresión de bloques del ciclo celular. El análisis inicial de ratones Pdcd1-/-no identifica ningún fenotipo inmunológico drástico. No obstante, los ratones de edad avanzada desarrollaron enfermedades autoinmunológicas espontáneas que difirieron de acuerdo con la cepa sobre la cual se produjo el retro-cruzamiento de la deficiencia de Pdcd1. Estos incluyen artritis proliferativa de tipo lupus (C57BL/6) (Nishimura H. y col., Int. Immunol. 10: 1563-1572 (1998) ) , cardiomiopatía mortal (BALB/c) (Nishimura H. y col., Science 291: 319-322 (2001) ) y diabetes de tipo I (NOD) (Wang J. y col., Proc. Natl. Acad. Sci.
U.S.A. 102: 11823-11828 (2005) ) . En general, el análisis de animales knockout ha conducido a la comprensión de que PD-1 funciona principalmente para inducir y regular la tolerancia periférica. De este modo, el bloqueo terapéutico del mecanismo PD-1 puede resultar útil para solucionar la tolerancia inmunológica. Dicho bloqueo selectivo puede ser de utilidad en el tratamiento de cáncer o infección así como en el refuerzo inmunitario durante la vacunación (bien profiláctico o terapéutico) .
El papel de PD-1 en el cáncer se establece en la bibliografía. Se sabe que el microentorno tumoral puede proteger células tumorales frente al destrucción imunológica eficaz. Recientemente, se ha visto que PD-L1 se expresa en un número de tumores humanos y de ratón (y se puede inducir por medio de IFN gamma sobre la mayoría de estirpes celulares tumorales PD-L1 negativas) y se postula que interviene como mediador en la evasión inmunológica (Iwai Y. y col., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002) ; Strome S.E. y col., Cancer Res., 63: 6501-6505 (2003) .
En seres humanos, se ha encontrado la expresión de PD-1 (en tumores que se infiltran en linfocitos) y/o PD-L1 (en células tumorales) en un número de biopsias primarias evaluadas por medio de inmunohistoquímica. Dichos tejidos incluyen cánceres de pulmón, hígado, ovario, cuello uterino, piel, colon, glioma, vejiga, mama, riñón, esófago, estómago, células escamosas orales, células uroteliales, y páncreas así como también tumores en el cerebro y cuello (Brown J.A. y col., J. Immnol. 170: 1257-1266 (2003) ; Dong H. y col., Nat. Med. 8: 793-800 (2002) ; Wintterle y col., Cancer Res. 63: 7462-7467 (2003) ; Strome S.E. y col., Cancer Res., 63: 6501-6505 (2003) ; Thompson R.H. y col., Cancer Res 66: 3381-5 (2006) ; Thompson y col., Clin. Cancer Res., 13: 1757-61 (2007) ; Nomi T. y col., Clin. Cancer Res. 13: 2151-7 (2007) ) . De manera más marcada, se ha correlacionado la expresión de PD-ligando sobre células tumorales con una prognosis pobre de pacientes con cáncer a lo largo de múltiples tipos de tumores (revisado en Okazaki y Honjo, Int. Immunol. 19: 813-824 (2007) ) .
El bloqueo de la interacción PD-1/PD-L1 podría conducir a un inmunidad mejorada de células T específicas tumorales y por tanto podría ser útil para la eliminación de células tumorales por parte del sistema inmunológico. Para abordar esta cuestión, se han llevado a cabo numerosos estudios. En un modelo murino de cáncer de páncreas agresivo, T. Nomi y col. (Clin. Cancer Res. 13: 2151-2157 (2007) ) demostraron la eficacia terapéutica del bloqueo PD-1/PD-L1. La administración de anticuerpo dirigido a PD-1 o PD-L1 inhibió significativamente la proliferación del tumor. El bloqueo de anticuerpo favoreció la infiltración de células CD8+ T reactivas tumorales en el interior del tumor, dando como resultado la sobre-regulación de los efectores anti-tumorales incluyendo IFN gamma, grancima B y perforina. De manera adicional, los autores mostraron que el bloqueo PD-1 se puede combinar de manera eficaz con quimioterapia para lograr un efecto sinérgico. En otro estudio, por medio del uso de un modelo de carcinoma celular escamoso en ratones, el bloqueo de anticuerpos de PD-1 o PD-L1 inhibió significativamente la proliferación tumoral (Tsushima F. y col., Oral Oncol. 42: 268-274 (2006) ) .
En otros estudios, la transfección de una estirpe de mastocitoma murino con PD-L1 condujo a una menor lisis de las células tumorales cuando se sometieron a co-cultivo con un clon de CTL específico tumoral. Se restituyó la lisis cuando se añadió anti-PD-L1 mAb (Iwai Y. y col., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002) ) . In vivo, se ha mostrado que el bloqueo de la interacción PD1/PD-L1 aumentaba la eficacia de la terapia de transferencia de células T adoptivas en un modelo tumoral de ratón (Strome S.E. y col., Cancer Res. 63: 6501-6505 (2003) ) . Otras evidencias del papel de PD-1 en el tratamiento del cáncer proceden de experimentos llevados a cabo con ratones knockout PD-1. Las... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo o fragmento de anticuerpo que se une a PD-1 humano, que comprende:
Nos. de SEQ ID de CDRs de cadena ligera: 15, 16 y 17 y Nos. de SEQ ID de CDRs: 18, 19 y 20; en el que dicho anticuerpo o fragmento de anticuerpo bloquea la unión de PD-L1 humano y PD-L2 humano a PD-1 humano.
2. El anticuerpo o fragmento de anticuerpo de la reivindicación 1, en el que dicho anticuerpo o fragmento de anticuerpo bloquea la unión de PD-L1 humano y/o PD-L2 humano a PD-1 humano, con un IC50 de aproximadamente 1 nM o menor.
3. El anticuerpo o fragmento de anticuerpo de la reivindicación 1 ó 2, que comprende:
a. una región variable de cadena pesada que comprende una secuencia de amino ácidos seleccionada entre el grupo que consiste en:
i. Nº. de SEQ ID: 7 o una de sus variantes, en la que dicha variante comprende una, dos o tres sustituciones de amino ácido modificadas de forma conservativa;
ii. residuos de amino ácido de 20 a 139 de Nº. de SEQ ID: 30 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
iii. una secuencia de amino ácido que tiene al menos 90 % de homología con residuos de amino ácido 20 a 139 de Nº. de SEQ ID: 30;
y que además comprende b. una región variable de cadena ligera que comprende una secuencia de amino ácido seleccionada entre el grupo que consiste en:
i. Nº. de SEQ ID: 8 o una de sus variantes, en la que dicha variante comprende una, dos o tres sustituciones de amino ácido modificadas de forma conservativa;
ii. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 32 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
iii. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 33 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
iv. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 34 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
v. una secuencia de amino ácido que tiene al menos 90 % de homología con residuos de amino ácido 20 a 130 de Nº. de SEQ ID: 32, 33 ó 34.
4. El anticuerpo de la reivindicación 1 ó 2, que comprende:
a. una cadena pesada que comprende una secuencia de amino ácido seleccionada entre el grupo que consiste en:
i. residuos de amino ácido de 20 a 466 de Nº. de SEQ ID: 31 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
ii. residuos de amino ácido de 20 a 469 de Nº. de SEQ ID: 35 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa;
y
b. una cadena ligera que comprende una secuencia de amino ácidos seleccionada entre el grupo que consiste en:
i. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 36 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa;
ii. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 37 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa; y
iii. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 38 o una de sus variantes, en los que dicha variante comprende una, dos o tres sustituciones de amino ácido modificado de forma conservativa.
5. Un anticuerpo o fragmento de anticuerpo que se une a PD-1 humano, que comprende
a. una región variable de cadena pesada que comprende residuos de amino ácido de 20 a 139 de Nº. de SEQ ID: 30, y
b. una región variable de cadena ligera que comprende una secuencia de amino ácidos seleccionada entre el
grupo que consiste en:
i. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 32;
ii. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 33; y
iii. residuos de amino ácido de 20 a 130 de Nº. de SEQ ID: 34.
6. Un anticuerpo o fragmento de anticuerpo que se une a PD-1 humano, que comprende
a. una cadena pesada que comprende residuos de amino ácido de 20 a 466 de NO de ID de SEQ: 31, y
b. una cadena ligera que comprende una secuencia de amino ácidos seleccionada entre el grupo que consiste en:
i. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 36;
ii. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 37; y
iii. residuos de amino ácido de 20 a 237 de Nº. de SEQ ID: 38.
7. El anticuerpo de la reivindicación 6, en el que la cadena pesada comprende residuos de amino ácido de 20 a 466 de Nº. de SEQ ID: 31 y la cadena ligera comprende residuos de amino ácido 20 a 237 de Nº. de SEQ ID: 36.
8. El anticuerpo de una cualquiera de las reivindicaciones 1 a 3 y 5, que además comprende una región constante de cadena pesada que comprende una región constante de cadena pesada humana y4 o y1.
9. El anticuerpo o fragmento de anticuerpo de cualquiera de las reivindicaciones anteriores, en el que el anticuerpo o fragmento de anticuerpo:
a. se une a PD-1 humano con un KD de aproximadamente 100 pM o menor;
b. se une a PD-1 humano con un KD de aproximadamente 30 pM o menor;
c. se une a PD-1 humano con aproximadamente el mismo KD que un anticuerpo que tiene una cadena pesada que comprende la secuencia de amino ácidos de Nº. de SEQ ID: 31 y una cadena ligera que comprende la secuencia de amino ácidos de Nº. de SEQ ID: 32;
d. se une a PD-1 humano con aproximadamente el mismo KD que un anticuerpo que tiene una cadena pesada que comprende la secuencia de amino ácidos de Nº. de SEQ ID: 31 y una cadena ligera que comprende la secuencia de amino ácidos de Nº. de SEQ ID: 33;
e. se une a PD-1 humano con un kasoc de aproximadamente 7, 5 x 105 I/M·s o más rápido;
f. se une a PD-1 humano con un kasoc de aproximadamente 1 x 106 I/M·s o más rápido;
g. se une a PD-1 humano con un kdisoc de aproximadamente 2 x 10-5 I/s o más lento;
h. se une a PD-1 humano con un kdisoc de aproximadamente 2, 7 x 10-5 I/s o más lento;
i. se une a PD-1 humano con un kdisoc de aproximadamente 3 x 10-5 I/s o más lento; o
j. bloquea la unión de PD-L1 humano y/o PD-L2 humano a PD-1 humano con un IC50 de aproximadamente 1nM o menor.
10. El anticuerpo o fragmento de anticuerpo de cualquiera de las reivindicaciones anteriores, en el que el anticuerpo
o fragmento de anticuerpo es:
a. un anticuerpo híbrido o uno de sus fragmentos;
b. un anticuerpo humano o uno de sus fragmentos; o
c. un anticuerpo humanizado o uno de sus fragmentos.
11. El fragmento de anticuerpo de cualquiera de las reivindicaciones anteriores, en el que el fragmento de anticuerpo está seleccionado entre el grupo que consiste en Fab, Fab´, Fab´-SH, Fv, scFv, F (aV) 2 y un diacuerpo.
12. El anticuerpo o fragmento de anticuerpo de cualquiera de las reivindicaciones anteriores, en el que el anticuerpo
o fragmento de anticuerpo aumenta la activación de las células T.
13. Un polinucleótido aislado que codifica el anticuerpo o fragmento de anticuerpo de una cualquiera de las reivindicaciones 1 a 12.
14. El polinucleótido aislado de la reivindicación 13, en el que el anticuerpo comprende una cadena pesada que comprende residuos de amino ácido 20 a 466 de Nº. de SEQ ID: 31 y una cadena ligera que comprende residuos de amino ácido d.
2. 237 de Nº. de SEQ ID: 36.
15. El polinucleótido aislado de la reivindicación 13, que comprende Nº. de SEQ ID: 23 y Nº. de SEQ ID: 27 o Nº. de SEQ ID: 22 y Nº. de SEQ ID: 27.
16. Un vector de expresión que comprende el polinucleótido aislado de una cualquiera de las reivindicaciones 13 a
15.
17. Una célula hospedadora que comprende el vector de expresión de la reivindicación 16.
18. Un procedimiento de producción de un anticuerpo o fragmento de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 1 a 12 que comprende:
a. someter a cultivo la célula hospedadora de la reivindicación 17 en un medio de cultivo en condiciones en las que se expresa la secuencia de ácido nucleico, produciendo de este modo polipéptidos que comprenden 10 las regiones variables de cadena ligera y pesada; y
b. recuperar los polipéptidos de la célula hospedadora o del medio de cultivo.
19. Una composición que comprende el anticuerpo o fragmento de anticuerpo de una cualquiera de las reivindicaciones 1 a 12 o que se puede obtener por medio del procedimiento de la reivindicación 18 en combinación 15 con un vehículo o diluyente farmacéuticamente aceptable.
20. El anticuerpo o fragmento de anticuerpo de una cualquiera de las reivindicaciones 1 a 12, o que se puede obtener por medio del procedimiento de la reivindicación 18 para su uso en el tratamiento de cáncer o una infección o enfermedad infecciosa. 20
21. El anticuerpo o fragmento de anticuerpo de las reivindicaciones 1 a 12, para su uso en un procedimiento para el tratamiento de cáncer.
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Terapias de combinación para el cáncer, del 22 de Julio de 2020, de MERCK SHARP & DOHME CORP: Una combinación que comprende un anticuerpo anti-PD-1 humano y un Compuesto A y un Compuesto B, en donde: el anticuerpo anti-PD-1 humano comprende […]