Anticuerpos anti-TNF y metotrexato en el tratamiento concomitante de enfermedades autoinmunes.
Uso de un anticuerpo anti-factor de necrosis tumoral humano, o un fragmento del mismo,
que se une específicamente a factor de necrosis tumoral, para la preparación de un medicamento para el tratamiento de artritis reumatoide, artritis crónica juvenil, espondilitis anquilosante, artritis psoriática o enfermedad de Crohn, en donde el anticuerpo anti-factor de necrosis tumoral está indicado para su administración en dosis únicas o múltiples, como terapia concomitante con terapia metotrexato, y el metotrexato está indicado para su administración en dosis múltiples.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05076131.
Solicitante: THE KENNEDY INSTITUTE OF RHEUMATOLOGY.
Nacionalidad solicitante: Reino Unido.
Dirección: 1 ASPENLEA ROAD HAMMERSMITH, LONDON W6 8LH REINO UNIDO.
Inventor/es: MAINI, RAVINDER, NATH, Feldman,Marc.
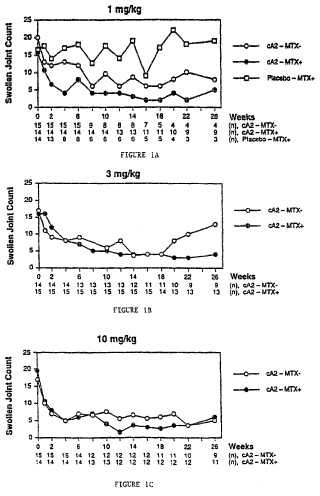
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/505 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirimidinas; Pirimidinas hidrogenadas, p. ej. trimetoprima.
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/17 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P37/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
PDF original: ES-2378446_T3.pdf
Fragmento de la descripción:
Anticuerpos anti-TNF y metotrexato en el tratamiento concomitante de enfermedades autoinmunes.
Antecedentes de la invención
Los monocitos y macrófagos secretan las citocinas conocidas como factor de necrosis tumoral alfa (TNFa) y factor de necrosis tumoral beta (TNFº) en respuesta a endotoxinas u otros estímulos. El TNFa es un homotrímero soluble de subunidades proteicas de 17 kDa (Smith et al., J. Biol. Chem. 262: 6951-6954 (1987) ) . Existe también una forma precursora de TNF de 26 kDa unida a membrana (Kriegler et al., Cell 53: 45-53 (1988) ) . Para revisiones del TNF, véanse Beutler et al., Nature 320: 584 (1986) ; Old, Science 230: 630 (1986) ; y Le et al., Lab. Invest. 56: 234 (1987) .
Células distintas de monocitos o macrófagos pueden producir también TNFa. Por ejemplo, las estirpes celulares de tumor no monocítico humano producen factor de necrosis tumoral (TNF) (Rubin et al., J. Exp. Med. 164: 1350 (1986) ; Spriggs et al., Proc. Natl. Acad. Sci. USA 84: 6563 (1987) ) . Los linfocitos T de sangre periférica CD4+ y CD8+ y algunas estirpes de células T y B cultivadas (Cuturi et al., J. Exp. Med. 165: 1581 (1987) ; Sung et al., J. Exp. Med. 168: 1539 (1988) ; Turner et al., Eur. J. Immunol. 17: 1807-1814 (1987) ) producen también TNFa.
El TNF causa acciones proinflamatorias que dan como resultado lesión de tejidos, tales como degradación de cartílago y hueso e inducción de moléculas de adhesión, induciendo actividad procoagulante sobre células endoteliales vasculares (Pober et al., J. Immunol. 136: 1680 (1986) ) , aumentando la adherencia de neutrófilos y linfocitos (Pober et al., J. Immunol. 138: 3319 (1987) ) y estimulando la liberación de factor activador de plaquetas de macrófagos, neutrófilos y células endoteliales vasculares (Camussi et al., J. Exp. Med. 166: 1390 (1987) ) .
Evidencias recientes asocian el TNF con infecciones (Cerami et al., Immunol. Today 9: 28 (1988) , trastornos inmunes, patologías neoplásicas (Oliff et al., Cell 50: 555 (1987) ) , patologías autoinmunes y patologías de injerto frente a hospedador (Piguet et al., J. Exp. Med. 166: 1280 (1987) ) . La asociación del TNF con cáncer y patologías infecciosas está a menudo relacionada con un estado catabólico del hospedador. Los pacientes de cáncer sufren pérdida de peso, asociada habitualmente a la anorexia.
El agotamiento extendido que está asociado al cáncer y a otras enfermedades es conocido como "caquexia" (Kern et al., J. Parent. Enter. Nutr. 12: 286-298 (1988) ) . La caquexia incluye pérdida progresiva de peso, anorexia y erosión persistente de la masa corporal en respuesta a un crecimiento maligno. El trastorno fisiológico fundamental puede relacionarse con una reducción de la ingesta de alimento respecto al gasto de energía. El estado caquéctico causa la mayoría de la morbilidad y mortalidad por cáncer. El TNF puede mediar la caquexia en cáncer, patologías infecciosas y otros estados catabólicos.
El TNF desempeña también un papel fundamental en la sepsis gram-negativa y en el shock endotóxico (Michie et al., Br. J. Surg. 76: 670-671 (1989) ; Debets et al., Second Vienna Shock Forum, pág. 463-466 (1989) ; Simpson et al., Crit. Care Clin. 5: 27-47 (1989) ) , incluyendo fiebre, malestar, anorexia y caquexia. La endotoxina activa fuertemente la producción de monocito/macrófago y la secreción de TNF y otras citocinas (Kornbluth et al., J. Immunol. 137: 2585-2591 (1986) ) . El TNF y otras citocinas derivadas de monocitos median las respuestas metabólicas y neurohormonales ante la endotoxina (Michie et al., New Engl. J. Med. 318; 1481-1486 (1988) ) . La administración de endotoxina a voluntarios humanos produce una enfermedad aguda con síntomas similares a la gripe, incluyendo fiebre, taquicardia, tasa metabólica aumentada y liberación de hormona del estrés (Revhaug et al., Arch. Surg. 123: 162-170 (1988) ) . El TNF en circulación aumenta en pacientes que sufren sepsis gram-negativa (Waage et al., Lancet
1: 355-357 (1987) ; Hammerle et al., Second Vienna Shock Forum, pág. 715-718 (1989) ; Debets et al., Crit. Care Med. 17: 489-497 (1989) ; Calandra et al., J. Infect. Dis. 161: 982-987 (1990) ) .
Por tanto, el TNFa se ha implicado en enfermedades inflamatorias, enfermedades autoinmunes, infecciones virales, bacterianas y parasíticas, malignidades y/o enfermedades neurodegenerativas, y es una diana útil para terapia biológica específica en enfermedades tales como artritis reumatoide y enfermedad de Crohn. Se han reseñado efectos beneficiosos en ensayos de etiqueta abierta con un anticuerpo monoclonal quimérico ante TNFa (cA2) , con supresión de la inflamación (Elliott et al., Arthritis Rheum. 36: 1681-1690 (1993) ; Elliott et al., Lancet 344: 1125-1127 (1994) ) . Véase también Van Dullemen et al., Gastroenterology 109: 129-135 (1995) . Se han reseñado también resultados beneficiosos en un ensayo aleatorizado doble ciego controlado por placebo con cA2, con supresión de la inflamación (Elliott et al., Lancet 344: 1105-1110 (1994) ) . WO95/09652 describe un método de tratamiento de enfermedades autoinmunes o inflamatorias en un mamífero usando una combinación de un agente que inhibe células T CD4+ y un antagonista del factor de necrosis tumoral. Se puede administrar el agente anti-reumático metotrexato conjuntamente con el agente que inhibe células T CD4+ y/o el antagonista de TNF. El antagonista de TNF puede ser, entre otros, un anticuerpo anti-TNF. No se describe ni sugiere el uso de un anticuerpo anti-factor de necrosis tumoral en el tratamiento de artritis reumatoide, artritis crónica juvenil, espondilitis anquilosante, artritis psoriática o enfermedad de Crohn en terapia concomitante con terapia metotrexato.
Maini et al. (Instituto Kennedy de Reumatología, 29º Informe Científico, 1995) informa de un estudio que examina la seguridad y eficacia, en la artritis reumatoide, de la dosificación repetida con el anticuerpo monoclonal anti-TNF cA2 en combinación con, o comparado con, el fármaco anti-reumático por excelencia, el metotrexato. Este informe no proporciona los resultados del estudio ni describe efecto terapéutico alguno. Tampoco sugiere que el anticuerpo antifactor de necrosis tumoral se use en terapia concomitante con terapia metotrexato.
El documento WO 94/08619 se refiere a una combinación de anticuerpo anti-CD4 y un anticuerpo anti-factor de necrosis tumoral para tratar enfermedades autoinmunes o inflamatorias en un mamífero. Se sugiere que podrían administrarse otros fármacos anti-inflamatorios, tales como metotrexato o ciclosporina-A, conjuntamente con el anticuerpo anti-CD4 o el anticuerpo anti-TNF. WO94/08619 no describe ni sugiere el uso de un anticuerpo anti-factor de necrosis tumoral en el tratamiento de artritis reumatoide, artritis crónica juvenil, espondilitis anquilosante, artritis psoriática o enfermedad de Crohn en terapia concomitante con terapia metotrexato.
Bologna et al., La Presse medicale, Vol 25, nº 19, Junio 1996, informa sobre usos de regímenes de combinación para la artritis reumatoide. Se hace referencia a estudios llevados a cabo usando diferentes combinaciones de DMARDs tales como azatioprina, hidroxicloroquina, metotrexato, salazopirina. Los autores concluyen que no ha quedado demostrado que estas combinaciones proporcionen algún beneficio apreciable a nivel clínico, y añaden que todavía quedan por estudiar muchas posibles combinaciones, por ejemplo la combinación de metotrexato con otros fármacos objetivo tales como los anticuerpos monoclonales anti-TNFa y anti-CD4 o el receptor TNFa soluble. No hay sugerencia sobre el uso de anticuerpos anti-TNFa en terapia concomitante con terapia metotrexato en el tratamiento de la artritis reumatoide.
Fenner et al., Arthritis & Rheumatism, Vol. 38, nº 9 (suppl.) 1995, pág. S266, Abstract 679, describen una monoterapia secuencial de la artritis reumatoide en estudios clínicos. Los pacientes reciben primero metotrexato, que se retira antes de la administración de una molécula de fusión receptor de TNF-IgG. Seguidamente, se reintroduce el metotrexato. No se describe el uso de anticuerpos anti-TNF, ni tampoco una terapia concomitante.
Sander et al., Arthritis & Rheumatism, Vol. 38, nº 9 (suppl.) 1995, pág. S266, Abstract 678, describen una terapia combinada de la artritis reumatoide, que implica el tratamiento intermitente con metotrexato y el bloqueo de TNF. La terapia de larga duración con metotrexato se interrumpe durante un periodo de eliminación del fármaco de 28 días, y después se administra un agente bloqueante de TNF durante 6 a 12 meses. Durante este tiempo, el paciente... [Seguir leyendo]
Reivindicaciones:
1. Uso de un anticuerpo anti-factor de necrosis tumoral humano, o un fragmento del mismo, que se une específicamente a factor de necrosis tumoral, para la preparación de un medicamento para el tratamiento de artritis reumatoide, artritis crónica juvenil, espondilitis anquilosante, artritis psoriática o enfermedad de Crohn, en donde el anticuerpo anti-factor de necrosis tumoral está indicado para su administración en dosis únicas o múltiples, como terapia concomitante con terapia metotrexato, y el metotrexato está indicado para su administración en dosis múltiples.
2. Uso según la reivindicación 1, en donde el anticuerpo anti-factor de necrosis tumoral es monoclonal.
3. Uso según la reivindicación 1, en donde el anticuerpo anti-factor de necrosis tumoral es quimérico.
4. Uso según la reivindicación 1, en donde el anticuerpo anti-factor de necrosis tumoral es humanizado.
5. Uso según la reivindicación 1 para la preparación de un medicamento para tratamiento de artritis reumatoide.
6. Uso según una cualquiera de las reivindicaciones 1 a 5, en donde el metotrexato está indicado para su administración en forma de una serie de dosis bajas separadas por intervalos de días o semanas.
7. Uso según la reivindicación 1, en donde la enfermedad mediada por TNF es artritis reumatoide y el anticuerpo anti-TNF está indicado para su administración como infusiones múltiples.
8. Uso según la reivindicación 7, en donde el anticuerpo anti-TNF es un anticuerpo monoclonal quimérico, que está indicado para su administración como infusiones múltiples de 1, 3 o 10 mg/kg.
9. Uso de un anticuerpo anti-factor de necrosis tumoral para la preparación de un medicamento para tratar artritis reumatoide, en donde el anticuerpo anti-factor de necrosis tumoral está indicado para su administración como terapia concomitante a pacientes que reciben terapia con metotrexato.
10. Uso según la reivindicación 9, donde el anticuerpo anti-TNF es cA2, que está indicado para su administración en combinación con metotrexato como una infusión única de 5, 10 o 20 mg/kg de cA2, y el metotrexato está indicado para administrarse a una dosis de 10 mg/semana.
11. Uso de un anticuerpo anti-factor de necrosis tumoral para la preparación de un medicamento para tratar artritis reumatoide, en donde el anticuerpo anti-factor de necrosis tumoral es cA2, que está indicado para su administración como un tratamiento repetido como terapia concomitante con terapia metotrexato en pacientes con artritis reumatoide cuya enfermedad no se controla completamente con metotrexato.
12. Uso según la reivindicación 11, en donde el anticuerpo anti-TNF es cA2, que está indicado para su administración como una infusión repetida de 10 mg/kg de cA2, y el metotrexato está indicado para ser administrado a una dosis de 10 mg/semana.
13. Un anticuerpo anti-factor de necrosis tumoral humano, o un fragmento del mismo, que se une específicamente a factor de necrosis tumoral, para uso en el tratamiento de artritis reumatoide, artritis crónica juvenil, espondilitis anquilosante, artritis psoriática o enfermedad de Crohn, en donde el anticuerpo anti-factor de necrosis tumoral está indicado para su administración en dosis únicas o múltiples, como terapia concomitante con terapia metotrexato, y el metotrexato está indicado para su administración en dosis múltiples.
14. El anticuerpo según la reivindicación 13, en donde el anticuerpo anti-factor de necrosis tumoral es monoclonal.
15. El anticuerpo según la reivindicación 13, en donde el anticuerpo anti-factor de necrosis tumoral es quimérico.
16. El anticuerpo según la reivindicación 13, en donde el anticuerpo anti-factor de necrosis tumoral es humanizado.
17. El anticuerpo según la reivindicación 13 para uso en el tratamiento de artritis reumatoide.
18. El anticuerpo según una cualquiera de las reivindicaciones 13 a 17, en donde el metotrexato está indicado para su administración en forma de una serie de dosis bajas separadas por intervalos de días o semanas.
19. El anticuerpo según la reivindicación 13 para uso en el tratamiento de artritis reumatoide por administración como infusiones múltiples.
20. El anticuerpo según la reivindicación 19, que es un anticuerpo monoclonal quimérico, que está indicado para su administración como infusiones múltiples de 1, 3 o 10 mg/kg.
21. Un anticuerpo anti-factor de necrosis tumoral para uso en el tratamiento de artritis reumatoide por administración como terapia concomitante a pacientes que reciben terapia con metotrexato.
22. El anticuerpo según la reivindicación 21, que es cA2, que está indicado para su administración en combinación con metotrexato como una infusión única de 5, 10 o 20 mg/kg de cA2, y el metotrexato está indicado para administrarse a una dosis de 10 mg/semana.
23. Un anticuerpo anti-factor de necrosis tumoral para uso en el tratamiento de artritis reumatoide, en donde el
anticuerpo es cA2, que está indicado para su administración como un tratamiento repetido como terapia concomitante con terapia metotrexato en pacientes con artritis reumatoide cuya enfermedad no se controla completamente con metotrexato.
24. El anticuerpo según la reivindicación 23, en donde el anticuerpo anti-TNF es cA2, que está indicado para su administración como una infusión repetida de 10 mg/kg de cA2, y el metotrexato está indicado para ser administrado 10 a una dosis de 10 mg/semana.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Inhibidores de la HDAC en combinación con los inhibidores de la pi3k, para el tratamiento del linfoma no Hodgkin, del 1 de Julio de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para usar en el tratamiento del linfoma no Hodgkin que comprende una cantidad terapéuticamente eficaz de un inhibidor […]
Compuestos de pirimidina como inhibidores de quinasas, del 1 de Julio de 2020, de Icahn School of Medicine at Mount Sinai: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal del mismo, donde: R1 es CN, S(O)jAr1 o S(O)k(alquilen C1-6)Ar1; j es 0, 1 o 2; k es 0, 1 o 2; […]
Síntesis y formas de sal novedosas de (R)-5-((E)-2-pirrolidin-3-ilvinil)pirimidina, del 1 de Julio de 2020, de Oyster Point Pharma, Inc: Un procedimiento para la fabricación de (R)-5-((E)-2-pirrolidin-3-ilvinil)pirimidina que comprende: (a) tratar el compuesto 1 con cloruro de metanosulfonilo para […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Actividad antitumoral de inhibidores de multicinasas en cáncer colorrectal, del 10 de Junio de 2020, de ENTRECHEM, S.L: Composición para uso en la prevención y/o el tratamiento de cáncer colorrectal en un paciente, que comprende: a) un compuesto de fórmula (I) **(Ver fórmula)** […]
Formulaciones farmacéuticas de estatinas y ácidos grasos omega-3 para encapsulación, del 27 de Mayo de 2020, de Catalent Ontario Limited: Una cápsula de gelatina blanda multifase para administración oral, comprendiendo la cápsula de gelatina blanda: una forma de dosificación […]