FORMAS FARMACÉUTICAS DE DOSIFICACIÓN ORAL RESISTENTES A LA MANIPULACIÓN INDEBIDA QUE COMPRENDEN UN ANALGÉSICO OPIOIDE.
Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada,
comprendiendo la formulación matricial de liberación prolongada una composición que comprende por lo menos un agente activo y por lo menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de por lo menos 1.000.000; en donde la formulación matricial de liberación prolongada está curada a una temperatura de por lo menos aproximadamente 60 ºC durante un periodo de tiempo de por lo menos aproximadamente 1 minuto, en forma de un comprimido o multiparticulados, en donde el comprimido o los multiparticulados individuales se pueden al menos aplanar sin romperse, caracterizada por un grosor del comprimido o del multiparticulado individual después del aplanado que se corresponde con no más de aproximadamente el 60% del grosor del comprimido o el multiparticulado individual antes del aplanado, y en donde el comprimido aplanado o no aplanado o los multiparticulados aplanados o no aplanados proporcionan una velocidad de disolución in-vitro, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) que comprende etanol 40% a 37°C, caracterizada por la cantidad porcentual de agente activo liberado a 0,5 horas de disolución, que se desvía no más de aproximadamente 20 puntos porcentuales con respecto a la velocidad de disolución in-vitro correspondiente medida en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37°C sin etanol, usando un comprimido de referencia aplanado y no aplanado o multiparticulados de referencia aplanados y no aplanados, respectivamente
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09156832.
Solicitante: PURDUE PHARMA LP.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE STAMFORD FORUM 201 TRESSER BOULEVARD STAMFORD CT 06901 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MANNION,RICHARD OWEN, O'DONNELL,EDWARD PATRICK, MCKENNA,WILLIAM HENRY, HUANG,HAIYONG HUGH.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Agosto de 2007.
Clasificación Internacional de Patentes:
- A61K9/16H6D
- A61K9/20H6D
- A61K9/20P
- A61K9/28H6F2
Clasificación PCT:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/32 A61K 9/00 […] › que contienen polímeros sintéticos sólidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357376_T3.pdf




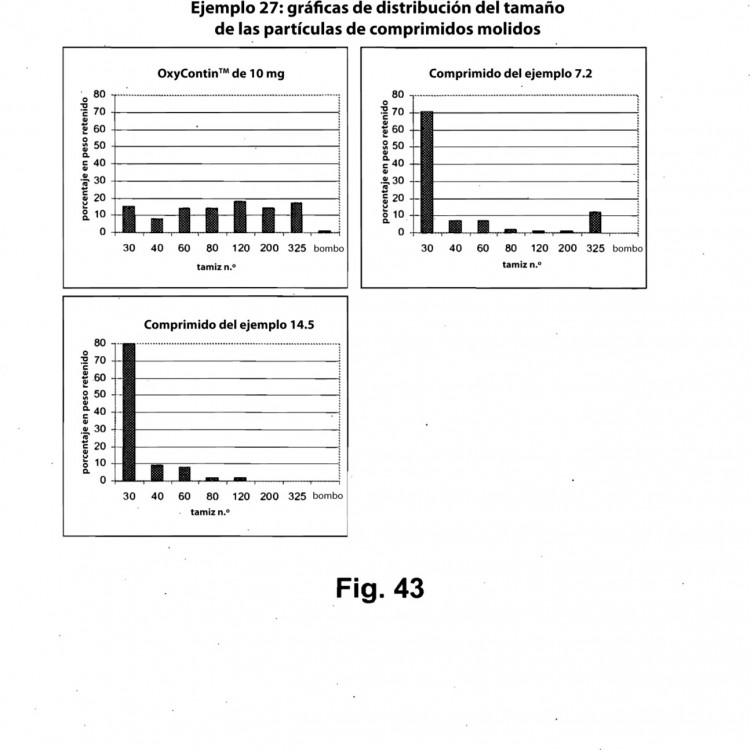
Fragmento de la descripción:
CAMPO TÉCNICO DE LA INVENCIÓN
La presente invención se refiere a formas de dosificación farmacéuticas, por ejemplo a una forma de dosificación resistente a manipulaciones indebidas que incluye un analgésico opioide, y a procesos de elaboración, usos y métodos de tratamiento de las mismas. 5
ANTECEDENTES DE LA INVENCIÓN
En ocasiones los productos farmacéuticos son objeto de abuso. Por ejemplo, una dosis particular de agonista opioide puede ser más potente cuando se administra de manera parenteral en comparación con la misma dosis administrada oralmente. Algunas formulaciones pueden ser manipuladas indebidamente para proporcionar el agonista opioide contenido en ellas para su uso ilícito. Las formulaciones de agonistas opioides de liberación 10 controlada en ocasiones son aplastadas, o sometidas a extracción con disolventes (por ejemplo, etanol) por toxicómanos con el fin de obtener el opioide contenido en ellas para su liberación inmediata tras administración oral o parenteral.
Las formas de dosificación de agonistas opioides de liberación controlada que pueden liberar una fracción del opioide tras exposición a etanol, pueden dar como resultado que un paciente reciba la dosis más rápidamente 15 que lo que se pretende si el mismo desatiende las instrucciones de uso y utiliza simultáneamente alcohol con la forma de dosificación.
Sigue existiendo en la técnica una necesidad de formas farmacéuticas de dosificación oral que comprendan un agonista opioide sin propiedades de liberación del opioide que cambien de manera significativa cuando entran en contacto con alcohol y/o con resistencia al aplastamiento. 20
OBJETIVOS Y RESUMEN DE LA INVENCIÓN
Un objetivo de ciertas realizaciones de la presente invención es proporcionar una forma de dosificación oral de liberación prolongada que comprende un agente activo, tal como un analgésico opioide, la cual es resistente a manipulaciones indebidas.
Un objetivo de ciertas realizaciones de la presente invención es proporcionar una forma de dosificación 25 oral de liberación prolongada que comprende un agente activo, tal como un analgésico opioide, la cual es resistente al aplastamiento.
Un objetivo de ciertas realizaciones de la presente invención es proporcionar una forma de dosificación oral de liberación prolongada que comprende un agente activo, tal como un analgésico opioide, la cual es resistente a la extracción con alcohol y a la absorción rápida de la dosis cuando se usa simultáneamente o en contacto con 30 alcohol.
En ciertas realizaciones, la presente invención se refiere a una forma farmacéutica de dosificación oral, sólida, de liberación prolongada, que comprende una formulación matricial de liberación prolongada en forma de un comprimido o multiparticulados, en la que el comprimido o los multiparticulados individuales pueden ser al menos aplanados sin romperse, caracterizada por un grosor del comprimido o del multiparticulado individual después del 35 aplanado que se corresponde con no más de aproximadamente el 60% del grosor del comprimido o del multiparticulado individual antes del aplanado, y en la que dicho comprimido aplanado o los multiparticulados aplanados proporcionan una velocidad de disolución in-vitro, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37° C, caracterizada por la cantidad porcentual de activo liberado a 0,5 horas de disolución, que se desvía no más de aproximadamente 20 puntos porcentuales con 40 respecto a la velocidad de disolución in-vitro correspondiente de un comprimido de referencia o multiparticulados de referencia no aplanados.
En ciertas realizaciones, la presente invención se refiere a una forma farmacéutica de dosificación oral, sólida, de liberación prolongada que comprende una formulación matricial de liberación prolongada en forma de un comprimido o multiparticulados, en la que el comprimido o los multiparticulados individuales se pueden al menos 45 aplanar sin romperse, caracterizada por un grosor del comprimido o del multiparticulado individual después del aplanado que se corresponde con no más de aproximadamente el 60% del grosor del comprimido o el multiparticulado individual antes del aplanado, y en la que el comprimido aplanado o no aplanado o los multiparticulados aplanados o no aplanados proporcionan una velocidad de disolución in-vitro, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) que comprende etanol 50 40% a 37°C, caracterizada por la cantidad porcentual de activo liberado a 0,5 horas de disolución, que se desvía no más de aproximadamente 20 puntos porcentuales con respecto a la velocidad de disolución in-vitro correspondiente medida en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37°C sin etanol, usando un comprimido de referencia aplanado y no aplanado o multiparticulados de referencia aplanados y no aplanados, respectivamente. 55
En ciertas realizaciones, la presente invención se refiere a una forma farmacéutica de dosificación oral, sólida, de liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial de liberación prolongada una composición que comprende al menos:
(1) al menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de al menos 1.000.000; y 5
(2) al menos un agente activo; y
en la que la composición comprende al menos aproximadamente un 80% (en peso) de óxido de polietileno.
De acuerdo con ciertas realizaciones del tipo mencionado, el agente activo es clorhidrato de oxicodona y la composición comprende más de aproximadamente un 5% (en peso) del clorhidrato de oxicodona. 10
En ciertas realizaciones, la presente invención se refiere a una forma farmacéutica de dosificación oral, sólida, de liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial de liberación prolongada una composición que comprende al menos:
(1) al menos un agente activo;
(2) al menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular 15 aproximado de al menos 1.000.000; y
(3) al menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular menor que 1.000.000.
En ciertas realizaciones, la presente invención se refiere a un proceso para preparar una forma farmacéutica de dosificación oral, sólida, de liberación prolongada, que comprende al menos las etapas de: 20
(a) combinar al menos
(1) al menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de al menos 1.000.000, y
(2) al menos un agente activo,
para formar una composición; 25
(b) dar forma a la composición para formar una formulación matricial de liberación prolongada; y
(c) curar dicha formulación matricial de liberación prolongada, que comprende al menos una etapa de curado en la que la formulación matricial de liberación prolongada se somete a una temperatura que es por lo menos la temperatura de reblandecimiento de dicho óxido de polietileno durante un periodo de tiempo de al menos aproximadamente 1 minuto. 30
En ciertas realizaciones, la presente invención se refiere a un proceso para preparar una forma farmacéutica de dosificación oral, sólida, de liberación prolongada, que comprende al menos las etapas de:
(a) combinar al menos
(1) al menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de al menos 1.000.000, y 35
(2) al menos un agente activo,
para formar una composición;
(b) dar forma a la composición para formar una formulación matricial de liberación prolongada; y
(c) curar dicha formulación matricial de liberación prolongada que comprende al menos una etapa de curado en la que dicho óxido de polietileno se funde al menos parcialmente. 40
En ciertas realizaciones, la presente invención se refiere a una forma farmacéutica de dosificación oral, sólida, de liberación prolongada que comprende una formulación matricial... [Seguir leyendo]
Reivindicaciones:
R E I V I N D I C A C I O N E S
1. Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial de liberación prolongada una composición que comprende por lo menos un agente activo y por lo menos un óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de por lo menos 1.000.000; 5 en donde la formulación matricial de liberación prolongada está curada a una temperatura de por lo menos aproximadamente 60 ºC durante un periodo de tiempo de por lo menos aproximadamente 1 minuto, en forma de un comprimido o multiparticulados,
en donde el comprimido o los multiparticulados individuales se pueden al menos aplanar sin romperse, caracterizada por un grosor del comprimido o del multiparticulado individual después del aplanado que se 10 corresponde con no más de aproximadamente el 60% del grosor del comprimido o el multiparticulado individual antes del aplanado, y en donde el comprimido aplanado o no aplanado o los multiparticulados aplanados o no aplanados proporcionan una velocidad de disolución in-vitro, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) que comprende etanol 40% a 37°C, caracterizada por la cantidad porcentual de agente activo liberado a 0,5 15 horas de disolución, que se desvía no más de aproximadamente 20 puntos porcentuales con respecto a la velocidad de disolución in-vitro correspondiente medida en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37°C sin etanol, usando un comprimido de referencia aplanado y no aplanado o multiparticulados de referencia aplanados y no aplanados, respectivamente.
2. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1, en la que el 20 comprimido o los multiparticulados pueden al menos aplanarse sin romperse, caracterizada por un grosor del comprimido o del multiparticulado individual después del aplanado, que se corresponde con no más que aproximadamente el 60%, o no más que aproximadamente el 50%, o no más que aproximadamente el 40%, o no más que aproximadamente el 30%, o no más que aproximadamente el 20%, o no más que aproximadamente el 16% del grosor del comprimido o el multiparticulado individual antes del aplanado, y 25 en la que el comprimido aplanado o no aplanado o los multiparticulados individuales proporcionan una velocidad de disolución in-vitro, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) que comprende etanol 40% a 37° C, caracterizada por la cantidad porcentual de agente activo liberado a las 0,5 horas de disolución, que se desvía no más que aproximadamente 20 puntos porcentuales o no más que aproximadamente 15 puntos porcentuales con 30 respecto a la velocidad de disolución in-vitro correspondiente medida en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37° C sin etanol, usando un comprimido de referencia o multiparticulados de referencia aplanados y no aplanados, respectivamente.
3. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1 ó 2,
en la que la densidad de la formulación matricial de liberación prolongada es igual a o menor que 35 aproximadamente 1,20 g/cm3, preferentemente igual a o menor que aproximadamente 1,19 g/cm3.
4. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1,
en la que la formulación matricial de liberación prolongada después de haber estado almacenada a 25 °C y un 60% de humedad relativa (RH) durante por lo menos 1 mes proporciona una velocidad de disolución, cuando se mide en un Aparato 1 USP (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin 40 enzimas (SGF) a 37 ºC, caracterizada por la cantidad porcentual de agente activo liberado a 1, 4 y 12 horas de disolución, que se desvía no más que aproximadamente 15 puntos porcentuales con respecto a la velocidad de disolución in-vitro correspondiente de una formulación de referencia antes del almacenamiento.
5. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 4, 45
en la que la formulación matricial de liberación prolongada se ha almacenado a 40 ºC y un 75 % de humedad relativa (RH).
6. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1,
en la que la formulación matricial de liberación prolongada, después de haberse almacenado a 25 ºC y una humedad relativa (RH) del 60 % durante por lo menos 1 mes contiene una cantidad del por lo menos 50 un agente activo en % (en peso) en relación con lo declarado en la etiqueta del agente activo para la formulación matricial de liberación prolongada, que se desvía no más de aproximadamente 10 puntos porcentuales con respecto a la cantidad correspondiente de agente activo en % (en peso) en relación con lo declarado en la etiqueta del agente activo para la formulación matricial de liberación prolongada de una formulación de referencia antes del almacenamiento. 55
7. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 6,
en la que la formulación matricial de liberación prolongada se ha almacenado a 40 ºC y una humedad relativa (RH) del 75 %.
8. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1,
en la que la forma de dosificación proporciona una velocidad de disolución, que, cuando se mide en un Aparato USP 1 (cestillo) a 100 rpm en 900 ml de fluido gástrico simulado sin enzimas (SGF) a 37 ºC, está 5 entre el 12,5 y el 55 % (en peso) de activo liberado después de 1 hora, entre el 25 y el 65 % (en peso) de activo liberado después de 2 horas, entre el 45 y el 85 % (en peso) de activo liberado después de 4 horas y entre el 55 y el 95 % (en peso) de activo liberado después de 6 horas.
9. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1,
en la que el agente activo es clorhidrato de oxicodona y en la que la forma de dosificación, cuando se 10 somete a prueba en un estudio clínico comparativo, es bioequivalente al producto comercial OxyContin™.
10. Forma farmacéutica sólida de dosificación oral y liberación prolongada de la reivindicación 1,
en la que el agente activo es clorhidrato de oxicodona y en la que una forma de dosificación que comprende 10 mg de clorhidrato de oxicodona, cuando se somete a prueba en un estudio clínico comparativo, es bioequivalente a un comprimido de referencia que contiene 10 mg de clorhidrato de 15 oxicodona en una formulación matricial que contiene:
a) Clorhidrato de oxicodona: 10,0 mg/comprimido
b) Lactosa (secada por atomización): 69,25 mg/comprimido
c) Povidona: 5,0 mg/comprimido
d) Eudragit® RS 30D (sólido): 10,0 mg/comprimido 20
e) Triacetin®: 2,0 mg/comprimido
f) Alcohol estearílico: 25,0 mg/comprimido
g) Talco: 2,5 mg/comprimido
h) Estearato de Magnesio: 1,25 mg/comprimido;
y en la que el comprimido de referencia se prepara mediante las siguientes etapas: 25
1. Eudragit® RS 30D y Triacetin® se combinan mientras se hacen pasar a través de un tamiz de malla 60, y se mezclan con baja cizalla durante aproximadamente 5 minutos o hasta que se observa una dispersión uniforme.
2. Se colocan HCl de oxicodona, lactosa, y povidona en el recipiente de un granulador/secador de lecho fluido (FBD), y la suspensión se pulveriza sobre el polvo en el lecho fluido. 30
3. Después de la pulverización, la granulación se hace pasar a través de un tamiz n.º 12, si es necesario, para reducir los grumos.
4. La granulación seca se coloca en un mezclador.
5. Mientras tanto, la cantidad requerida de alcohol estearílico se funde a una temperatura de aproximadamente 70° C. 35
6. El alcohol estearílico fundido se incorpora en la granulación mientras se mezcla.
7. La granulación encerada se transfiere a bandejas o un granulador/secador de lecho fluido, y se deja enfriar a temperatura ambiente o inferior.
8. A continuación la granulación enfriada se hace pasar a través de un tamiz n.º 12.
9. La granulación encerada se coloca en un mezclador (mixer/blender) y se lubrica con las cantidades 40 necesarias de talco y estearato de magnesio durante aproximadamente 3 minutos.
10. El granulado se comprime en comprimidos de 125 mg en una máquina para elaborar comprimidos, apropiada.
11. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 1 a 10, en la que la composición comprende por lo menos aproximadamente un 80 % (en peso) de óxido de polietileno. 45
12. Forma de dosificación de liberación prolongada de la reivindicación 11, en la que la composición
comprende por lo menos aproximadamente un 80 % (en peso) de óxido de polietileno que tiene, basándose en mediciones reológicas, un peso molecular aproximado de por lo menos 1.000.000.
13. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 1 a 8, en la que el agente activo es un analgésico opioide.
14. Forma de dosificación de liberación prolongada de la reivindicación 13, en la que el analgésico opioide se 5 selecciona del grupo de alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, becitramida, buprenorfina, butorfanol, clonitaceno, codeína, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxafetilo, dipipanona, eptazocina, etoheptacina, etilmetiltiambuteno, etilmorfina, etonitaceno, etorfina, dihidroetorfina, fentanilo y derivados, hidrocodona, hidromorfona, hidroxipetidina, isometadona, 10 ketobemidona, levorfanol, levofenacilmorfano, lofentanil, meperidina, meptacinol, metazocina, metadona, metopón, morfina, mirofina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, nalbufeno, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomorfano, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propoxifeno, sufentanil, tilidina, tramadol, sales, hidratos y solvatos farmacéuticamente aceptables de los 15 mismos, mezclas de cualquiera de los anteriores.
15. Forma de dosificación de liberación prolongada de la reivindicación 13, en la que el analgésico opioide se selecciona del grupo de codeína, morfina, oxicodona, hidrocodona, hidromorfona u oximorfona, o sales, hidratos y solvatos farmacéuticamente aceptables de las mismas, mezclas de cualquiera de los anteriores. 20
16. Forma de dosificación de liberación prolongada de la reivindicación 9 ó 14, en la que el analgésico opioide es clorhidrato de oxicodona y la forma de dosificación comprende entre aproximadamente 5 mg y aproximadamente 500 mg de clorhidrato de oxicodona.
17. Forma de dosificación de liberación prolongada de la reivindicación 16, en la que la forma de dosificación comprende 5 mg, 7,5 mg, 10 mg, 15 mg, 20 mg, 30 mg, 40 mg, 45 mg, 60 mg, u 80 mg, 90 mg, 120 mg ó 25 160 mg de clorhidrato de oxicodona.
18. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 9, 10 y 13, en la que el analgésico opioide es clorhidrato de oxicodona que tiene un nivel de 14-hidroxicodeinona menor que aproximadamente 25 ppm, preferentemente menor que aproximadamente 15 ppm, menor que aproximadamente 10 ppm, o menor que aproximadamente 5 ppm. 30
19. Forma de dosificación de liberación prolongada de la reivindicación 13, en la que el analgésico opioide es clorhidrato de oximorfona y la forma de dosificación comprende entre aproximadamente 1 mg y aproximadamente 500 mg de clorhidrato de oximorfona.
20. Forma de dosificación de liberación prolongada de la reivindicación 19, en la que la forma de dosificación comprende 5 mg, 7,5 mg, 10 mg, 15 mg, 20 mg, 30 mg, 40 mg, 45 mg, 60 mg, u 80 mg, 90 mg, 120 mg ó 35 160 mg de clorhidrato de oximorfona.
21. Forma de dosificación de liberación prolongada de la reivindicación 13, en la que el analgésico opioide es clorhidrato de hidromorfona y la forma de dosificación comprende entre aproximadamente 1 mg y aproximadamente 100 mg de clorhidrato de hidromorfona.
22. Forma de dosificación de liberación prolongada de la reivindicación 21, en la que la forma de dosificación 40 comprende 2 mg, 4 mg, 8 mg, 12 mg, 16 mg, 24 mg, 32 mg, 48 mg ó 64 mg de clorhidrato de hidromorfona.
23. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 1 a 22, que está en forma de un comprimido formado mediante compresión directa de la composición y curado por lo menos sometiendo dicho comprimido a una temperatura de por lo menos aproximadamente 60 ºC o por lo 45 menos aproximadamente 62 ºC durante un periodo de tiempo de por lo menos aproximadamente 1 minuto, preferentemente por lo menos aproximadamente 5 minutos o por lo menos aproximadamente 15 minutos.
24. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 1 a 23, que está en forma de un comprimido y a la que se le aplica un sobrerrecubrimiento con una capa de polvo de óxido 50 de polietileno para formar un comprimido que presenta un comprimido con núcleo y una capa de óxido de polietileno que rodea al comprimido con núcleo.
25. Forma de dosificación de liberación prolongada de una cualquiera de las reivindicaciones 1 a 23, que está en forma de un comprimido con dos o múltiples capas apiladas,
en la que una de las capas contiene una formulación de liberación prolongada y una de las otras capas 55 contiene una formulación de liberación inmediata.
26. Forma de dosificación de liberación prolongada de la reivindicación 25, en la que la formulación de liberación prolongada y la formulación de liberación inmediata contienen los mismos o diferentes agentes activos.
27. Forma de dosificación de liberación prolongada de la reivindicación 25, en la que la formulación de liberación prolongada comprende un analgésico opioide y la formulación de liberación inmediata 5 comprende un analgésico no opioide.
28. Uso de una forma de dosificación según una cualquiera de las reivindicaciones 1 a 27 para la elaboración de un medicamento para el tratamiento del dolor, en donde la forma de dosificación comprende un analgésico opioide.
29. Uso de óxido de polietileno de alto peso molecular que presenta, basándose en mediciones reológicas, un 10 peso molecular de por lo menos 1.000.000, como material formador de matrices en la elaboración de una forma sólida de dosificación oral y liberación prolongada que comprende un agente activo seleccionado de entre opioides para comunicar a la forma sólida de dosificación oral y liberación prolongada, resistencia a la extracción con alcohol.
30. Comprimido farmacéutico según las reivindicaciones anteriores, que presenta una fuerza de fractura de 15 por lo menos 110 N, preferentemente 120 N, más preferentemente 130 N, y todavía más preferentemente 140 N, cuando se somete a una prueba de indentación.
31. Comprimido farmacéutico según las reivindicaciones anteriores, que presenta una distancia de profundidad de penetración hasta la fractura de por lo menos 1,0 mm, preferentemente 1,2 mm, más preferentemente 1,4 mm, y todavía más preferentemente 1,6 mm, cuando se somete a una prueba de 20 indentación.
32. Comprimido farmacéutico según las reivindicaciones anteriores, capaz de resistir un trabajo de por lo menos 0,06 J sin fracturarse.
Patentes similares o relacionadas:
MÉTODO PARA ELABORAR DISPERSIONES SÓLIDAS DE MIDOSTAURINA, del 12 de Agosto de 2011, de NOVARTIS AG: Un método para elaborar una dispersión sólida que comprende las etapas de: combinar midostaurina con un vehículo y un agente solubilizante para formar una […]
PREPARACIÓN FARMACÉUTICA QUE CONTIENE GABAPENTINA, del 5 de Agosto de 2011, de ZAMBON S.P.A.: Un granulado de gabapentina obtenido por granulación en estado fundido de gabapentina con PEG, que tiene un punto de fusión comprendido entre […]
FORMAS DE DOSIFICACIÓN FARMACÉUTICAS ORALES RESISTENTES A MANIPULACIONES QUE INCLUYE UN ANALGÉSICO OPIOIDE, del 21 de Junio de 2011, de PURDUE PHARMA LP: Forma posológica farmacéutica oral sólida de liberación prolongada que comprende una formulación de matriz de liberación prolongada, comprendiendo la formulación […]
 FORMAS FARMACÉUTICAS DE DOSIFICACIÓN ORAL RESISTENTES A LA MANIPULACIÓN INDEBIDA QUE COMPRENDEN UN ANALGÉSICO OPIOIDE, del 5 de Mayo de 2011, de PURDUE PHARMA LP: Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial […]
FORMAS FARMACÉUTICAS DE DOSIFICACIÓN ORAL RESISTENTES A LA MANIPULACIÓN INDEBIDA QUE COMPRENDEN UN ANALGÉSICO OPIOIDE, del 5 de Mayo de 2011, de PURDUE PHARMA LP: Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial […]
ARIPIPRAZOL AMORFO Y PROCEDIMIENTO PARA SU PREPARACIÓN, del 2 de Marzo de 2011, de HELM AG: Una composición que comprende aripiprazol amorfo y al menos como primer agente estabilizador un polimetacrilato, y como segundo agente estabilizador un polietilenglicol
FORMULACION FARMACEUTICA QUE COMPRENDE MICROCAPSULAS DE ESTATINAS SUSPENDIDAS EN ESTERES ALQUILICOS DE ACIDOS GRASOS POLIINSATURADOS (PUFA), del 25 de Octubre de 2010, de GP PHARM S.A. DEFIANTE FARMACEUTICA S.A: Formulación farmacéutica compuesta por una suspensión que comprende un aceite con elevado contenido de esteres alquílicos de ácidograso poliinsaturado (PUFA) y microcápsulas […]
 FORMULACION DE LIBERACION CONTROLADA QUE TRAMADOL FORMULACION DE LIBERACION CONTROLADA QUE CONTIENE TRAMADOL, del 19 de Octubre de 2010, de EURO-CELTIQUE S.A.: Uso de tramadol en la fabricación de una preparación analgésica de liberación controlada para una administración oral de una vez al día, en […]
FORMULACION DE LIBERACION CONTROLADA QUE TRAMADOL FORMULACION DE LIBERACION CONTROLADA QUE CONTIENE TRAMADOL, del 19 de Octubre de 2010, de EURO-CELTIQUE S.A.: Uso de tramadol en la fabricación de una preparación analgésica de liberación controlada para una administración oral de una vez al día, en […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE UNA FORMA DE DOSIFICACIÓN SÓLIDA A PRUEBA DE ABUSO, del 10 de Noviembre de 2011, de GRUNENTHAL GMBH: Procedimiento para la preparación de una forma de dosificación sólida a prueba de abuso que contiene al menos un principio activo susceptible de abuso […]