COMPOSICIÓN PARA SUMINISTRO TRANSMUCOSAL DE POLIPÉPTIDOS.
Una composición transmucosal que comprende: a) una cantidad terapéuticamente eficaz de un polipéptido biológicamente activo;
b) un componente excipiente efervescente; y c) una sal biliar
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/005655.
Solicitante: CEPHALON, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 41 MOORES ROAD P.O. BOX 4011 FRAZER, PA 19355 ESTADOS UNIDOS DE AMERICA.
Inventor/es: DURFEE,Steve,L, THURMAN,Gary,B.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Mayo de 2008.
Clasificación Internacional de Patentes:
- A61K31/575 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › sustituidos en posición 17 beta por una cadena de al menos tres átomos de carbono, p. ej. colano, colestano, ergosterol, sitosterol.
- A61K38/11
- A61K38/21A
- A61K38/21B
- A61K38/21C
- A61K38/22 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormonas (derivados de pro-opiomelanocortina, pro-encefalina o pro-dinorfina A61K 38/33, p. ej. corticotropina A61K 38/35).
- A61K38/23 A61K 38/00 […] › Calcitoninas.
- A61K38/26 A61K 38/00 […] › Glucagón.
- A61K38/28 A61K 38/00 […] › Insulinas.
- A61K38/29 A61K 38/00 […] › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K9/00L6
- A61K9/00M18D
Clasificación PCT:
- A61K31/575 A61K 31/00 […] › sustituidos en posición 17 beta por una cadena de al menos tres átomos de carbono, p. ej. colano, colestano, ergosterol, sitosterol.
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/11
- A61K38/21 A61K 38/00 […] › Interferones.
- A61K38/22 A61K 38/00 […] › Hormonas (derivados de pro-opiomelanocortina, pro-encefalina o pro-dinorfina A61K 38/33, p. ej. corticotropina A61K 38/35).
- A61K38/23 A61K 38/00 […] › Calcitoninas.
- A61K38/26 A61K 38/00 […] › Glucagón.
- A61K38/28 A61K 38/00 […] › Insulinas.
- A61K38/29 A61K 38/00 […] › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/46 A61K 9/00 […] › efervescentes.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359875_T3.pdf




Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La invención se refiere a los campos de la biotecnología y la química farmacéutica. En particular, la invención se refiere al suministro oral transmucosal de polipéptidos biológicamente activos.
ANTECEDENTES DE LA INVENCIÓN
Es sabido que algunos polipéptidos farmacéuticamente activos son útiles en el campo médico en una diversidad de terapias. Los avances en la biotecnología han permitido la producción en gran escala de polipéptidos naturales y recombinantes para fabricación de productos en la industria farmacéutica. Se ha reconocido, sin embargo, que algunos polipéptidos son candidatos deficientes para la ruta de administración gastrointestinal oral debido a su tendencia a la descomposición en el tracto digestivo. De acuerdo con ello, la terapia con polipéptidos se ha realizado típicamente por la ruta parenteral, v.g. infusión o inyección.
Se ha desarrollado la administración transmucosal de fármacos, con inclusión de polipéptidos, utilizando formas de dosificación con composiciones que mejoran la absorción transmucosal. Por ejemplo, Igari et al., Patentes U.S. Núms. 5.725.852 y 5.482.706 describen la administración mucosal de polipéptidos en asociación con citidina-colina-difosfato. Otro método para suministro transmucosal de polipéptidos, por ejemplo, se describe en Acharya et al., Patente U.S. No. 6.210.699, utilizando polivinil-pirrolidona sin plastificar como mucoadhesivo. La absorción transvaginal de polipéptidos se describe en Fujii et al., Patente U.S. No. 5.238.937, en donde el promotor de absorción incluye polioxietilenoalquilfenil-éter y ácido cólico.
Es bien sabido que la absorción oral transmucosal está asociada con ciertas ventajas, tales como posibilidad de auto-administración, comienzo más rápido de concentración en plasma y efecto terapéutico, y evitación del metabolismo de primer paso del ingrediente activo. Se han desarrollado diversas formas de dosificación para el suministro oral transmucosal de ciertos ingredientes activos a través de las mucosas, v.g., sublingual, bucal, gingival, palatal, y de los tejidos mucosales esofágicos. Dichas formas de dosificación han sido diseñadas para desintegración rápida y concentraciones elevadas del ingrediente activo a fin de efectuar la absorción en la cavidad oral.
Se ha explorado también la administración oral transmucosal de polipéptidos. Por ejemplo, la administración bucal de polipéptidos se describe en Heiber et al., Patentes U.S. Núms. 5.863.555 y 5.766.620, en donde se administra por vía bucal un polipéptido insulinotrópico semejante a glucagón, en asociación con un mejorador de la permeación tal como sales biliares.
Una forma de dosificación oral formulada específicamente para absorción oral transmucosal de ciertos opiáceos tales como fentanilo, ha sido desarrollada bajo el nombre comercial FENTORA® utilizando la tecnología ORAVESCENT® (disponible de CIMA LABS., Inc., Eden Prairie, Minnesota). Esta tecnología ha sido descrita en las Patentes U.S. Núms. 6.200.604 y 6.974.590, por ejemplo, así como en las Solicitudes de Patente U.S. Publicadas Núms. 2005/0169989 (Núm. de Serie 1/026.132 presentada el 30 de diciembre de 2004); 2005/0142197 (Serial No. 1/026.327 presentada el 30 de diciembre de 2004); 2005/0142198 (Núm. de Serie 1/027.353 presentada el 30 de diciembre de 2004); y 2005/0163838 (Núm. de Serie 11/026.759 presentada el 30 de diciembre de 2004). Esta tecnología particular utiliza una formulación de excipientes que contiene una sustancia de ajuste del pH y un par efervescente para facilitar el transporte transmucosal del ingrediente activo citrato de fentanilo. No obstante, se encuentra en curso la identificación de otros compuestos farmacéuticamente activos que podrían beneficiarse de la administración de la forma de dosificación oral efervescente de ORAVESCENT®.
Existe necesidad en el campo farmacéutico de formas de dosificación que alcancen éxito y mejoren el suministro de moléculas grandes, con inclusión de polipéptidos, a través del tejido mucosal oral. Existe necesidad adicional de formulaciones que consigan eficazmente el suministro transmucosal para estructuras moleculares mayores, con inclusión de polipéptidos.
SUMARIO DE LA INVENCIÓN
La invención proporciona una composición que mejora la absorción transmucosal de polipéptidos a través del tejido mucosal oral y proporciona un comienzo terapéutico eficaz relativamente rápido de la misma. Se ha descubierto que puede prepararse una composición que mejora la absorción transmucosal de polipéptidos proporcionando concentraciones terapéuticas en suero al receptor. Se ha descubierto también que la combinación de formas de dosificación transmucosal efervescentes con sales biliares tales como taurocolato (de sodio) puede mejorar significativamente la absorción de polipéptidos cuando se formulan de acuerdo con la invención. La combinación de composiciones efervescentes y sales biliares puede tener un efecto sinérgico sobre el transporte de polipéptidos a través de la mucosa oral, produciendo con ello resultados de biodisponibilidad que son mayores que la suma de sus efectos individuales de mejora de la absorción.
La invención proporciona una composición para absorción oral transmucosal que comprende un polipéptido biológicamente activo; una sal biliar; y un componente excipiente efervescente que comprende un par efervescente. La composición puede comprender opcionalmente además una sustancia de ajuste del pH, v.g., como parte del componente excipiente efervescente o como parte de la composición oral transmucosal. En algunas realizaciones, la composición comprende una forma de dosificación oral sólida, v.g., una tableta.
La invención proporciona adicionalmente una composición que comprende: un polipéptido biológicamente activo; una sal biliar; y un componente excipiente efervescente que comprende un par efervescente para uso en un método de mejora de la absorción transmucosal de un polipéptido biológicamente activo; la composición puede comprender además opcionalmente una sustancia de ajuste del pH.
La invención proporciona una composición oral transmucosal que comprende una cantidad terapéuticamente eficaz de insulina, un componente excipiente efervescente; y una sal biliar, para uso en métodos de tratamiento de la diabetes en un receptor.
BREVE DESCRIPCIÓN DE LOS DIBUJOS
La invención se ilustra adicionalmente por las figuras siguientes - ninguna de las cuales debe interpretarse como necesariamente limitante de la invención.
Las Figuras 1 a 15 son gráficos de barras que muestran la permeabilidad comparativa de diversos polipéptidos en combinación con diferentes composiciones excipientes utilizando tejido de cultivo de células epiteliales in vitro.
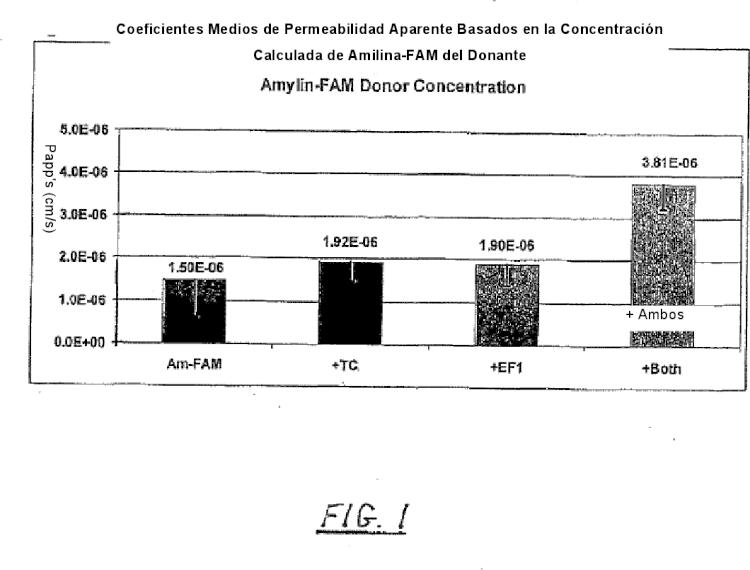
La Figura 1 es un gráfico de barras que muestra la permeabilidad in vitro de amilina por sí sola, en combinación con una sal biliar, en combinación con una composición efervescente, y en combinación a la vez con sal biliar y composición efervescente de acuerdo con algunas realizaciones de la invención. La amilina marcada por fluorescencia se mide por detección de fluorescencia.
La Figura 2 es un gráfico de barras que muestra la permeabilidad in vitro de la calcitonina de salmón por sí sola, en combinación con una sal biliar, en combinación con composición efervescente, y en combinación a la vez con sal biliar y composición efervescente de acuerdo con algunas realizaciones de la invención. La calcitonina marcada por fluorescencia se mide por detección de fluorescencia.
La Figura 3 es un gráfico de barras que muestra la permeabilidad in vitro de GLP-1 por sí solo, en combinación con una sal biliar, en combinación con composición efervescente, y en combinación a la vez con sal biliar y composición efervescente de acuerdo con algunas realizaciones de la invención. El GLP-1 marcado por fluorescencia se mide por detección de fluorescencia.
La Figura 4 es un gráfico de barras que muestra la permeabilidad in vitro de insulina por sí sola, en combinación con una sal biliar, en combinación con composición efervescente, y en combinación a la vez con sal biliar y composición efervescente de acuerdo con algunas realizaciones de la invención. La insulina marcada por fluorescencia se mide por detección de fluorescencia.
La Figura 5 es un gráfico de barras que muestra la permeabilidad in vitro de glucagón en sí mismo, en combinación con una sal biliar, en combinación con composición... [Seguir leyendo]
Reivindicaciones:
1. Una composición transmucosal que comprende:
a) una cantidad terapéuticamente eficaz de un polipéptido biológicamente activo;
b) un componente excipiente efervescente; y
c) una sal biliar.
2. La composición de acuerdo con la reivindicación 1, en la cual el polipéptido tiene un peso molecular comprendido entre aproximadamente 500 Daltons y aproximadamente 200 kiloDaltons.
3. La composición de acuerdo con la reivindicación 2, en la cual el polipéptido tiene un peso molecular comprendido entre aproximadamente 1000 Daltons y aproximadamente 20.000 Daltons.
4. La composición de acuerdo con la reivindicación 1, en la cual dicho componente excipiente efervescente comprende un ácido y una base.
5. La composición de acuerdo con la reivindicación 4, en la cual dicho componente excipiente efervescente comprende ácido cítrico y bicarbonato de sodio.
6. La composición de acuerdo con la reivindicación 1, en la cual dicha sal biliar se selecciona del grupo constituido por taurocolato de sodio, glicocolato de sodio, glicodesoxicolato de sodio, taurodesoxicolato de sodio, colato de sodio, tauroquenodesoxicolato de sodio, y tauroursodesoxicolato de sodio, y combinaciones de los mismos.
7. La composición de acuerdo con la reivindicación 6, en la cual dicha sal biliar es taurocolato de so-dio.
8. La composición de acuerdo con la reivindicación 1, en la cual dicho componente excipiente efervescente comprende adicionalmente una sustancia de ajuste del pH.
9. La composición de acuerdo con la reivindicación 8, en la cual la sustancia de ajuste del pH es un carbonato.
10. La composición de acuerdo con la reivindicación 9, en la cual la sustancia de ajuste del pH es carbonato de sodio.
11. La composición transmucosal de acuerdo con la reivindicación 1 que comprende adicionalmente un desintegrante.
12. La composición de acuerdo con la reivindicación 11, en la cual dicho desintegrante es un glicolato de almidón.
13. La composición de acuerdo con la reivindicación 12, en la cual dicho glicolato de almidón es almidón-glicolato de sodio.
14. La composición de acuerdo con la reivindicación 1 ó 11, en la cual dicho polipéptido biológicamente activo se selecciona del grupo constituido por amilina, calcitonina derivada de salmón rosa (s-CT), péptido 1 semejante a glucagón (GLP-1), glucagón, hormona paratiroidea (PTH), oxitocina, y desmopresina (D-Arg vasopresina).
15. La composición de acuerdo con la reivindicación 1 ó 11, en la cual dicho polipéptido biológicamente activo se selecciona del grupo constituido por insulina, proteína YY (PYY), IFN-α, IFN-β, e IFN-γ.
16. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 15 para uso en un método de mejora de la absorción transmucosal del polipéptido biológicamente activo.
17. Una forma de dosificación oral sólida que comprende una composición oral transmucosal de acuerdo con la reivindicación 1.
18. La forma de dosificación de acuerdo con la reivindicación 17, en la cual dicho componente excipiente efervescente comprende adicionalmente una sustancia de ajuste del pH.
19. La forma de dosificación de acuerdo con la reivindicación 17, en la cual dicho polipéptido es insulina.
20. Una composición oral transmucosal que comprende una cantidad terapéuticamente eficaz de insulina, un componente excipiente efervescente, y una sal biliar para uso en un método de tratamiento de la diabetes en un receptor que se encuentra en necesidad de ello.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Terapia para la diabetes, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un inhibidor de DPP-4, que es linagliptina, para uso terapéutico por administración subcutánea.
Formulaciones farmacéuticas estabilizadas de análogos de insulina y/o derivados de insulina, del 29 de Abril de 2020, de SANOFI: Una formulación farmacéutica que comprende (a) al menos un análogo y/o derivado de insulina, en donde dicho análogo de insulina se selecciona del grupo que […]
Dispositivo, composición y método para el diagnóstico basado en tejidos, del 29 de Abril de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un dispositivo para licuar al menos parcialmente un tejido de un sujeto vivo, que comprende: un depósito que se configura para acoplar operativamente […]
Dispositivo tragable para la administración de fármacos, del 22 de Abril de 2020, de Rani Therapeutics, LLC: Un dispositivo ingerible para la administración de un agente terapéutico hacia el interior de una pared luminal del tubo gastrointestinal de un paciente, […]
Sistemas a base de conjugados para la administración controlada de fármacos, del 18 de Marzo de 2020, de Smartcells, Inc: Un conjugado que comprende una molécula de insulina conjugada a dos o más ligandos de sacáridos, en el que los dos o más ligandos son cada uno aminoetiltrimanosa (AETM) y en […]