SINTESIS DE GLICOPROTEINAS.
Método para la síntesis de una glicoproteína, comprendiendo el método:
a) incorporar en una proteína un aminoácido no natural que comprende un primer grupo reactivo; en el que la etapa de incorporación comprende la incorporación del aminoácido no natural en la proteína con un par ARNt ortogonal/aminoacil ortogonal-ARNt sintetasa (O-ARNt/O-RS), en el que el O-ARNt reconoce un codón selector e incorpora el aminoácido no natural en la proteína como respuesta al codón selector, y en el que los ORS aminoacilan el O-ARNt con el aminoácido natural; y,
b) poner en contacto la proteína con un residuo sacárido que comprende un segundo grupo reactivo, en donde el primer grupo reactivo reacciona con el segundo grupo reactivo para unir el residuo sacárido al aminoácido no natural, produciendo por tanto la glicoproteína
Tipo: Resumen de patente/invención. Número de Solicitud: W03032870US.
Solicitante: THE SCRIPPS RESEARCH INSTITUTE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10550 NORTH TORREY PINES ROAD,LA JOLLA, CA 92037.
Inventor/es: SCHULTZ,PETER G, WANG,LEI, ZHANG,ZHIWEN.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C12P21/00B
Clasificación PCT:
- C12P21/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
Clasificación antigua:
- C12P21/06 C12P 21/00 […] › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
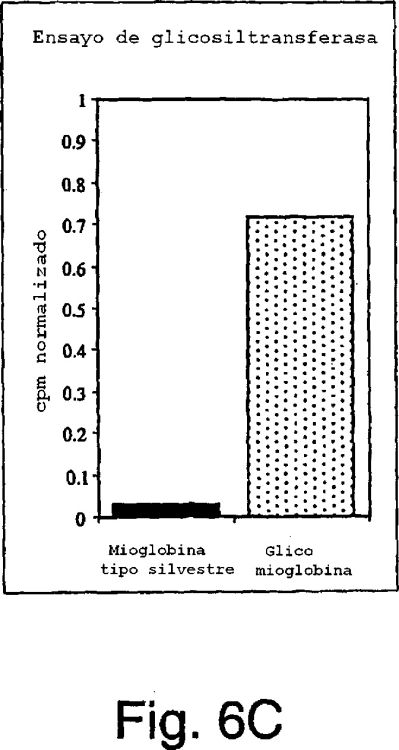
Fragmento de la descripción:
Síntesis de glicoproteínas.
Campo de la invención
La invención se encuentra en el campo de los glicopéptidos, glicoproteínas y miméticos relacionados, y métodos para la síntesis de glicopéptidos, glicoproteínas y miméticos relacionados.
Antecedentes de la invención
La modificación post-traducción de las proteínas mediante glicosilación puede afectar el desdoblamiento y la estabilidad de las proteínas, modificar la actividad intrínseca de las proteínas, y modular sus interacciones con otras biomoléculas. Ver, p. ej., Varki, A. (1993) Glycobiology 3:97-130. Las glicoproteínas naturales se encuentran presentes frecuentemente como una población de muchas glicoformas diferentes, lo cual hace difícil el análisis de la estructura del glicano y el estudio de los efectos de glicosilación en la estructura y función de las proteínas. En consecuencia, son necesarios métodos para la síntesis de proteínas naturales y no naturales homogéneamente glicosiladas para la comprensión sistemática de la función del glicano, y para el desarrollo de mejores terapéuticos de glicoproteínas.
Un procedimiento previamente conocido para elaborar proteínas que tienen los patrones de glicosilación deseados hace uso de glicosidasas para convertir una glicoproteína heterogénea natural en un simple núcleo homogéneo, sobre el cual los sacáridos pueden injertarse en secuencia con glicosiltransferasas. Ver, p. ej., Witte, K., et al., (1997) J. Am. Chem. Soc. 119:2114-2118. Una limitación de este procedimiento es que los sitios principales de glicosilación se encuentran predeterminados por la línea celular en la cual se expresa la proteína. Alternativamente, un glicopéptido que contiene la estructura de glicano deseada puede sintetizarse mediante síntesis de péptido en fase sólida. Este glicopéptido puede acoplarse a otros péptidos o a fragmentos de proteína recombinante para producir una glicoproteína más grande mediante ligación química natural, (ver, p. ej., Shin, Y., et al., (1999) J. Am. Chem. Soc. 121:11684-11689) ligación de proteína expresada, (ver, p. ej., Tolbert, T.J., y Wong, C.H. (2000) J. Am. Chem. Soc. 122:5421-5428), o con proteasas diseñadas. Ver, p. ej., Witte, K., et al., (1998) J. Am. Chem. Soc. 120:1979-1989. Tanto la ligación química natural como la ligación de proteína expresada son muy efectivas con proteínas pequeñas, y necesitan un residuo de cisteína en la terminal N del glicopéptido. Cuando se utiliza una proteasa para ligar péptidos entre sí, el sitio de ligación debe colocarse alejado del sitio de glicosilación para producir buen acoplamiento, Ver, p. ej., Witte, K., et al., (1998) J. Am. Chem. Soc. 120:1979-1989. Un tercer procedimiento es modificar las proteínas con sacáridos directamente utilizando métodos químicos. Puede lograrse una buena selectividad con derivados sacáridos de haloacetamida, que se acoplan al grupo tiol de cisteína, (ver, p. ej., Davis, N. J. y Flitsch, S.L. (1991) Tetrahedron Lett. 32:6793-6796; y Macmillan, D., et al., (2002) Org. Lett 4:1467-1470), pero este método puede volverse problemático con proteínas que tiene más de un residuo de cisteína.
De acuerdo con esto, existe la necesidad de métodos mejorados para elaborar glicoproteínas que tienen un patrón de glicosilación deseado. La invención cumple esta y otras necesidades, como será aparente al revisar la siguiente descripción.
Resumen de la invención
La invención proporciona métodos para la síntesis de glicoproteínas. Estos métodos implican, en algunas realizaciones, incorporar en una proteína un aminoácido no natural que comprende un primer grupo reactivo; y poner en contacto la proteína con un residuo sacárido que comprende un segundo grupo reactivo, en donde el primer grupo reactivo reacciona con el segundo grupo reactivo para unir el residuo sacárido al aminoácido no natural. Las glicoproteínas producidas mediante estos métodos también se incluyen en la invención. El primer grupo reactivo, es en algunas realizaciones, un residuo electrofílico (p. ej., un residuo ceto, un residuo aldehído, y/o lo similar) y el segundo grupo reactivo es un residuo nucleofílico. En algunas realizaciones, el primer grupo reactivo es un residuo nucleofílico y el segundo grupo reactivo es un residuo electrofílico (p. ej., un residuo ceto, un residuo aldehído, y/o lo similar). Por ejemplo, un residuo electrofílico se une al residuo sacárido y el residuo nucleofílico se une al aminoácido no natural. El residuo sacárido puede incluir un solo residuo de carbohidrato, o el residuo sacárido puede incluir dos o más residuos de carbohidrato.
En algunas realizaciones, los métodos implican además poner en contacto el residuo sacárido con una glicosiltransferasa, un residuo donante de azúcar, y otros reactivos requeridos para la actividad de la glicosiltransferasa durante un tiempo suficiente y bajo las condiciones apropiadas para transferir un azúcar desde el residuo donante de azúcar hacia el residuo sacárido. El producto de esta reacción, si se desea, puede ponerse en contacto mediante al menos una segunda glicosiltransferasa, junto con el residuo donante de azúcar apropiado.
En ciertas realizaciones, el método comprende además poner en contacto el residuo sacárido con una o más de una ß1-4N-acetilglucosaminiltransferasa, una a1,3fucosiltransferasa, una a1,2fucosiltransferasa, una a1,4fucosiltransfe- rasa, una ß1-4galactosiltransferasa, una sialiltransferasa, y/o lo similar, para formar una estructura de oligosacárido biantenaria o triantenaria.
En una realización, el residuo sacárido comprende un GlcNAc terminal, el residuo donante de azúcar es UDP-Gal y la glicosiltransferasa es una ß-1,4-galactosiltransferasa. En una realización, el residuo sacárido comprende un GlcNAc terminal, el residuo donante de azúcar es UDP-GlcNAc y la glicosiltransferasa es una ß1-4N-acetilglucosaminiltransferasa. Opcionalmente, el método comprende además poner en contacto el producto de la reacción de N-acetilglucosaminiltransferasa con una ß1-4manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Manß1-4GlcNAcß1-4GlcNAc-. Opcionalmente, el método comprende además poner en contacto el residuo Manß1-4GlcNAcß1-4GlcNAc- con una a1-3manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Mana1-3Manß1-4GlcNAcß1-4GlcNAc-. Opcionalmente, el método comprende además poner en contacto el residuo Mana1-3Manß1-4GlcNAcß1-4GlcNAc- con una a1-6manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Mana1-6(Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-. Opcionalmente, el método comprende además poner en contacto el residuo Mana1-6(Mana1-3)Manß1-4GlcNAcß1-4GlcNAc- con una ß1-2N-acetilglucosaminiltransferasa y UDP-GlcNAc para formar un residuo sacárido que comprende Mana1-6(GlcNAcß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-. Opcionalmente, el método comprende además poner en contacto el residuo Mana1-6(GlcNAcß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAc- con una ß1-2N-acetilglucosaminiltransferasa y UDP-GlcNAc para formar un residuo sacárido que comprende GlcNAcß1-2Mana1-6(GlcNAcß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-.
La etapa de incorporación en una proteína de un aminoácido no natural que comprende un primer grupo reactivo, en algunas realizaciones, comprende utilizar un par ARNt ortogonal/aminoacil ortogonal-ARNt sintetasa (O-ARNt/O-RS), en donde el O-ARNt reconoce un codón selector e incorpora el aminoácido no natural dentro de la proteína en respuesta al codón selector, y en donde la O-RS preferentemente aminoacila el O-ARNt con el aminoácido no natural. Por ejemplo, el O-RS comprende una secuencia de aminoácidos que comprende cualquiera de las SEQ ID NO.: 1, 2 o 3. Opcionalmente, el O-ARNt comprende un mutARNTyr CUA. En algunas realizaciones el aminoácido no natural se incorpora en el polipéptido in vivo.
La invención proporciona también glicoproteínas que comprenden un residuo sacárido y un polipéptido. En ciertas realizaciones en las glicoproteínas de la invención, el residuo sacárido se une al polipéptido mediante un producto de reacción de una reacción nucleofílica entre un primer grupo reactivo unido a un aminoácido no natural presente en el polipéptido y un segundo grupo reactivo unido al residuo sacárido. En ciertas realizaciones, el primer grupo reactivo es un residuo electrofílico (p. ej., residuo ceto, residuo aldehído, y/o lo similar) y el segundo grupo reactivo es un residuo nucleofílico.
En ciertas realizaciones, el residuo nucleofílico de la invención incluye, pero no se limita a, hidrazida, hidroxilamina,...
Reivindicaciones:
1. Método para la síntesis de una glicoproteína, comprendiendo el método:
a) incorporar en una proteína un aminoácido no natural que comprende un primer grupo reactivo; en el que la etapa de incorporación comprende la incorporación del aminoácido no natural en la proteína con un par ARNt ortogonal/aminoacil ortogonal-ARNt sintetasa (O-ARNt/O-RS), en el que el O-ARNt reconoce un codón selector e incorpora el aminoácido no natural en la proteína como respuesta al codón selector, y en el que los ORS aminoacilan el O-ARNt con el aminoácido natural; y,
b) poner en contacto la proteína con un residuo sacárido que comprende un segundo grupo reactivo, en donde el primer grupo reactivo reacciona con el segundo grupo reactivo para unir el residuo sacárido al aminoácido no natural, produciendo por tanto la glicoproteína.
2. Método de la reivindicación 1, en el que el primer grupo reactivo es un residuo electrofílico y el segundo grupo reactivo es un residuo nucleofílico.
3. Método de la reivindicación 2, en el que:
- (a) el residuo electrofílico es un residuo ceto o un residuo aldehído; y/o
- (b) el residuo nucleofílico se selecciona del grupo que consiste en:
4. Método de la reivindicación 4, en el que el residuo nucleofílico se selecciona del grupo que consiste en hidrazida, hidroxilamina, semicarbazida y carbohidrazida.
5. Método de la reivindicación 2, en el que el producto de reacción comprende una oxima, una amida, una hidrazona, una carbohidrazona, una tiocarbohidrazona, una sulfonilhidrazona, una semicarbazona o una tiosemicarbazona.
6. Método de la reivindicación 6, en el que el producto de reacción comprende una hidrazona reducida.
7. Método de la reivindicación 1, en el que el primer grupo reactivo es un residuo nucleofílico y el segundo grupo reactivo es un residuo electrofílico.
8. Método de la reivindicación 8, en el que el residuo electrofílico es un residuo ceto o aldehído.
9. Método de la reivindicación 1, en el que el residuo sacárido comprende dos o más residuos de carbohidrato.
10. Método de la reivindicación 1, que comprende además:
c) poner en contacto el residuo sacárido con una glicosiltransferasa, un residuo donante de azúcar, y otros reactivos requeridos para la actividad de glicosiltransferasa durante un tiempo suficiente y bajo las condiciones apropiadas para transferir un azúcar proveniente del residuo donante de azúcar hacia el residuo sacárido.
11. Método de la reivindicación 11, en el que
(a) la glicosiltransferasa se selecciona del grupo que consiste en una galactosiltransferasa, una fucosiltransferasa, una glucosiltransferasa, una N-acetilgalactosaminiltransferasa, una N-acetilglucosaminiltransferasa, una glucuroniltransferasa, una sialiltransferasa, una manosiltransferasa, una transferasa de ácido glucurónico, una transferasa de ácido galacturónico, y una oligosacariltransferasa, o
(b) el método comprende además poner en contacto un producto de la etapa (c) con al menos una segunda glicosiltransferasa y un segundo residuo donante de azúcar; o
(c) el método comprende además poner en contacto el residuo sacárido con una o más ß1-4N-acetilglucosaminiltransferasa, una a1,3fucosiltransferasa, una a1,2fucosiltransferasa, una a1,4fucosiltransferasa, una ß1-4galactosiltransferasa, una sialiltransferasa, para formar una estructura de oligosacárido biantenaria o triantenaria.
12. Método de la reivindicación 10, en el que
- (a) el residuo sacárido comprende un GlcNAc terminal, el residuo donante de azúcar es UDP-Gal y la glicosiltransferasa es una ß-1,4-galactosiltransferasa; o
- (b) el residuo sacárido comprende un GlcNAc terminal, el residuo donante de azúcar es UDP-GlcNAc y la glicosiltransferasa es una ß1-4N-acetilglucosaminiltransferasa.
13. Método de la reivindicación 12(b), en el que el método comprende además poner en contacto el producto de la reacción de N-acetilglucosaminiltransferasa con una ß1-4manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Manß1-4GlcNAcß1-4GlcNAc-.
14. Método de la reivindicación 13, en el que el método comprende además poner en contacto el residuo Manß1-4GlcNAcß1-4GlcNAc- con una a1-3manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Mana1-3Manß1-4GlcNAcß1-4GlcNAc-.
15. Método de la reivindicación 14, en el que el método comprende además poner en contacto el residuo Mana1-3Manß1-4GlcNAcß1-4GlcNAc- con una a1-6manosiltransferasa y GDP-manosa para formar un residuo sacárido que comprende Mana1-6(Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-.
16. Método de la reivindicación 15, en el que el método comprende además poner en contacto el residuo Mana1-6(Mana1-3)Manß1-4GlcNAcß1-4GlcNAc- con una ß1-2N-acetilglucosaminiltransferasa y UDP-GlcNAc para formar un residuo sacárido que comprende Mana1-6(GlcNAcß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-.
17. Método de la reivindicación 16, en el que el método comprende además poner en contacto el residuo Mana1-6(GlcNacß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAcß1-4GlcNAc- con una ß1-2N-acetilglucosaminiltransferasa y UDP-GlcNAc para formar un residuo sacárido que comprende GlcNAcß1-2Mana1-6(GlcNAcß1-2Mana1-3)Manß1-4GlcNAcß1-4GlcNAc-.
18. Método de la reivindicación 1, en el que el sistema de traducción comprende una célula.
19. Método de la reivindicación 1, en el que el sistema O-RS comprende una secuencia de aminoácidos que comprende cualquiera de las SEQ ID NO.: 1, 2 ó 3.
20. Método de la reivindicación 23, en el que el O-ARNt comprende un mutARN Tyr CUA (SEQ ID NO: 7).
21. Método de la reivindicación 1, en el que:
(a) incorporar el aminoácido no natural en la proteína comprende aminoacilar le OtARN con el aminoácido no natural; o
(b) incorporar el aminoácido no natural en la proteína comprende:
aminoacilar el OtARN con el aminoácido no natural, utilizando la ORS, en el que la ORS aminoacila el OtRNA más eficazmente que el ORS aminoacilata cualquier tARN endógeno del sistema de traducción y en el que el ORS aminoacilata el OtARN más eficazmente con el aminoácido no natural que con el aminoácido natural.
22. Método de la reivindicación 1, comprendiendo además la purificación de la glicoproteína.
23. Método de la reivindicación 1, en el que la glicoproteína se produce en una célula o lisado celular.
24. Método de la reivindicación 1, en el que se producen al menos aproximadamente 10 µg de glicoproteína.
25. Método de la reivindicación 1, en el que la glicoproteína se produce en una célula o lisado celular en una concentración de al menos aproximadamente 10 µg/litro.
26. Glicoproteína que comprende dos o más residuos polisacáridos unidos a dos o más aminoácidos no naturales en la glicoproteína, en la que el residuo sacárido se une al polipéptido mediante un producto de reacción de una reacción nucleofílica entre un primer grupo reactivo unido a un aminoácido no natural presente en el polipéptido y un segundo grupo reactivo unido al residuo sacárido.
27. Glicoproteína de la reivindicación 26, en la que el primer grupo reactivo es un residuo electrofílico y el segundo grupo reactivo es un residuo nucleofílico.
28. Glicoproteína de la reivindicación 26 o la reivindicación 27, en la que los residuos polisacáridos son iguales, o en el que los aminoácidos no naturales son los iguales.
29. Glicoproteína de la reivindicación 26 o la reivindicación 27, en la que los residuos polisacáridos son diferentes, o en el que los aminoácidos no naturales son los diferentes.
30. Glicoproteína de cualquiera de las reivindicaciones 26 a 29, en la que la glicoproteína comprende tres o más residuos polisacáridos unidos a tres o más aminoácidos no naturales en la glicoproteína.
31. Glicoproteína de la reivindicación 26, en la que:
(a) el residuos electrofílico es un residuo ceto o aldehído; y/o
(b) el residuo nucleofílico se selecciona del grupo que consiste en: -NR1-NH2(hidrazida), -NR1(C=O)NR2NH2 (semicarbazida), -NR1(C=S)NR2NH2(tiosemicarbazida), -(C=O) NR1NH2(carbonilhidrazida), -(C=S)NR1NH2(tiocarbonilhidrazida), -(SO2)NR1NH2(sulfonilhidrazida), -NR1NR2(C=O)NR3NH2(carbazida), -NR1NR2(C=S) NR3NH2(tiocarbazida) o -O-NH2(hidroxilamina, en donde cada R1, R2 y R3 es independientemente H, o alquilo que tiene de 1-6 carbonos.
32. Glicoproteína de la reivindicación 27, en la que el residuo nucleofílico se selecciona del grupo que consiste en hidrazida, hidroxilamina, semicarbazida y carbohidrazida.
33. Glicoproteína de la reivindicación 28, en la que el producto de reacción comprende una oxima, una amida, una hidrazona, una carbohidrazona, una tiocarbohidrazona, una sulfonilhidrazona, una semicarbazona o una tiosemicarbazona.
34. Glicoproteína de la reivindicación 33, en la que el producto de reacción comprende una hidrazona reducida.
35. Glicoproteína de cualquiera de las reivindicaciones 26 a 34, presente en una célula o lisado celular.
36. Glicoproteína de cualquiera de las reivindicaciones 26 a 34, en la que la glicoproteína se produce utilizando un sistema de traducción en una célula.
37. Método para sintetizar una glicoproteína, comprendiendo el método la incorporación en una proteína de un aminoácido no natural que comprende un residuo sacárido, en el que el método comprende además poner en contacto el residuo sacárido con una glicosiltransferasa recombinante, un residuo donante de azúcar, y otros reactivos requeridos para la actividad de la glicosiltransferasa durante un tiempo suficiente y bajo las condiciones apropiadas para transferir un azúcar desde el residuo donante de azúcar hacia el residuo sacárido.
38. Método de la reivindicación 37, en el que la glicosiltransferasa se selecciona del grupo que consiste en una galactosiltransferasa, una fucosiltransferasa, una glucosiltransferasa, una N-acetilgalactosaminiltransferasa, una N-acetilglucosaminiltransferasa, una glucuroniltransferasa, una sialiltransferasa, una manosiltransferasa, una transferasa de ácido glucurónico, una transferasa de ácido galacturónico, y una oligosacariltransferasa.
39. Método de la reivindicación 37, en el que
(a) el método comprende además poner en contacto el producto de la reacción de glicosiltransferasa con al menos una segunda glicosiltransferasa y un segundo residuo donante de azúcar, o
(b) el residuo sacárido comprende una GlcNAc terminal, el residuo donante de azúcar es UDP-GlcNAc y la glicosiltransferasa es una ß1-4N-acetilglucosaminiltransferasa, o
(c) el residuo sacárido comprende una GlcNAc terminal, el residuo donante de azúcar es UDP-Gal y la glicosiltransferasa es una ß1-4-galactosiltransferasa.
40. Método de la reivindicación 37, en el que la etapa de incorporación comprende utilizar un par ARNt ortogonal/aminoacil ortogonal-ARNt sintetasa (O-ARNt/O-RS), en donde el O-ARNt reconoce un codón selector e incorpora el aminoácido no natural dentro de la proteína en respuesta al codón selector, y en donde la O-RS preferentemente aminoacila el O-ARNt con el aminoácido no natural.
41. Método de la reivindicación 41, en el que
la O-RS comprende una secuencia de aminoácidos que comprende cualquiera de las SEQ ID NO.: 4, 5 o 6.
el O-ARNt comprende un muARN Tyr CUA (SEQ ID NO:7).
42. Método de la reivindicación 37, en el que
(a) la etapa de incorporación es in vivo; o
(b) el aminoácido no natural comprende una ß-O-GlcNAc-L-serina, una tri-acetil-ß-GlcNAc-serina, una tri-O-acetil-GalNAc-a-treonina, o una a-GalNAc-L-treonina.
43. Célula huésped para sintetizar una glicoproteína, la célula huésped comprendiendo:
a) un aminoácido no natural que comprende un residuo sacárido;
b) un ARNt ortogonal que reconoce un codón selector;
c) una ARNt sintetasa de aminoacilo ortogonal (O-RS) que cataliza la unión del aminoácido no natural al ARNt ortogonal;
d) un polinucleótido que codifica una glicosiltransferasa recombinante; y
e) una secuencia de polinucleótidos que codifica para un polipéptido y comprende al menos un codón selector.
44. Célula huésped de la reivindicación 47, en la que
(a) la glicosiltransferasa recombinante se selecciona del grupo que consiste en: una galactosiltransferasa, una fucosiltransferasa, una glucosiltransferasa, una N-acetilgalactosaminiltransferasa, una N-acetilglucosaminiltransferasa, una glucuroniltransferasa, una sialiltransferasa, una manosiltransferasa, una transferasa de ácido glucurónico, una transferasa de ácido galacturónico, y una oligosacariltransferasa; y/o
(b) la célula huésped es una célula de mamífero, una célula de levadura, una célula bacterial, una célula vegetal, una célula de hongo, una célula arqueobacterial, o una célula de insecto.
45. Composición que comprende un sistema de traducción, comprendiendo el sistema de traducción un ARNt ortogonal (O-ARNt) y una ARNt sintetasa de aminoacilo ortogonal (O-RS),
en la que la O-RS preferentemente aminoacila el O-ARNt con un aminoácido no natural que comprende un residuo sacárido y el O-ARNt reconoce al menos un codón selector, en la que el aminoácido no natural comprende un aminoácido treonina que comprende un residuo Man, Gal, GalNac, Glc, GlcNAc p Fuc, o un aminoácido serina que comprende un residuo Man o Fuc.
46. Composición de la reivindicación 45, en la que
(a) la O-RS comprende una secuencia de aminoácidos que comprende un mutARN Tyr CUA (SEQ ID NO.: 7) o
(b) el aminoácido no natural comprende un tri-O-acetil-GalNac-a-treonina, o un a-GalNAc-L-treonina.
47. Polipéptido artificial seleccionado del grupo que consiste en:
(a) un polipéptido que comprende una secuencia de aminoácidos como se muestra en cualquiera de las SEQ ID NO.: 4-6;
(b) un polipéptido que comprende una secuencia de aminoácidos codificada por una secuencia de polinucleótidos como se muestra en cualquiera de las SEQ ID NO.: 8-10;
(c) un polipéptido que es específicamente inmunorreactivo con un anticuerpo específico para un polipéptido de (a), o (b); y
(d) una secuencia de aminoácidos que comprende una variante conservadora de (a), (b) o (c).
48. Polinucleótido artificial seleccionado del grupo que consiste en:
(a) un polinucleótido que comprende una secuencia de nucleótidos como se establece en cualquiera de las SEQ ID NO.: 8-10;
(b) un polinucleótido que es complementario, o que codifica para una secuencia de polinucleótidos de (a);
(c) un polinucleótido que codifica para un polipéptido que comprende, una secuencia de aminoácidos como se establece en cualquiera de las SEQ ID NO.: 1-6, o una variante conservadora de la misma;
(d) un polinucleótido que codifica para un polipéptido de la reivindicación 55;
(e) un ácido nucleico que se híbrida a un polinucleótido de (a), (b), (c), o (d) bajo condiciones altamente rigurosas sobre sustancialmente la longitud total del ácido nucleico;
(f) un polinucleótido que es al menos 98% idéntico a un polinucleótido de (a), (b), (c), (d) o (e); y
(h) un polinucleótido que comprende una variante conservadora de (a), (b), (c), (d), (e) o (f),
en el que el polinucleótido codifica un RS que aminoacila un tARN con ß-GlcNAc-Serina.
49. Polinucleótido de la reivindicación 48, en el que el polinucleótido es un ácido nucleico que comprende una subsecuencia e polinucleótido correspondiente a SEQ. ID NO: 8.
50. Polineucleótido de la reivindicación 49, en el que el vector es un vector de expresión que comprende un promotor enlazado operablemente a la subsecuencia que comprende SEQ ID NO:8.
51. Equipo que comprende:
un RS que aminoacila un TARN con ß-GlcNAc-Serina;
un polinucleótido que codifica un RS que aminoacila un tARN con ß-GlcNAc-Serina;
un vector que comprende un polinucleótido que codifica un RS que aminoacila un tARN con ß-GlcNAc-Serina; o
un sistema de traducción que comprende un RS que aminoacila un tARN con ß-GlcNAc-Serina o un polinucleótido que codifica un RS que aminoacila un tARN con ß-GlcNAc-Serina.
52. Equipo de la reivindicación 51, en el que el RS, polinucleótido, vector o sistema de traducción está envasado en un recipiente.
Patentes similares o relacionadas:
SÍNTESIS DEL ÁCIDO SIÁLICO EN PLANTAS, del 21 de Noviembre de 2011, de MEDICAGO INC. CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE DE ROUEN: Un método para sintetizar el ácido siálico que comprende, i) cultivo de una planta transgénica que comprende una secuencia de nucleótidos codificadora de la sintasa del […]
MEJORA DE LA CALIDAD DEL PRODUCTO EN PROCEDIMIENTOS DE CULTIVO DE CÉLULAS DE MAMÍFERO PARA LA PRODUCCIÓN DE PROTEÍNAS, del 16 de Marzo de 2011, de BRISTOL-MYERS SQUIBB COMPANY: Un procedimiento de cultivo celular para la producción de una molécula de CTLA4 soluble, que comprende: a) cultivar células CHO que producen […]
 PROTEÍNAS N-GLICOSILADAS RECOMBINANTES DE CÉLULAS PROCARIOTAS, del 7 de Marzo de 2011, de ETH ZURICH: Un método para producir proteínas glicosiladas N-enlazadas, que comprende: a) proporcionar ácidos nucleicos que codifican al menos una proteína diana recombinante, […]
PROTEÍNAS N-GLICOSILADAS RECOMBINANTES DE CÉLULAS PROCARIOTAS, del 7 de Marzo de 2011, de ETH ZURICH: Un método para producir proteínas glicosiladas N-enlazadas, que comprende: a) proporcionar ácidos nucleicos que codifican al menos una proteína diana recombinante, […]
MÉTODO PARA FABRICACIÓN DE GLICOPROTEÍNAS QUE TIENEN GLICOSILACIÓN DE TIPO HUMANO, del 17 de Enero de 2011, de PHYTON HOLDINGS, LLC: Un método de expresar una glicosiltransferasa y una glicoproteína exógena que tienen una cadena de azúcar de tipo humano en una célula de planta transformada, […]
 TRANSPORTADOR DE FUCOSA, del 26 de Noviembre de 2010, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Célula de hámsteres chino DXB11 en la que se destruye un gen transportador de fucosa
TRANSPORTADOR DE FUCOSA, del 26 de Noviembre de 2010, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Célula de hámsteres chino DXB11 en la que se destruye un gen transportador de fucosa
SIALIDASA RECOMBINANTE DE CELULA CHO, del 21 de Octubre de 2010, de GENENTECH, INC.: UNA LINEA CELULAR RECOMBINANTE TIENE UNA SIALIDASA CONSTITUTIVA CUYA EXPRESION FUNCIONAL SE INTERRUMPE POR EJEMPLO POR RECOMBINACION HOMOLOGA O UTILIZANDO RNA ANTI-SENTIDO. LA […]
 INGENIERIA DE GLICOSILACION DE ANTICUERPOS PARA LA MEJORA DE LA CITOTOXICIDAD CELULAR DEPENDIENTE DE ANTICUERPOS, del 28 de Mayo de 2010, de UMANA, PABLO
JEAN-MAIRET, JOEL
BAILEY, JAMES E: Un procedimiento in vitro o ex vivo para la producción de un anticuerpo recombinante que presenta mayor citotoxicidad celular mediada por Fc, que comprende:
(i) proporcionar […]
INGENIERIA DE GLICOSILACION DE ANTICUERPOS PARA LA MEJORA DE LA CITOTOXICIDAD CELULAR DEPENDIENTE DE ANTICUERPOS, del 28 de Mayo de 2010, de UMANA, PABLO
JEAN-MAIRET, JOEL
BAILEY, JAMES E: Un procedimiento in vitro o ex vivo para la producción de un anticuerpo recombinante que presenta mayor citotoxicidad celular mediada por Fc, que comprende:
(i) proporcionar […]
GLICOINGENIERIA EN SETAS, del 6 de Mayo de 2010, de PLANT RESEARCH INTERNATIONAL B.V.: Un método para producir una glicoproteína en una célula huésped recombinante, que comprende permitir la expresión de dicha glicoproteína en un huésped […]