PROFARMACOS DE ACILOXIALQUILCARBAMATO DEL ACIDO TRANEXAMICO Y USO DE LOS MISMOS.
Un compuesto de Fórmula (I):
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/023873.
Solicitante: XENOPORT, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3410 CENTRAL EXPRESSWAY,SANTA CLARA, CA 95051.
Inventor/es: GALLOP, MARK, A., JANDELEIT,BERND, LI,YUNXIAO, ZERANGUE,NOA.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07C271/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 271/00 Derivados del ácido carbámico, es decir, compuestos que contienen uno de los grupos en que el átomo de nitrógeno no forma parte de grupos nitro o nitroso. › a átomos de carbono de radicales hidrocarbonados sustituidos por grupos carboxilo.
Clasificación PCT:
- C07C271/22 C07C 271/00 […] › a átomos de carbono de radicales hidrocarbonados sustituidos por grupos carboxilo.
Fragmento de la descripción:
Profármacos de aciloxialquilcarbamato del ácido tranexámico y uso de los mismos.
Campo técnico
La divulgación se refiere a profármacos de aciloxialquil carbamato del ácido trans-4-(aminometil)-ciclohexanocarboxílico y composiciones farmacéuticas del mismo para tratar diversas enfermedades o trastornos. La divulgación también se refiere a dichos profármacos adecuados para su administración oral y tópica incluyendo para su administración oral usando formas farmacéuticas de liberación sostenida.
Antecedentes
Ácido tranexámico (1) (ácido trans-4-(aminometil)-ciclohexanocarboxílico, Cyklokapron®):

es un agente antifibrinolítico que bloquea de forma reversible sitios de unión a lisina en el plasminógeno y la plasmina y actúa previniendo la degradación proteolítica de coágulos de fibrina que se forman en los procesos de homeostasis fisiológicos normales. Tanto el plasminógeno como la plasmina son activadores de la fibrinolisis y agentes activos lisantes de coágulos. Por lo tanto, el ácido tranexámico ayuda a estabilizar los coágulos de fibrina, lo que a su vez mantiene la coagulación y ayuda a controlar el sangrado.
El ácido tranexámico se usa clínicamente para controlar el exceso de sangrado, por ejemplo, un sangrado intenso asociado con cirugía cardiaca, hemorragia gastrointestinal superior, pérdida de sangre en pacientes con cáncer avanzado (tanto acontecimientos hemorrágicos agudos como sangrado crónico de escaso volumen), sangrado excesivo que se produce durante procedimientos dentales en hemofílicos y para sangrado intenso durante la menstruación, es decir, menorragia (véase Wellington y Wagstaff, Drugs, 2003, 63, 1417-1433; Dunn y Goa, Drugs, 1999, 57, 1005-1032; Pereira y Phan, The Oncologist, 2004, 9, 561-570).
La importancia de la cascada proteolítica de plasminógeno/plasmina en la biología y la fisiopatología epidérmica también está bien valorada (Kramer y col., Biol. Chem. Hoppe-Seylar, 1995, 3, 131-141). La rotura del estrato córneo por lesión mecánica o química induce la actividad proteolítica epidérmica. El tratamiento tópico de piel humana o de roedor con ácido tranexámico acelera significativamente la recuperación de la barrera y disminuye enormemente la hiperplasia epidérmica, sugiriendo un papel para compuestos inhibidores de plasmina en la estimulación de la cicatrización de heridas epidérmicas (Denda y col., J. Invest. Dermatol., 1997, 109, 84-90; Kitamura y col., J. Soc. Cosmet. Chem., 1995, 29, 133-145). La exposición de piel humana a radiación ultravioleta causa eritema y pigmentación, siendo la pigmentación el resultado de una producción de melanina aumentada. También se ha demostrado un papel para la plasmina en la contribución a una producción aumentada de ácido araquidónico y metabolitos de prostaglandina en la piel después de exposición UV. La aplicación tópica de ácido tranexámico previene la pigmentación inducida por UV in vivo por medio de una reducción dependiente de la dosis de la producción de prostaglandina (Maeda y Naganuma, J. Photochem. Photobiol. B, 1998, 47, 136-141; Manosroi y col., J. Cosmet. Sci., 2002, 53, 375-386; Suetsugu y col., Patente de Estados Unidos Nº 5.690.914).
El sistema de activación de plasminógeno también es una ruta de proteasas predominante responsable de la degradación de la matriz extracelular (ECM). La diseminación del cáncer y la metástasis son sinónimos de migración celular invasiva, un proceso en el que la ECM desempeña el doble papel de sustrato en el que se mueve la célula, así como el obstáculo físico que las células tienen que superar. Para degradar el obstáculo físico que representa la ECM en la dirección de la migración, las células usan enzimas proteolíticas tales como plasminógeno y plasmina capaces de hidrolizar los componentes de la ECM (Stonelake y col., Br. J. Cancer, 1997, 75, 951-959; Dunbar y col., Expert Opin. Investig. Drugs, 2000, 9, 2085-2092; Sidenius y Blasi, Cancer Metastasis Rev., 2003, 22, 205-222). Los compuestos inhibidores de plasmina tales como ácido tranexámico, por lo tanto, muestran utilidad como agentes antimetastásicos en solitario o en combinación con agentes anticancerosos citotóxicos (Tsutsumi y Konishi, Jpn. Kokai Tokkyo Koho, 2002114673).
La menorragia se define como una pérdida de sangre >80 ml por ciclo menstrual y afecta a muchas mujeres y representa un problema de salud significativo. Se cree que los índices de prevalencia son similares por todo el mundo occidental, y en el Reino Unido al menos una de cada 20 mujeres de edades comprendidas entre los 34 y 49 años consultará a su médico general debido a trastornos menstruales. La menorragia representa el 60% de las consultas de atención primaria para problemas menstruales y el 12% de todas las remisiones a ginecología (Peto y col., Fam. Pract., 1993, 10, 207-211; McPherson y Andersson, eds., Women's problems in general, practice, Oxford: Oxford University Press, 1983, pp 21-41; Bradlow y col., Patterns of referral, Oxford: Oxford Health Services Research Unit, 1992). Aunque diversos mecanismos patológicos pueden contribuir a la causa de la menorragia, aproximadamente el 50% de las mujeres con pérdida de sangre menstrual intensa no tienen anomalías anatómicas o endocrinológicas subyacentes. En dichas mujeres la actividad fibrinolítica en el útero es superior que en mujeres con pérdida de sangre menstrual normal, siendo esta fibrinolisis aumentada el resultado de niveles elevados de activadores de plasminógeno y plasmina derivados del endometrio (Gleeson, Am. I. Obstet. Gynecol., 1994, 171, 178-183; Dockeray y col., Eur. J. Obstet. Gynecol. Reprod. Biol., 1987, 24, 309-318).
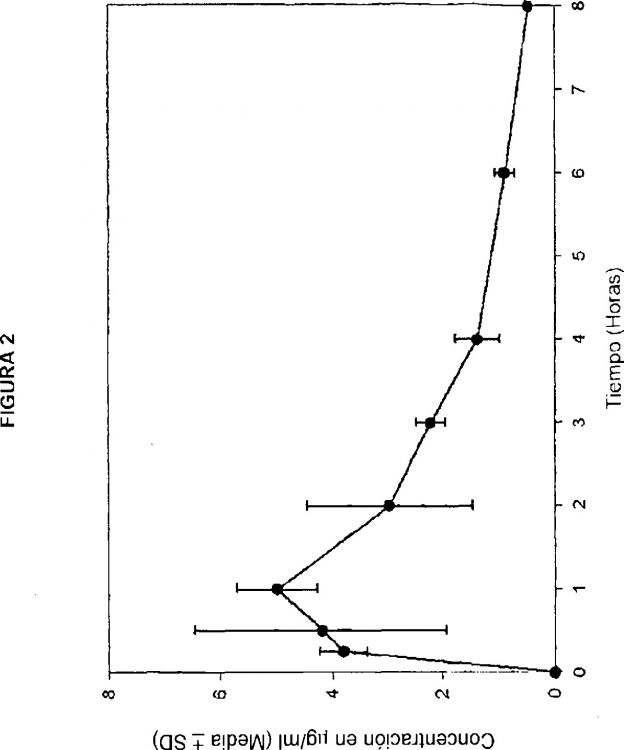
A pesar de la disponibilidad de agentes antifibrinolíticos clínicamente eficaces tales como ácido tranexámico (que se ha demostrado que reduce la pérdida de sangre menstrual ~50%), aproximadamente el 60% de las mujeres con menorragia se someten a histerectomía en un plazo de 5 años desde su remisión a un ginecólogo (Coulter y col., Br. J. Obstet. Gynaecol., 1991, 98, 789-796). Típicamente, las mujeres que padecen menorragia se tratan por vía oral con ácido tranexámico simultáneamente con la menstruación (4-7 días). Son típicas dosis de comprimidos de ácido tranexámico de 500-1500 mg administrados tres o cuatro veces al día. También están disponibles formulaciones de dosificación intravenosa para su uso como infusión continua en el entorno quirúrgico. La necesidad de administración oral diaria frecuente es el resultado de las propiedades farmacocinéticas subóptimas del ácido tranexámico, que incluyen una biodisponibilidad oral modesta (~30%) y una semivida de eliminación terminal rápida de ~2 horas.
Las formulaciones de dosificación oral de liberación sostenida son una solución convencional al problema del aclaramiento de fármaco sistémico rápido, como se conoce bien en la técnica (Véase, por ejemplo, "Remington's Pharmaceutical-Sciences", Philadelphia College of Pharmacy and Science, 19ª Edición, 1995). Los sistemas de administración osmótica también son procedimientos reconocidos para administración de fármacos sostenida (véase, por ejemplo, Verma y col., Drug Dev. Ind. Pharm., 2000, 26, 695-708). La aplicación con éxito de estas tecnologías depende del fármaco de interés que tiene un nivel eficaz de absorción desde el intestino grueso (también denominado en este documento colon), donde la forma farmacéutica pasa la mayor parte de su tiempo durante su paso a través del tracto gastrointestinal. El ácido tranexámico se absorbe muy poco después de su administración rectal en seres humanos (Almer y col., J. Clin. Pharm., 1992, 32, 49-54), que concuerda con una permeabilidad limitada del fármaco a través de la mucosa del colon. El desarrollo de una formulación de liberación controlada oral para el ácido tranexámico debería mejorar considerablemente el perfil de comodidad, eficacia y efectos secundarios de la terapia con ácido tranexámico. Sin embargo, el paso rápido de las formas farmacéuticas convencionales a través de la región de absorción proximal del intestino delgado ha impedido hasta ahora la aplicación con éxito de tecnologías de liberación sostenida a este fármaco. Heasley y col. han descrito formulaciones orales de liberación retardada de ácido tranexámico basadas en el uso de recubrimientos poliméricos entéricos que están diseñados para retrasar la disolución del fármaco 1-2 horas hasta que la forma farmacéutica haya pasado desde el estómago...
Reivindicaciones:
1. Un compuesto de Fórmula (I):

una sal farmacéuticamente aceptable del mismo o un solvato farmacéuticamente aceptable de cualquiera de los anteriores, en la que:
R1 se selecciona entre alquilo C1-6, alquilo C1-6 sustituido, arilo C6-10, arilo C6-10 sustituido, cicloalquilo C3-7, cicloalquilo C3-7 sustituido, arilalquilo C7-16 y arilalquilo C7-16 sustituido;
R2 y R3 se seleccionan independientemente entre hidrógeno, alquilo C1-6, alquilo C1-6 sustituido, arilo C6-10, arilo C6-10 sustituido, cicloalquilo C3-7 y cicloalquilo C3-7 sustituido;
R4 se selecciona entre hidrógeno, alquilo C1-6, alquilo C1-6 sustituido, cicloalquilo C3-7, cicloalquilo C3-7 sustituido, arilo C6-10, arilo C6-10 sustituido, arilalquilo C7-16, arilalquilo C7-16 sustituido, trialquilsililo C3-12 y arildialquilsililo C7-14;
y
en la que cada grupo sustituyente se selecciona independientemente entre al menos uno de alquilo C1-3, -OH, -NH2, -SH, alcoxi C1-3, acilo C1-3, tioalquilo C1-3, alcoxicarbonilo C1-3, alquilamino C1-3 y dialquilamino C1-3.
2. El compuesto de la reivindicación 1, en el que R1 se selecciona entre alquilo C1-4, alquilo C1-4 sustituido, fenilo, fenilo sustituido, ciclohexilo y ciclohexilo sustituido.
3. El compuesto de la reivindicación 1, en el que R1 se selecciona entre metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, sec-butilo, terc-butilo, fenilo, o-tolilo y ciclohexilo.
4. El compuesto de la reivindicación 1, en el que R4 se selecciona entre hidrógeno, metilo, etilo, terc-butilo, alilo, bencilo, 4-metoxi-bencilo, difenilmetilo, trifenilmetilo, trimetilsililo, trietilsililo, triisopropilsililo, terc-butildimetilsi- lilo y fenildimetilsililo.
5. El compuesto de la reivindicación 1, en el que R4 se selecciona entre hidrógeno, alilo, bencilo y trimetilsililo.
6. El compuesto de la reivindicación 1, en el que R4 es hidrógeno.
7. El compuesto de la reivindicación 1, en el que R2 y R3 se seleccionan independientemente entre hidrógeno, metilo, etilo, n-propilo, isopropilo, fenilo y ciclohexilo.
8. El compuesto de la reivindicación 1, en el que R2 es hidrógeno y R3 se selecciona entre metilo, etilo, n-propilo, isopropilo, fenilo y ciclohexilo.
9. El compuesto de la reivindicación 1, en el que R1 se selecciona entre metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, sec-butilo, terc-butilo, fenilo, o-tolilo y ciclohexilo, R2 es hidrógeno, y R3 se selecciona entre metilo, etilo, n-propilo, isopropilo, fenilo y ciclohexilo.
10. El compuesto de la reivindicación 9, en el que R4 es hidrógeno.
11. El compuesto de la reivindicación 1, en el que el compuesto se selecciona entre:
ácido trans-4-{[(2-metilpropanoiloxi)metoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[(2,2-dimetilpropanoiloxi)metoxicarbonil]-aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[(3-metilbutanoiloxi)metoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[(benzoiloxi)metoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilpropanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilpropanoiloxi)propoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilpropanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(benzoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(ciclohexilcarboniloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(pentanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(propanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(butanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(pentanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(3-metilbutanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2,2-dimetilpropanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(ciclohexilcarboniloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(benzoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilbenzoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(butanoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilpropanoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(3-metilbutanoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2,2-dimetilpropanoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(benzoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(propanoiloxi)propoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(butanoiloxi)propoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2,2-dimetilpropanoiloxi)propoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(benzoiloxi)propoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(butanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(butanoiloxi)-1-ciclohexilmetoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2-metilpropanoiloxi)-1-ciclohexilmetoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(acetoxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(propanoiloxi)butoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(acetoxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(3-metilbutanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(2,2-dimetilpropanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico;
ácido trans-4-{[1-(acetoxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico; y
ácido trans-4-{[1-(propanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
sus sales farmacéuticamente aceptables y solvatos farmacéuticamente aceptables de cualquiera de los anteriores.
12. El compuesto de la reivindicación 1, en el que el compuesto se selecciona entre:
Ácido trans-4-{[1-(2-metilpropanoiloxi)etoxicarbonil]-aminometil}-ciclohexanocarboxílico;
trans-4-{[1-(2-Metilpropanoiloxi)etoxicarbonil]-aminometil}-ciclohexanocarboxilato sódico;
Ácido (+)-trans-4-({[(1S)-1-(2-metilpropanoiloxi)etoxi]carbonilamino}metil)-ciclohexanocarboxílico,
trans-4-({[(1S)-1-(2-Metilpropanoiloxi)etoxi]carbonilamino}metil)-ciclohexanocarboxilato sódico;
Ácido (-)-trans-4-({[(1R)-1-(2-metilpropanoiloxi)etoxi]carbonilamino}metil)-ciclohexanocarboxílico;
trans-4-({[(1R)-1-(2-Metilpropanoiloxi)etoxi}carbonilamino}metil)-ciclohexanocarboxilato sódico;
Ácido trans-4-{[1-(3-metilbutanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
trans-4-{[1-(3-Metilbutanoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxilato sódico;
Ácido trans-4-{[1-(benzoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxílico;
trans-4-{[1-(Benzoiloxi)etoxicarbonil]aminometil}-ciclohexanocarboxilato sódico;
Ácido trans-4-{[1-(2-metilpropanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxílico; y
trans-4-{[1-(2-Metilpropanoiloxi)-2-metilpropoxicarbonil]aminometil}-ciclohexanocarboxilato sódico.
13. El compuesto de la reivindicación 1, en el que el compuesto se selecciona entre:
ácido (+)-trans-4-({[(1S)-1-(2-metilpropanoiloxi)etoxi]carbonilamino}metil)-ciclohexanocarboxílico; y
ácido (-)-trans-4-({[(1R)-1-(2-metilpropanoiloxi)etoxi]carbonilaminometil)-ciclohexanocarboxílico.
14. El compuesto de la reivindicación 1, en el que el compuesto se selecciona entre:
trans-4-{[1-(2-metilpropanoiloxi)etoxicarbonil]-aminometil}-ciclohexanocarboxilato sódico;
trans-4-({[(1S)-1-(2-metilpropanoiloxi)etoxi]carbonilamino}metil)-ciclohexanocarboxilato sódico; y
trans-4-({[(1R)-1-(2-metilpropanoiloxi)etoxi]carbonilamino]metil)-ciclohexanocarboxilato sódico.
15. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de al menos un compuesto de Fórmula (I) de acuerdo con una cualquiera de las reivindicaciones 1 a 14, y un vehículo farmacéuticamente aceptable.
16. La composición farmacéutica de la reivindicación 15, en la que la composición farmacéutica es una formulación oral.
17. La composición farmacéutica de la reivindicación 15, en la que la composición farmacéutica es una formulación tópica.
18. La composición farmacéutica de una cualquiera de las reivindicaciones 15 a 17, en la que la composición farmacéutica es una formulación de liberación sostenida.
19. La composición farmacéutica de una cualquiera de las reivindicaciones 15 a 18, para tratar una patología seleccionada entre sangrado excesivo, una enfermedad o trastorno cutáneo y metástasis tumoral en un paciente.
20. La composición farmacéutica de una cualquiera de las reivindicaciones 15 a 18, para tratar el sangrado excesivo en un paciente.
21. La composición farmacéutica de la reivindicación 20, para tratar el sangrado menstrual excesivo en un paciente.
22. La composición farmacéutica de la reivindicación 20, para tratar el sangrado excesivo asociado con cirugía cardiaca, hemorragia gastrointestinal superior, pérdida de sangre en pacientes con cáncer avanzado o sangrado que se produce durante procedimientos dentales en hemofílicos.
23. La composición farmacéutica de una cualquiera de las reivindicaciones 15 a 18, para tratar una enfermedad o trastorno cutáneo seleccionado entre cicatrización de heridas, hiperplasia epidérmica, aspereza de la piel y pigmentación cutánea no deseada en un paciente.
24. La composición farmacéutica de una cualquiera de las reivindicaciones 15 a 18, para tratar la metástasis tumoral en un paciente.
25. La composición farmacéutica de la reivindicación 24, que comprende adicionalmente al menos un agente citotóxico.
26. Uso de una cantidad terapéuticamente eficaz de al menos un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 14 en la fabricación de un medicamento para el tratamiento del sangrado excesivo en un paciente.
27. El uso de la reivindicación 26, en el que el sangrado excesivo es sangrado menstrual excesivo.
28. El uso de la reivindicación 26, en la que el sangrado excesivo está asociado con cirugía cardiaca, hemorragia gastrointestinal alta, pérdida de sangre en pacientes con cáncer avanzado o sangrado que se produce durante procedimientos dentales en hemofílicos.
29. Uso de una cantidad terapéuticamente eficaz de al menos un compuesto de acuerdo con la reivindicación 1 en la fabricación de un medicamento para el tratamiento de una enfermedad o trastorno cutáneo en un paciente.
30. El uso de la reivindicación 29, en el que la enfermedad o trastorno cutáneo se selecciona entre cicatrización de heridas, hiperplasia epidérmica, engrosamiento de la piel y pigmentación cutánea no deseada.
31. Uso de una cantidad terapéuticamente eficaz de al menos un compuesto de acuerdo con la reivindicación 1 en la fabricación de un medicamento para el tratamiento de la metástasis tumoral en un paciente.
32. El uso de la reivindicación 31, en el que el medicamento comprende al menos un agente citotóxico.
33. El uso de una cualquiera de las reivindicaciones 26-32, en el que el medicamento es una formulación oral.
34. El uso de la reivindicación 33, en el que la formulación oral es una formulación oral de liberación sostenida.
35. El uso de una cualquiera de las reivindicaciones 26-32, en el que el medicamento es una formulación tópica.
36. El uso de la reivindicación 35, en el que la formulación tópica es una formulación tópica de liberación sostenida.
Patentes similares o relacionadas:
Enlazadores sensibles al pH para suministrar un agente terapéutico, del 8 de Abril de 2020, de GNT Biotech & Medicals Corporation: Un enlazador sensible al pH que tiene la siguiente fórmula (I), **(Ver fórmula)** en donde X es **(Ver fórmula)** -SH, -NH2, Boc-NH-, Fmoc-NH-, -COOH; n […]
Fabricación de 4,5,6,7-tetrahidroisozaxolo[5,4-c]piridin-3-ol, del 26 de Febrero de 2020, de H. LUNDBECK A/S: Un procedimiento para la fabricación del compuesto de fórmula VI a continuación, **(Ver fórmula)** en donde tanto R1 como R2 son o metilo o etilo, comprendiendo […]
Proceso de preparación de N-boc bifenil alaninol, del 26 de Febrero de 2020, de Chiral Quest (suzhou) Co., Ltd: Un proceso para preparar compuesto 4, que comprende en uno de los disolventes alcohólicos, hidrogenación asimétrica de 5 en presencia de [Rh(Duanphos)(X)]Y e hidrógeno […]
Procesos para la preparación de compuestos de pirimidinilciclopentano, del 23 de Octubre de 2019, de F. HOFFMANN-LA ROCHE AG: Un proceso para la preparación de un compuesto de fórmula (I) **(Ver fórmula)** o sales del mismo, que comprende la reacción de acoplamiento […]
Compuesto capaz de unirse al receptor de S1P y uso farmacéutico del mismo, del 25 de Septiembre de 2019, de ONO PHARMACEUTICAL CO., LTD.: Un compuesto representado por la formula (I-S-7a):**Fórmula** en el que el anillo A representa un grupo carbociclico C3-15; X representa un enlace o un grupo […]
Modificaciones de proteínas quimioenzimáticas específicas para lisina utilizando transglutaminasa microbiana, del 21 de Agosto de 2019, de NOVARTIS AG: Un método para modificar una proteína, que comprende: proporcionar una proteína diana que tiene al menos un residuo de lisina; poner […]
N-Fenil-1-sulfonil-2-pirrolidinacarboxamidas para la identificación de actividad biológica y farmacológica, del 16 de Agosto de 2019, de INSTITUT UNIV. DE CIENCIA I TECNOLOGÍA, S.A: Un compuesto de fórmula (I) **(Ver fórmula)** y las sales y estereoisómeros del mismo, donde R1 es hidrógeno, halo, hidroxilo, nitro, ciano, […]
Procedimientos para la preparación de derivados ácidos de GalNAc, del 3 de Julio de 2019, de F. HOFFMANN-LA ROCHE AG: Procedimiento para la preparación de derivados ácidos de GalNAc de fórmula I **Fórmula** en la que n es un número entero entre 0 y 10, y sus sales, sus enantiómeros correspondientes […]