PROCESO PARA LA PREPARACION DE 7-ALFA-METILESTEROIDES.
Un proceso para la preparación de 7a-metil esteroides de fórmula I:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP03/00339.
Solicitante: N. V. ORGANON.
Nacionalidad solicitante: Países Bajos.
Dirección: KLOOSTERSTRAAT 6,5349 AB OSS.
Inventor/es: STOELWINDER,J, OSTENDORF,M, BUGGENUM,VAN P.A.M.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07J1/00C4B
- C07J1/00C5B
- C07J1/00C5C2
- C07J5/00B1
- C07J51/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales con la estructura del ciclopenta [a] hidrofenantreno no modificada no previstos en los grupos C07J 1/00 - C07J 43/00.
Clasificación PCT:
- C07J1/00 C07J […] › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
- C07J5/00 C07J […] › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno, sustituidos en posición 17beta por una cadena de dos átomos de carbono, p. ej. pregnano, y sustituidos en posición 21 por solamente un enlace sencillo a átomo de oxígeno.
- C07J51/00 C07J […] › Esteroides normales con la estructura del ciclopenta [a] hidrofenantreno no modificada no previstos en los grupos C07J 1/00 - C07J 43/00.
Clasificación antigua:
- C07J1/00 C07J […] › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
- C07J5/00 C07J […] › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno, sustituidos en posición 17beta por una cadena de dos átomos de carbono, p. ej. pregnano, y sustituidos en posición 21 por solamente un enlace sencillo a átomo de oxígeno.
- C07J51/00 C07J […] › Esteroides normales con la estructura del ciclopenta [a] hidrofenantreno no modificada no previstos en los grupos C07J 1/00 - C07J 43/00.
Fragmento de la descripción:
Proceso para la preparación de 7a-metilesteroides.
La invención se refiere a un nuevo proceso para la preparación de 7a-metilesteroides.
Los 7a-metilesteroides representan una importante clase de compuestos farmacológicamente activos. Uno de los ejemplos de esteroide con un grupo metilo en la posición 7 es (7a,17a)-17-hidroxi-7-metil-19-norpregn-5-(10)-en-20-in-3-ona (Tibolona) que es el componente activo de Livial® utilizado para la terapia de reemplazamiento con hormonas en el tratamiento de dolencias de la menopausia. Tibolone es un compuesto que ejerce una actividad hormonal especifica de tejido. En los estudios de laboratorio y clínicos, Tibolona ejerce efectos estrógenos en el sistema termorregulador, el tejido vaginal y los huesos, pero no despliega ninguna actividad estrógena en el pecho o en el endometrio. Los efectos prometedores de Tibolona en los huesos también se están investigando actualmente enfocados a la prevención de la osteoporosis en las mujeres que son propensas a desarrollar este estado patológico. (1) Pavlov, P.W. y cols., Gynecol. Endocrinol. 1999; 13: 230-237, 2) Tibolone (Livial). A new steroid for the menopause. Drug. Ther. Bull. 1991; 29:77-8,3) Moore R.A. Systematic and economical review for Livial. In: Rymer J (Ed.), Livial: A review of clinical studies. Br. J. Gynaecol. 1999; 106; (3 Supl. 19)1).
Otra importante clase farmacológica de 7a-metilesteroides son 7a-metil-19-nortestosterona (MENTTM) y los ésteres relacionados en la posición 17 (WO 99/6727) que son andrógenos sintéticos que se están desarrollando para terapia de reemplazamiento con hormonas y control de la fertilidad masculina. Los estudios han demostrado que MENTTM es más potente que la hormona masculina testosterona para mantener la masa muscular, la potencia y la libido, así como en su capacidad para suprimir la producción de esperma. Asimismo, MENTTM no alarga la próstata como ocurre con la testosterona, lo que puede significar un uso médico más seguro. (1) Ogawa, S. y cols. 1996; 30:74-84. Hormones and Behaviour, 2) Robbins, A. y cols. Society for Neuroscience Abstracts 1994; 20 (parte 1); 376, 3) Sundaram, K. y cols. Annals of Medicine 1993; 25: 199-205, 4) Morali, G. y cols. Biology of Reproduction 1993; 49: 577-581).
Un tercer ejemplo de un esteroide de interés potencial con un grupo metilo en la posición 7 es citrato de 3-hidroxi-7a-metil-21-][2'-metoxi-4'-(dietilaminometil)-fenoxi]-19-norpregna-1,3,5(10)trieno (SR 16234) que es un Modulador Receptor de Estrógenos Selectivo (SERM) que según las conclusiones, posee una potente actividad antitumoral con propiedades selectivas de tejido, y una actividad antagonista-antiestrógena completa en las células de tumor de pecho en seres humanos. (1) WO 01/58919 A2, 2) WO 99/333859 A2, 3) US 6.281.205 B1, 4) US 20020032180 A1).
Desde el punto de vista de su síntesis, la introducción estereoselectiva de los sustituyentes en C-7 constituye la transformación clave en el ensamblaje de elementos representativos de esta importante clase de esteroides. De acuerdo con la bibliografía, la introducción de un grupo alquilo en la posición 7 en la cadena principal de esteroide se lleva a cabo generalmente a través de a)la adición 1,6-conjugada catalizada con cloruro cuproso o acetato cúprico de halógenos de alquil magnesio a 3-cetoesteroides 4,6-insaturados, o b) por adición conjugada de reactivos de cobre-alquil litio a 3-cetoesteroides 4,6 insaturados. No obstante, estos métodos producen mezclas de 7a- y 7ß-alquilesteroides. (1) Modi, S.P. y cols. J. Org. Chem. 1989; 54; 2317-2321, 2) Grunwell, J. F. Steroids 1976; 27:6, 759. 3) Campbell, J.A. y cols. J. Am. Chem. Soc. 1959; 81: 4069, 4) Grunwell, J.F. y cols. Steroids 1976; 27 750, 5) patente EE.UU. 3.798.213, 6) van Vliet N.P. y cols. Rec. Trav. Chim. Pays-Bas 1986; 105:111) en relaciones a,ß comprendidas entre 1,5:1 y 9:1. El aislamiento de 7a-isómeros interesantes farmacológicamente a partir de los 7ß-isómeros no deseables que los acompañan, que son inhibidores de enzimas menos efectivos (O'Reilly, J.M. y cols. J. Med. Chem. 1995; 38: 2842) sólo se puede conseguir por separación cromatográfica, o a través de procedimientos muy laboriosos a través de una recristalización repetitiva. Ambas
En WO 01/58919, se alquila un 3-cetoesteroide 4,6-diinsaturado, en la posición 7 con metil litio en presencia de bromuro de litio. En este caso, se describe que la estereoselectividad de esta alquilación en 7 aumenta tras la protección del grupo hidroxilo que queda con un éter THP, supuestamente por formación de complejo con el litio a favor del ataque de la cara a del esteroide. A pesar del aumento de la selectividad, desafortunadamente, en este último método la alta reactividad del grupo protector de acetato con el metil litio se refleja solamente en un rendimiento moderado de 67% del 7a-metil esteroide.
Se han desarrollado métodos alternativos para introducir grupos alquilo en 7, pero por lo general no son aplicables. Solamente se puede introducir una selección limitada de grupos alquilo, el método se limita a la síntesis de esteroides con un anillo A aromático, o se requieren etapas de reacción adicionales, lo que supone que estos métodos sean generalmente ineficaces. Por ejemplo, se han preparado estradioles 7a sustituidos por conversión de 6-cetoestradioles en 6-(fenilsulfonil)-6-dehidroestradiol, que experimenta la adición conjugada de reactivos de organolitio en la posición C7, seguido de etapas adicionales para eliminar el grupo sulfona. (Künzer, H. y cols. Tetrahedron Lett. 1994; 35:11, 1691). En un método más reciente se han preparado estradioles 7a-sustituidos por alquilación de 6-cetoestradioles, seguido de la desoxigenación y desprotección con eterato de trifluoruro de boro y trietilsilano. (Tedesco, R. y cols. Tetrahedron Lett. 1997; 38: 46, 7997). En WO 01/58919, se alquila un 6-cetoestradiol en la posición 7 por reacción con yoduro de metilo en presencia de litio diisopropilamina, seguido de la eliminación catalítica de la 6-cetona utilizando hidrógeno y platino y paladio; se describe que la estereoselectividad de dicha alquilación en 7 aumenta tras la protección del grupo hidroxilo que queda con un éter THP, supuestamente por impedimento estérico desde la cara ß del esteroide. En DE 4.418.828 A se describe la preparación de 7a-metilestradioles a través de una secuencia de reacciones a partir de estradioles 8,9 insaturados con formaldehído en presencia de ácidos de Lewis, seguido de hidrogenación catalítica, tosilación y reducción. En EP 0.262.201 B1, se describe la preparación de 7a-propilesteroides a partir de 3-cetoesteroides 4,6-insaturados por reacción de Sakurai de compuestos de alquiltrialquilsilanos o aliltrialquilestaño en presencia de ácidos de Lewis, seguido de la hidrogenación selectiva con tris(trifenilfosfina)rodio(I)cloruro (Wilkinson's catalysts) (ver también Nickisch, K; Laurent, H. Tetrahedron Lett. 1988; 29: 13, 1533). Por consiguiente, uno de los mayores retos de la síntesis de 7-alquilesteroides es el control de la diaestéreo selectividad de la adición 1,6-conjugada mediada por cobre, que es el método más directo para introducir grupos alquilo en 7.
De acuerdo con la presente invención, se ha encontrado ahora un proceso para la preparación de 7-a-metil esteroides de fórmula:
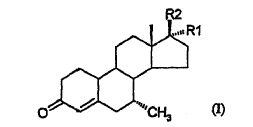
en la que
R1 es hidrógeno, metilo o C= CH,
R2 es (CH2)nOH, en la que n es 0, 1 o 2;
a través de una adición 1,6-conjugada mediada por cobre de un reactivo de Grignard CH3MgX, siendo X un halógeno (Cl, Br o I), al 3-cetoesteroide 4,6-insaturado de fórmula II,
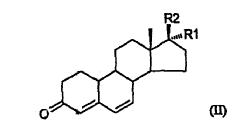
en la que R1 y R2 son como se han definido anteriormente, que comprende la protección del grupo hidroxi del esteroide de fórmula II con un grupo trialquilsililo, seguido del tratamiento del esteroide protegido con hidroxi con el reactivo de Grignard.
El proceso de la presente invención tiene como resultado un importante aumento en la solubilidad del sustrato esteroide, abre la posibilidad de aumentar la concentración de sustratos esteroides en dicho proceso (es posible un intervalo de concentraciones, pero preferiblemente la concentración del esteroide es de 0,1 a 0,3 molar) y, sorprendentemente, presenta una notablemente mejor estereoselectividad...
Reivindicaciones:
1. Un proceso para la preparación de 7a-metil esteroides de fórmula I:
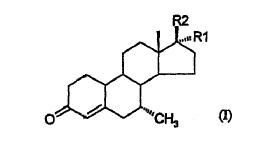
en la que
R1 es hidrógeno, metilo o C=CH,
R2 es (CH2)nOH, en la que n es 0, 1 o 2;
a través de una adición 1,6-conjugada mediada por cobre de un reactivo de Grignard CH3MgX, siendo X un halógeno, al 3-cetoesteroide 4,6-insaturado de fórmula II,
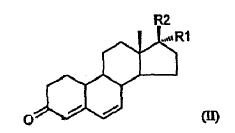
en la que R1 y R2 son como se han definido anteriormente, que comprende la protección del grupo hidroxi del esteroide de fórmula II con un grupo trialquilsililo, definiéndose el grupo alquilo como un grupo alquilo lineal o ramificado que tiene de 1 a 4 átomos de carbono, seguido del tratamiento del esteroide protegido en hidroxi con el reactivo de Grignard.
2. El proceso de la reivindicación 1, en el que R1 es hidrógeno, metilo o C=CH y R2 es OH.
3. El proceso de la reivindicación 1, en el que R1 es hidrógeno y R2 es (CH2)2OH.
4. El proceso de cualquiera de las reivindicaciones 1 a 3, en el que el reactivo de Grignard es CH3MgCl.
5. El proceso de cualquiera de las reivindicaciones 1 a 4, en el que el grupo trialquilsililo es un grupo trimetilsililo.
6. El proceso de cualquiera de las reivindicaciones 1 a 5, en el que el disolvente de la reacción de Grignard es tetrahidrofurano, éter dietílico o una mezcla de ellos.
7. El proceso de cualquiera de las reivindicaciones 1 a 6, en el que la concentración del esteroide es de 0,1 a 0,3 molar.
8. El proceso de cualquiera de las reivindicaciones 1 a 7, en el que la relación molar del esteroide al reactivo de Grignard es de 1:1 a 1:7.
9. El proceso de cualquiera de las reivindicaciones 1 a 8, en el que se utiliza como catalizador de cobre, acetato de cobre (II) o cloruro de cobre (II).
10. El proceso de cualquiera de las reivindicaciones 1 a 9 en el que la temperatura de reacción de la reacción de Grinard está comprendida entre -78ºC y 0ºC.
11. El compuesto 21-hidroxi-19-norpregn-4,6-dien-3-ona.
Patentes similares o relacionadas:
Derivados de ácidos biliares como agonistas FXR/TGR5, del 1 de Julio de 2020, de ENANTA PHARMACEUTICALS, INC: Un compuesto representado por la Formula I, o una sal o ester aceptable farmaceuticamente de este: **(Ver fórmula)** en donde: Ra es hidrogeno o -C1-C8 alquilo […]
Procedimiento industrial para la síntesis de acetato de ulipristal y su análogo 4-acetilo, del 21 de Mayo de 2019, de RICHTER GEDEON NYRT: Un procedimiento para la síntesis del compuesto de fórmula (I)**Fórmula** en el que el significado de R es un grupo dimetilamino o acetilo, caracterizado porque a) […]
Compuestos que comprenden uno o más dominios hidrófobos y un dominio hidrófilo que comprende restos de PEG, útiles para unir células, del 9 de Abril de 2019, de F. HOFFMANN-LA ROCHE AG: Un compuesto que comprende, preferentemente que consiste en, uno o más dominios hidrófobos y un dominio hidrófilo, en el que el uno o más dominios […]
Antagonistas de progesterona, del 26 de Octubre de 2018, de Evestra, Inc: Un compuesto que tiene la estructura:**Fórmula** en donde R7 es (E)-CH≥CH-CF3, -CH2-CF≥CF2 o -CF2-CH≥CH2
Procedimiento de producción de derivados de 21-metoxi-11-beta-fenil-19-nor-pregna-4,9-dieno-3,20-diona, del 24 de Septiembre de 2018, de RICHTER GEDEON NYRT: Procedimiento de síntesis de un compuesto de fórmula (I)**Fórmula** en la que el significado de R es un grupo dimetilamino o acetilo, caracterizado por […]
Derivados de testosterona con una sustitución carboxialquilo en la posición 3 y sus utilizaciones para la producción de los esteroides marcados para la determinación de la concentración de testosterona en una muestra biológica, del 23 de Agosto de 2017, de BIOMERIEUX: Derivado de testosterona de fórmula general (I) siguiente:**Fórmula** en la que n es un número entero comprendido entre 1 y 10 e Y representa un grupo […]
Un procedimiento para la producción de 19-norpregn-4-en-3,20-diona-17?-ol (gestonorona) y productos intermedios correspondientes, del 26 de Octubre de 2016, de RICHTER GEDEON NYRT: Un procedimiento para la síntesis de (17α)-17-acetil-17-hidroxi-estr-4-en-3-ona de fórmula (I)**Fórmula** caracterizado por hacer reaccionar el compuesto […]
Proceso para la producción de intermediarios de estetrol, del 6 de Abril de 2016, de Estetra S.P.R.L: Proceso para la preparacion de un compuesto de fórmula **Fórmula** dicho proceso comprendiendo las etapas de: a) reaccionar un compuesto de formula , con […]