PEPTIDOS INHIBIDORES SELECTIVOS DE LA ACTIVIDAD BIOLOGICA DE LA CALCINEURINA.
Péptidos inhibidores selectivos de la actividad biológica de la calcineurina.
La presente invención se encuadra en el sector de la biotecnología aplicada al área de la salud humana y más concretamente se basa en la sorprendente utilidad de los péptidos, LxVPc1, c3 y c4 como eficientes inhibidores selectivos de la ruta de señalización Calcineurina (CN)-NFAT y de la actividad fosfatasa de la CN. Dichos compuestos son útiles immunosupresores y sirven de base para la elaboración de composiciones terapéuticas para la profilaxis y el tratamiento de enfermedades humanas que cursen con activación de linfocitos T, tales como, pero sin limitarnos a, enfermedades autoinmunes, inflamación y alergia o situaciones de rechazo a transplantes. Igualmente, estos péptidos y el material genético y biológico relacionado pueden constituir útiles herramientas para el desarrollo de ensayos para encontrar compuestos que tengan actividad antagonista selectiva de la CN
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200503237.
Solicitante: CONSEJO SUPERIOR INVESTIG. CIENTIFICAS
FUNDACION CTRO. NACIONAL INVESTIG. CARDIOVASCULARES.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: REDONDO MOYA,JUAN MIGUEL, RODRIGUEZ MARQUEZ,ANTONIO, MARTINEZ MARTINEZ,SARA.
Fecha de Solicitud: 29 de Diciembre de 2005.
Fecha de Publicación: .
Fecha de Concesión: 21 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07K7/08A
- G01N33/50D2
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61P37/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunosupresores, p. ej. medicamentos para el tratamiento del rechazo en injertos.
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Fragmento de la descripción:
Péptidos inhibidores selectivos de la actividad biológica de la calcineurina.
Sector de la técnica
La presente invención se encuadra en el sector de la biotecnología aplicada al área de la salud humana y más concretamente se basa en la sorprendente utilidad de los péptidos, LxVPc1, c3 y c4 como eficientes inhibidores selectivos de la ruta de señalización Calcineurina (CN)-NFAT y de la actividad fosfatasa de la CN. Dichos compuestos son útiles immunosupresores y sirven de base para la elaboración de composiciones terapéuticas para la profilaxis y el tratamiento de enfermedades humanas que cursen con activación de linfocitos T, tales como, pero sin limitarnos a, enfermedades autoinmunes, inflamación y alergia o situaciones de rechazo a transplantes. Igualmente, estos péptidos y el material genético y biológico relacionado pueden constituir útiles herramientas para el desarrollo de ensayos para encontrar compuestos que tengan actividad antagonista selectiva de la CN.
Antecedentes de la invención
La ruta Calcio/Calcineurina/NFAT desempeña un papel destacado en una gran cantidad de procesos biológicos importantes, incluyendo el desarrollo y funcionamiento de los sistemas inmune y nervioso, formación de la vasculatura, morfogénesis de las válvulas cardíacas y crecimiento y desarrollo muscular (1-5). Las señales de calcio activan a la fosfatasa calcineurina (CN), que desfosforila a los factores de transcripción NFATc1, NFATc2, NFATc3 y NFATc4 (nomenclatura HUGO). Esto induce su translocación desde el citoplasma al núcleo y aumenta su capacidad de unión al ADN, provocando la expresión génica dependiente de NFAT (6). La unión de CN a los NFATs es por lo tanto un paso esencial en la activación de esta familia de factores de transcripción.
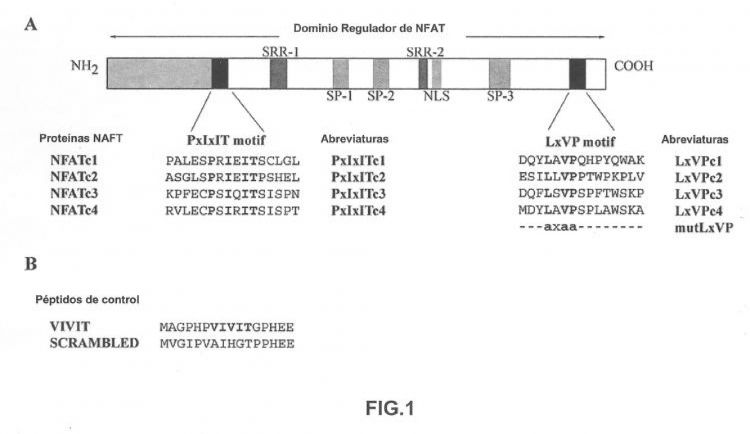
La calcineurina, también conocida como la proteína fosfatasa 2B, es un heterodímero que consta de una subunidad catalítica (CnA) fuertemente unida a una subunidad reguladora (CnB). La CnA se compone de un dominio catalítico y otro regulador que contiene la secuencia de unión con la CnB, un dominio de unión de calmodulina (CaM) y un segmento autoinhibidor (7). La actividad fosfatasa de CnA se regula por un complejo formado por Ca2+, CnB y CaM; ambas proteínas reguladoras son esenciales para esta actividad (7,8). La CN puede unirse tanto a NFAT fosforilado como desfosforilado (9,10); y aunque la CN inactiva puede unirse a los NFAT, la unión es más fuerte con la CN activada (11). En los NFAT, esta interacción ha sido localizada dentro del dominio regulador N-terminal, que está conservado en los cuatro miembros (12-14). Mediante análisis mutacional se analizaron los motivos conservados dentro del dominio regulador de NFATc2, definiéndose la secuencia SPRIEIT como el sitio de anclaje de calcineurina (15). En estudios posteriores se identificaron los residuos conservados en las secuencias correspondientes de los demás miembros de NFAT, definiéndose el motivo PxIxIT (ver Fig. 1A), que parece ser funcional en todos los miembros de NFAT regulados por CN (11,16-18).
NFAT se describió por primera vez como un factor esencial para la expresión del gen de la IL-2 (19), y posteriormente se ha implicado en la regulación de muchos otros genes necesarios para una respuesta inmune eficaz (20-23). El descubrimiento de que CN es la diana intracelular de las drogas inmunosupresoras, como Ciclosporina A (CsA) y FK506 (24), resaltó aún más la importancia de NFAT en el sistema inmune así como de la ruta Ca2+/CN/NFAT (25-27). El empleo de estas drogas, CsA y FK506, es el método más frecuente para bloquear la ruta de señalización CN-NFAT, ya que inhiben la actividad enzimática de CN (24). Sin embargo, esta estrategia también inhibe otras rutas no relacionadas con NFAT dependientes de CN, lo que se asocia con los efectos secundarios severos que desencadena su uso clínico (28). Se ha visto mediante estudios usando péptidos inhibidores que el bloqueo específico de las interacciones proteína-proteína es terapéuticamente prometedor para el tratamiento de enfermedades donde esté implicada la ruta CN-NFAT. El péptido VIVIT, cuya secuencia está basada en el motivo PxIxIT y que posee una elevada afinidad por CN, es capaz de inhibir selectivamente la ruta de señalización dependiente de NFAT sin afectar al resto de vías activadas por CN (29). Sin embargo, en los últimos años se han descrito numerosas proteínas que se unen a CN que presentan, la mayoría de ellas, un motivo similar al PxIxIT dentro de la zona de interacción con CN (41). El péptido VIVIT podría por lo tanto bloquear tanto la interacción CN-NFAT como la de CN con otras proteínas. Por el contrario, el motivo LxVP - que participa en la interacción de NFAT con la CN activada - se ha descrito solamente en NFAT. Por lo tanto, el efecto bloqueante tanto in vitro como in vivo que aquí se describe muestra que el empleo de péptidos derivados de estos motivos posee un efecto inhibidor selectivo potencial en la ruta CN-NFAT, cubriendo pues, la necesidad de encontrar moléculas altamente selectivas capaces de inhibir la ruta CN-NFAT.
Descripción de la invención
La presente invención se refiere a nuevos péptidos y a derivados de los mismos útiles como antagonistas (inhibidores) selectivos de la ruta de señalización CN-NFAT y más concretamente como inmunosupresores (además, se ha observado que son inhibidores de la actividad fosfatasa de la CN). La invención también se refiere a composiciones terapéuticas que comprenden dichos péptidos, a ensayos para encontrar compuestos que tengan actividad, preferentemente, antagonista selectiva de la acción biológica de CN sobre NFAT y el uso de dichos péptidos para la profilaxis y tratamiento de enfermedades humanas que cursen con activación de linfocitos T, tales como, pero sin limitación, enfermedades autoinmunes, inflamación y alergia o situaciones de rechazo a transplantes. De la misma forma, se refiere a herramientas genéticas y métodos de producción de dichos péptidos.
Descripción de las Figuras
Fig. 1A.- Representación esquemática del dominio regulador NH2-terminal y de las secuencias de interacción con CN de los diferentes NFATs. Las regiones conservadas entre los diferentes miembros de NFAT se muestran como sigue: SP-1, SP-2 y SP-3 son motivos repetitivos de serina-prolina susceptibles de fosforilación; SRR-1 y SRR-2 son regiones ricas en serina; y NLS es la secuencia de localización nuclear. Las dos regiones implicadas en la unión a CN, denominadas motivos PxIxIT y LxVP se muestran en negro, y por debajo se muestran las secuencias correspondientes a estos motivos en cada uno de los cuatro miembros de NFAT humano; los aminoácidos conservados entre los diferentes miembros se muestran en negrita. Los residuos indicados se sustituyeron por alaninas para producir el correspondiente péptido LxVPc1 mutante. Las abreviaturas empleadas para los diferentes motivos PxIxIT y LxVP se muestran a la derecha. Fig. 1B.- Secuencias de aminoácidos de los péptidos usados como control positivo (VIVIT) o negativo (SCRAMBLED) de competición para los experimentos de unión in vitro.
Fig. 2.- Comparación de la unión de CN a NFATc1 y NFATc2 in vitro. Fig. 2A.- La unión de NFATc1 y NFATc2 a CN es dependiente de la concentración de NFAT. Se ensayó una concentración fija de CN (20 nM) frente a concentraciones decrecientes de los dominios reguladores de NFATc2 o NFATc1 fusionados a GST (Glutathione-S-Transferase) en ensayos de pull-down. La CN unida se mostró mediante western blot usando un anticuerpo monoclonal frente a CnA. Debido a las altas cantidades de CN unida a NFATc1 se muestran dos exposiciones diferentes (panel superior e inferior respectivamente) para mostrar claramente la interacción NFATc1-CN. Se cuantificó la CN unida mediante densitometría, dato mostrado en el gráfico inferior como unidades de intensidad relativa de CN unida a cada concentración de NFAT. Fig 2B.- La unión de CN-NFAT es dependiente de la concentración de CN. Se ensayaron cantidades fijas de GST-NFATc2 (izquierda) ó GST-NFATc1 (derecha) con concentraciones decrecientes de CN (20, 10, 5 y 2,5 nM de CN). La CN se detectó usando un anticuerpo monoclonal frente a CnA: la CN unida se muestra en el panel superior; y en el inferior se muestra la CN no unida (libre) en 1/3 de los sobrenadantes obtenidos tras la reacción de unión. La tinción de las membranas de western blot con Ponceau Red confirmó que se usaron las mismas cantidades de las proteínas de fusión de GST en las reacciones (panel intermedio).
Fig. 3.- Análisis...
Reivindicaciones:
1. Secuencia de aminoácidos, para inhibir selectivamente la ruta de señalización de la Calcineurina (CN) sobre los factores de transcripción NFAT (CN-NFAT), que comprende la secuencia de aminoácidos
donde R1 es un aminoácido aromático del tipo Tirosina o Fenilalanina; R2 es un aminoácido del tipo Alanina o Serina y R3 no es el aminoácido Prolina.
2. Secuencia de aminoácidos según la reivindicación 1, donde dichos factores de transcripción son, al menos, NFATc1 y NFATc2.
3. Secuencia de aminoácidos según cualquiera de las reivindicaciones 1 o 2, caracterizada porque está constituida por una secuencia de aminoácidos perteneciente al siguiente grupo:
a) secuencia de aminoácidos SEQ ID NO 18,
b) secuencia de aminoácidos análoga a la secuencia de a),
c) secuencia de aminoácidos que comprende una secuencia cualquiera perteneciente a (a) o (b).
4. Secuencia de aminoácidos según cualquiera de las reivindicaciones 1 o 2, caracterizada porque está constituida por una secuencia de aminoácidos perteneciente al siguiente grupo:
a) secuencia de aminoácidos SEQ ID NO 21,
b) secuencia de aminoácidos análoga a la secuencia de a),
c) secuencia de aminoácidos que comprende una secuencia cualquiera perteneciente a (a) o (b).
5. Secuencia de aminoácidos según cualquiera de las reivindicaciones 1 o 2, caracterizada porque está constituida por una secuencia de aminoácidos perteneciente al siguiente grupo:
a) secuencia de aminoácidos SEQ ID NO 22,
b) secuencia de aminoácidos análoga a la secuencia de a),
c) secuencia de aá que comprende una secuencia cualquiera perteneciente a (a) o (b).
6. Secuencia de nucleótidos capaz de codificar una secuencia de aminoácidos según cualquiera de las reivindicaciones 1-5.
7. Secuencia de nucleótidos según la reivindicación 6, donde dicha secuencia está seleccionada de uno de los siguientes grupos:
a) secuencia de nucleótidos SEQ ID NO 5 y/o su secuencia de nucleótidos complementaria SEQ ID NO 6,
b) secuencia de nucleótidos que codifica para la secuencia de aminoácidos SEQ ID NO 21,
c) secuencia de nucleótidos que codifica para la secuencia de aminoácidos SEQ ID NO 22,
d) secuencia de nucleótidos análoga a la secuencia (a), o (b) o (c),
e) secuencia de nucleótidos que comprende una secuencia cualquiera perteneciente de (a), (b), (c) y (d).
8. Secuencia de nucleótidos según la reivindicación 7, donde dicha secuencia es la SEQ ID NO 5 y/o la SEQ ID NO 6.
9. Construcción genética caracterizada porque comprende una secuencia de nucleótidos según cualquiera de las reivindicaciones 6-8.
10. Construcción genética según la reivindicación 9 que además comprende una secuencia de nucleótidos codificante de un péptido o secuencia peptídica que permita el aislamiento o la detección del péptido expresado.
11. Vector de expresión génica que comprenda una secuencia de nucleótidos según cualquiera de las reivindicaciones 6-8 o la construcción génica según las reivindicaciones 9-10.
12. Vector de expresión génica según la reivindicación 11, donde dicho vector es un plásmido.
13. Célula transformada que contiene una secuencia de nucleótidos según cualquiera de las reivindicaciones 6-8, la construcción génica según las reivindicaciones 9-10 o el vector de expresión según cualquiera de las reivindicaciones 11-12.
14. Procedimiento de identificación de nuevos compuestos farmacéuticos capaces de inhibir la acción biológica de la Calcineurina sobre los factores de transcripción NFATc1 y NFATc2, que comprende el uso de un péptido según cualquiera de las reivindicaciones 1-5, una secuencia de nucleótidos según cualquiera de las reivindicaciones 6-8, la construcción génica según las reivindicaciones 9-10, el vector de expresión según cualquiera de las reivindicaciones 11-12 o la célula transformada según la reivindicación 13.
15. Procedimiento de identificación de nuevos compuestos según la reivindicación 14, caracterizado porque dichos compuestos son antagonistas selectivos de la actividad biológica de Calcineurina A.
16. Procedimiento de identificación de nuevos compuestos según la reivindicación 14, caracterizado porque dicho procedimiento es un ensayo in vitro de interacción o unión de proteínas.
17. Uso de los péptidos según cualquiera de las reivindicaciones 1-5 para la elaboración de una composición farmacéutica para el tratamiento o profilaxis de enfermedades que cursen con activación de la Calcineurina.
18. Uso de los péptidos según la reivindicación 17, donde dicha enfermedad cursa con activación de linfocitos T y pertenece al siguiente grupo: enfermedades autoinmunes, inflamación, alergia o situaciones de rechazo a transplantes.
Patentes similares o relacionadas:
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 COMBINACIONES DE PÉPTIDOS PARA VACUNAS CONTRA LA ALERGIA A LOS GATOS, del 1 de Marzo de 2011, de CIRCASSIA LIMITED: Una composición para uso en la prevención o tratamiento de alergia a los gatos en un individuo por tolerización que comprende los polipéptidos: CPAVKRDVDLFLT (SEC […]
COMBINACIONES DE PÉPTIDOS PARA VACUNAS CONTRA LA ALERGIA A LOS GATOS, del 1 de Marzo de 2011, de CIRCASSIA LIMITED: Una composición para uso en la prevención o tratamiento de alergia a los gatos en un individuo por tolerización que comprende los polipéptidos: CPAVKRDVDLFLT (SEC […]
PEPTIDOS CON CAPACIDAD DE PENETRACION CELULAR Y SUS USOS, del 28 de Febrero de 2011, de UNIVERSITAT POMPEU FABRA: Péptidos con capacidad de penetración celular y sus usos.Los péptidos, o sales farmacéutica o biológicamente aceptables de los mismos, comprende la secuencia […]
 PÉPTIDOS QUE PUEDEN UNIRSE AL FACTOR TRANSFORMANTE DE CRECIMIENTO B1 (TGF-B1), del 11 de Febrero de 2011, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Los péptidos tienen la capacidad de unirse al factor transformante de crecimiento TGF-ß1 (TGF-ß1) y son potenciales inhibidores de la actividad biológica del […]
PÉPTIDOS QUE PUEDEN UNIRSE AL FACTOR TRANSFORMANTE DE CRECIMIENTO B1 (TGF-B1), del 11 de Febrero de 2011, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Los péptidos tienen la capacidad de unirse al factor transformante de crecimiento TGF-ß1 (TGF-ß1) y son potenciales inhibidores de la actividad biológica del […]
PROCEDIMIENTO PARA LA IDENTIFICACION DE LAS ESPECIES COMERCIALES DE LA FAMILIA MERLUCCIIDAE, ELEMENTOS NECESARIOS Y APLICACIONES, del 11 de Febrero de 2011, de CONSEJO SUPERIOR INVESTIG. CIENTIFICAS: Procedimiento para la identificación de las especies comerciales de la Familia Merlucciidae, elementos necesarios y aplicaciones.La invención proporciona […]
 ANTICUERPO MONOCLONAL HUMANO ESPECIFICO PARA LIPOPOLISACARIDOS (LPS) DE SEROTIPO IATS 011 DE PSEUDOMONAS AERUGINOSA, del 2 de Diciembre de 2010, de KENTA BIOTECH AG: Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P. aeruginosa que comprende una cadena ligera y una cadena pesada […]
ANTICUERPO MONOCLONAL HUMANO ESPECIFICO PARA LIPOPOLISACARIDOS (LPS) DE SEROTIPO IATS 011 DE PSEUDOMONAS AERUGINOSA, del 2 de Diciembre de 2010, de KENTA BIOTECH AG: Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P. aeruginosa que comprende una cadena ligera y una cadena pesada […]