PROCEDIMIENTO DE OBTENCION DE CELULAS MADRE MESENQUIMALES CON CAPACIDAD PLURIPOTENTE.
El objeto de la presente invención es un procedimiento de obtención de células madre mesenquimales con capacidad pluripotente que utiliza sangre periférica de mamíferos o sus hemoderivados como fuente celular.
Las células madre mesenquimales son un tipo de célula madre adulta con capacidad de diferenciarse hacia tejidos derivados del mesodermo y otros linajes celulares de otras capas embrionarias
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702640.
Solicitante: FUNDACION PROGRESO Y SALUD.
Nacionalidad solicitante: España.
Provincia: SEVILLA.
Inventor/es: GARCIA CASTRO,JAVIER, PEREZ HERNANDEZ,DANIEL, RODRIGUEZ GONZALEZ,RENE, MASIP ORDOEZ,MANUEL, RUBIO AMADOR,RUTH.
Fecha de Solicitud: 26 de Septiembre de 2007.
Fecha de Publicación: .
Fecha de Concesión: 8 de Julio de 2010.
Clasificación Internacional de Patentes:
- C12N5/06B11P
Clasificación PCT:
- C12N5/0789 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre; Células progenitoras multipotentes.
Fragmento de la descripción:
Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente.
Sector y objeto de la invención
La presente invención se encuadra en el ámbito de la biomedicina. Más específicamente, se refiere a la obtención de células madre mesenquimales mediante un procedimiento que utiliza sangre periférica de mamíferos o sus hemoderivados como fuente celular. Las células madre mesenquimales son un tipo de célula madre adulta con capacidad de diferenciarse hacia tejidos derivados del mesodermo y otros linajes celulares de otras capas embrionarias.
Estado de la técnica
Un tipo de célula madre adulta, especialmente prometedor en aplicaciones terapéuticas, son las denominadas células madre mesenquimales (CMM). En 1.974, Friedenstein y colaboradores describieron una población de células, aisladas de la médula ósea (MO), con adherencia innata al plástico y capacidad de diferenciarse en osteoblastos, adipocitos y condrocitos, denominándolas por ello células estromales de la médula ósea (Friedenstein AJ, Chailakhyan RK, Latsinik NV, Panasyuk AF, Keiliss-Borok IV. Transplantation 1974; 17: 331-340). Desde entonces numerosos grupos de investigación han aislado poblaciones celulares de otros tejidos sólidos (tejido adiposo, cartílago, piel, etc...) con características muy similares a las células estromales de la MO e idéntica capacidad de diferenciación hacía tejidos derivados del mesodermo, de ahí que las células estromales de la MO pasasen a denominarse genéricamente Células Madre Mesenquimales (revisado en Beyer Nardi N, da Silva Meirelles L. Handbook Experimental Pharmacology 2006;174:249-282). Posteriormente se ha demostrado que también poseen capacidad de diferenciación hacia linajes celulares de otras capas embrionarias, e incluso presentan capacidad de injertar in vivo en fetos pre-inmunes de ternera y diferenciarse in situ en células maduras de múltiples órganos (Liechty KW, MacKenzie TC, Shaaban AF, Radu A, Moseley AM, Deans R, Marshak DR, Flake AW. Nature Medicine 2000; 6: 1282-12862).
La diferenciación de las CMM no es sólo un hecho descrito in vitro; en diversos modelos animales de daño tisular se ha observado cómo, en la zona dañada, aparecían células no hematopoyéticas de la MO o bien directamente CMM, y que estas células eran capaces de diferenciarse hacía el linaje celular del tejido donde anidaban (piel, cerebro, hígado, etc...)(Prockop DJ, Gregory CA, Spees JL. Proc Natl Acad Sci U S A. 2003; 100:11917-11923). Esto demuestra el potencial de las CMM para reparar y regenerar múltiples órganos gracias a su capacidad de movilizarse desde sus reservorios naturales hasta la sangre periférica (SP) y de ahí extravasarse hacia el lugar donde se localice el daño. Esta movilización implicaría la presencia de CMM en sangre, al menos de forma transitoria. Efectivamente diversos artículos han mostrado la posibilidad de aislar CMM de sangre periférica, de sangre de cordón umbilical e incluso de sangre fetal (Revisado en Zvaifler NJ, Marinova-Mutafchieva L, Adams G, Edwards CJ, Moss J, Burger JA, Maini RN. Arthritis Research 2000; 2: 477-488 y en He Q, Wan C, Li G. Stem Cells 2007; 25: 69-77). Además investigadores del Hospital Universitario de Salamanca han aislado CMM de MO de pacientes sometidos a trasplante hematopoyético y en dos casos han observado como un cierto porcentaje de las CMM de MO eran de origen del donante, demostrando indirectamente que éstas se hallaban en la aféresis con la que se realizó el trasplante (Villaron EM, Almeida J, Lopez-Holgado N, Alcoceba M, Sanchez-Abarca LI, Sanchez-Guijo FM, Alberca M, Perez-Simon JA, San Miguel JF, Del Canizo MC. Haematologica. 2004; 89:1421-1427). Sin embargo, otros autores han sido incapaces de reproducir estos hallazgos de CMM en SP (Lazarus HM, Haynesworth SE, Gerson SL, Rosenthal NS, Caplan Al. Bone Marrow Transplantation 1995; 16: 557-564; Wexler SA, Donaldson C, Denning-Kendall P, Rice C, Bradley B, Hows JM. British Journal Haematology 2003; 121: 368-374 y las anteriores revisiones). Al revisar la bibliografía al respecto se observa un punto común en todos los trabajos que es la dificultad de aislar CMM de SP, con los métodos disponibles en la actualidad (revisado en Roufosse CA, Direkze NC, Otto WR, Wright NA. International Journal Biochemistry Cell Biology 2004; 36: 585-597 y las anteriores revisiones). Se han detectado CMM en SP total aunque su cultivo igualmente resulta dificultoso y poco reproducible ya que sólo en un pequeño porcentaje de las muestras se consigue obtener, por los métodos tradicionales, y expandir durante meses poblaciones enriquecidas en CMM (Ramírez M, Lucia A, Gómez-Gallego F, Esteve-Lanao J, Pérez-Martínez A, Foster C, Andreu AL, Martín MA, Madero L, Arenas J, García-Castro J. British Journal Sports Medicine 2006; 40: 719-22; García-Castro J, Balas A, Ramírez M, Pérez-Martínez A, Madero L, González-Vicent M, Díaz MA. Journal Pediatric Hematology Oncology 2007; 29: 388-392).
En la actualidad el proceso de obtención de CMM humanas de diversos tejidos sólidos se basa en el mismo principio, la adherencia innata de las CMM al plástico. En general, tras disgregar el tejido y obtener una muestra celular en suspensión se obtiene una fracción enriquecida en células mononuclares, utilizando gradientes de densidad (ficoll, percoll...). Esta fracción se suele depositar directamente sobre frascos de cultivo celular estándar con medios generalistas a los que se añade suero bovino fetal. Al día siguiente se retiran las células no adheridas y se mantiene el cultivo de células adheridas hasta que este se enriquece en CMM (Friedenstein AJ, Chailakhyan RK, Latsinik NV, Panasyuk AF, Keiliss-Borok IV. Transplantation 1974; 17: 331-340; WO 0183709; WO 0134775; WO 2005121317; WO 2005015151). Además las CMM se pueden obtener de forma similar a partir de ciertos fluidos corporales durante el desarrollo del feto, tales como líquido amniótico (Tsai MS, Lee JL, Chang YJ, Hwang SM. Human Reproduction. 2004; 19:1450-1456; In 't Anker PS, Scherjon SA, Kleijburg-van der Keur C, Noort WA, Claas FH, Willemze R, Fibbe WE, Kanhai HH. Blood. 2003; 102:1548-1459; WO 2006019357; US 2005118712), sangre fetal (Campagnoli C, Roberts IA, Kumar S, Bennett PR, Bellantuono I, Fisk NM. Blood. 2001; 98: 2396-2402) y sangre de cordón umbilical (Erices A, Conget P, Minguell JJ. British Journal Haematology 2000; 109: 235-242; Lee OK, Kuo TK, Chen WM, Lee KD, Hsieh SL, Chen TH. Blood. 2004; 103: 1669-1675; Bieback K, Kern S, Kluter H, Eichler H. Stem Cells. 2004; 22: 625-634; WO 2006113881; WO 2006121043; WO 2007015546; WO 03070922; US 2007105221).
Sin embargo durante la etapa adulta la obtención de CMM de fluidos corporales humanos resulta mucho más complicada y menos reproducible. Con la metodología tradicional, anteriormente comentada, ocasionalmente se puede obtener CMM de sangre periférica movilizada y con mucha menor probabilidad con SP no movilizada (Zvaifler NJ, Marinova-Mutafchieva L, Adams G, Edwards CJ, Moss J, Burger JA, Maini RN. Arthritis Research 2000; 2: 477-488; He Q, Wan C, Li G. Stem Cells. 2007; 25: 69-77; Lazarus HM, Haynesworth SE, Gerson SL, Rosenthal NS, Caplan Al. Bone Marrow Transplantation 1995; 16: 557-564; Wexler SA, Donaldson C, Denning-Kendall P, Rice C, Bradley B, Hows JM. British Journal Haematology 2003; 121: 368-374; WO 0022097; WO 9901145). Para obtener una mayor cantidad de CMM de SP sería necesario disponer de un sistema que permitiese aislar CMM de una manera reproducible.
Explicación de la invención
El objeto de la presente invención es un procedimiento de obtención de células madre mesenquimales con capacidad pluripotente que utiliza sangre periférica de mamíferos o sus hemoderivados como fuente celular y que incluye las siguientes etapas:
a) centrifugación en gradiente de densidad de dicha sangre periférica o sus hemoderivados para obtener células mononucleares.
b) separación de la fracción celular mononuclear obtenida en la etapa anterior y lavado de la misma con un buffer salino centrifugando hasta obtención de un pellet celular.
c) resuspensión de dicho pellet celular y recuento de células
d) cultivo de dichas células
Dicho cultivo se realiza a partir de una densidad celular inicial comprendida entre 106 células/cm2 y 5 x 106 células/cm2 en un medio de cultivo químicamente definido derivado del alpha-MEM suplementado con glutamina y con al menos un 10% de suero fetal bovino y sobre una matriz extracelular que contenga ligandos de integrinas.
La fuente celular se selecciona entre sangre periférica fresca o criopreservada,...
Reivindicaciones:
1. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente que utiliza sangre periférica de mamíferos o sus hemoderivados como fuente celular y que incluye las siguientes etapas:
a) centrifugación en gradiente de densidad de dicha sangre periférica o sus hemoderivados para obtener células mononucleares.
b) separación de la fracción celular mononuclear obtenida en la etapa anterior y lavado de la misma con un buffer salino centrifugando hasta obtención de un pellet celular.
c) resuspensión de dicho pellet celular y recuento de células
d) cultivo de dichas células
caracterizado porque dicho cultivo se realiza a partir de una densidad celular inicial comprendida entre 106 células/cm2 y 5 x 106 células/cm2 en un medio de cultivo químicamente definido derivado del alpha-MEM suplementado con glutamina y con al menos un 10% de suero fetal bovino y sobre una matriz extracelular que contenga ligandos de integrinas.
2. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 1, caracterizado porque la fuente celular se selecciona entre sangre periférica fresca o criopreservada, sangre periférica movilizada fresca o criopreservada, sangre periférica movilizada y sin movilizar obtenida por técnicas de aféresis fresca o criopreservada, fracción CD34- fresca o criopreservada obtenida de sangre periférica movilizada o buffy coats
3. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 2, caracterizado porque la fuente celular es preferentemente sangre periférica humana procedente de un individuo al cuál se le ha administrado un factor de crecimiento capaz de movilizar los precursores hematopoyéticos a sangre periférica (SP movilizada).
4. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 3, caracterizado porque el factor de crecimiento administrado para movilizar los precursores hematopoyéticos se selecciona entre factor de crecimiento de colonias de granulocitos (G-CSF) o factor de crecimiento de colonias granulomacrofágicas (GM-CSF).
5. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 1 a 4, caracterizado porque las etapas de centrifugación en gradiente de densidad, separación de la fracción celular mononuclear y lavado con buffer salino así como la resuspensión del pellet celular, todas ellas previas al cultivo, se realizan en un rango de tiempo comprendido entre 5 minutos y 48 horas, preferentemente entre 5 minutos y 6 horas.
6. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 5, caracterizado porque se adiciona un anticoagulante, preferentemente heparina, a cualquiera de las fuentes celulares cuando las etapas previas al cultivo se realizan en un periodo de tiempo superior a 5 minutos.
7. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 5 y 6, caracterizado porque la fracción celular mononuclear se somete a criopreservación antes de la etapa de cultivo.
8. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 7, caracterizado porque cuando la fracción celular mononuclear se somete a criopreservación antes de la etapa de cultivo, la resuspensión del pellet celular se lleva a cabo en un medio compuesto por un 90% de suero fetal bovino y un 10% de un crioprotector, preferentemente dimetilsulfóxido (DMSO).
9. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 1 a 8, caracterizado porque el medio químicamente definido derivado del alpha-MEM utilizado para el cultivo de las células se selecciona entre DMEM o Stemline Médium (Sigma-Aldrich) suplementados con glutamina y al menos un 10% de suero fetal bovino.
10. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 1-9, caracterizado porque el medio utilizado para el cultivo de las células es DMEM suplementado con un 20% de suero fetal bovino, glutamina y antibióticos.
11. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 1-10, caracterizado porque la matriz extracelular sobre la que se realiza el cultivo de las células contiene ligandos de receptores con el motivo de unión RGD (arginina-glicina-aspártico).
12. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 11, caracterizado porque la matriz extracelular sobre la que se realiza el cultivo de las células se selecciona entre matrigel, fibronectina, vitronectina, Cultrex Basement Membrane Extract o Dextrosa-Gelatina-Veronal.
13. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según la reivindicación 12, caracterizado porque la matriz extracelular sobre la que se realiza el cultivo de las células es fibronectina a una concentración comprendida entre 1 y 10 µg/cm2.
14. Procedimiento de obtención de células madre mesenquimales con capacidad pluripotente según las reivindicaciones 1-13, caracterizado porque la fuente celular es sangre periférica de aféresis movilizada fresca, realizándose el cultivo partiendo de una concentración inicial de 1,25 x 106 células/cm2 en medio DMEM suplementado con glutamina y un 20% de suero fetal bovino y sobre una matriz de fibronectina a una concentración de 6,25 µg/cm2.
Patentes similares o relacionadas:
COMPOSICIONES PARA LA DERIVACIÓN CULTIVO IN VITRO DE LÍNEAS DE CÉLULAS MADRE EMBRIONARIAS (ES) CON CAPACIDAD DE TRANSMISIÓN DE LA LÍNEA GERMINAL Y PARA EL CULTIVO DE CÉLULAS MADRE ADULTAS, del 4 de Julio de 2011, de THROMBOGENICS N.V.: Un método para obtener, mantener o hacer crecer células madre embrionarias pluripotentes de roedor que comprenden la etapa de cultivar las células durante al menos […]
MEDIO DE CULTIVO CELULAR Y PROCEDIMIENTO DE CULTIVO DE CÉLULAS MADRE Y CÉLULAS PROGENITOR, del 15 de Febrero de 2011, de UNIVERSITÄT LEIPZIG: Utilización de un medio de cultivo celular que contiene menos de 500 mg/l de glucosa y menos de 500 µg/l de inositol, que comprende un medio basal suministrado como una solución […]
 PROCEDIMIENTO PARALA EXPANSION INDIFERENCIADA U ORIENTADA A LINAJE MIELOIDE DE CELULAS MADRE HEMATOPOYETICAS PROCEDENTES DE SANGRE DE CORDONUMBILICAL, SANGRE PERIFERICA MOVILIZADA O MEDULA OSEA, del 21 de Enero de 2011, de BANC DE SANG I TEIXITS: Procedimiento para la expansión indiferenciada u orientada a linaje mieloide de células madre hematopoyéticas (CMH). Más específicamente, la presente […]
PROCEDIMIENTO PARALA EXPANSION INDIFERENCIADA U ORIENTADA A LINAJE MIELOIDE DE CELULAS MADRE HEMATOPOYETICAS PROCEDENTES DE SANGRE DE CORDONUMBILICAL, SANGRE PERIFERICA MOVILIZADA O MEDULA OSEA, del 21 de Enero de 2011, de BANC DE SANG I TEIXITS: Procedimiento para la expansión indiferenciada u orientada a linaje mieloide de células madre hematopoyéticas (CMH). Más específicamente, la presente […]
 EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
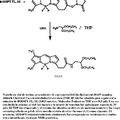 BODIPY AMINOACETALDEHIDO DIETIL ACETAL, del 26 de Julio de 2010, de DUKE UNIVERSITY: Compuesto de fórmula
BODIPY AMINOACETALDEHIDO DIETIL ACETAL, del 26 de Julio de 2010, de DUKE UNIVERSITY: Compuesto de fórmula
 POLIPEPTIDOS LIGANDOS PARA SELECTINA-E/SELECTINA-L DE LA CELULA HEMATOPOYETICA Y METODOS DE UTILIZACION DE LOS MISMOS, del 12 de Mayo de 2010, de THE BRIGHAM AND WOMEN'S HOSPITAL, INC.: Un polipéptido glucosilado sustancialmente purificado, dicho polipéptido glucosilado comprende un eje polipéptido CD44 en el que dicho polipéptido glucosilado […]
POLIPEPTIDOS LIGANDOS PARA SELECTINA-E/SELECTINA-L DE LA CELULA HEMATOPOYETICA Y METODOS DE UTILIZACION DE LOS MISMOS, del 12 de Mayo de 2010, de THE BRIGHAM AND WOMEN'S HOSPITAL, INC.: Un polipéptido glucosilado sustancialmente purificado, dicho polipéptido glucosilado comprende un eje polipéptido CD44 en el que dicho polipéptido glucosilado […]
 METODO Y APARATO PARA MANTENIMIENTO Y EXPASION DE CELULAS MADRE HEMOPOYETICAS Y/O CELULAS PROGENITORAS, del 7 de Mayo de 2010, de TECHNION RESEARCH & DEVELOPMENT FOUNDATION LTD.: Un método para expandir/mantener ex-vivo células madre hemopoyéticas no diferenciadas o células progenitoras, comprendiendo el método las etapas de:
(a) cultivar en […]
METODO Y APARATO PARA MANTENIMIENTO Y EXPASION DE CELULAS MADRE HEMOPOYETICAS Y/O CELULAS PROGENITORAS, del 7 de Mayo de 2010, de TECHNION RESEARCH & DEVELOPMENT FOUNDATION LTD.: Un método para expandir/mantener ex-vivo células madre hemopoyéticas no diferenciadas o células progenitoras, comprendiendo el método las etapas de:
(a) cultivar en […]
Espumas de fibroína de seda inyectables y usos de la misma, del 1 de Abril de 2020, de TRUSTEES OF TUFTS COLLEGE: Un aplicador de inyección que comprende una composición inyectable, la composición inyectable comprende una espuma de fibroína de seda comprimida que tiene […]