EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES.
Un método de expansión de una población de células madre hematopoyéticas ex vivo,
mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas células madre ex vivo, comprendiendo el método:
cultivar dichas células madre ex vivo en presencia de citoquinas y nicotinamida, de un análogo de nicotinamida, de un derivado de nicotinamida o de un análogo de nicotinamida o de un metabolito de nicotinamida o de un análogo de nicotinamida, en el que dicho análogo de nicotinamida se selecciona entre el grupo constituido por benzamida, nicotintioamida, ácido nicotínico y ácido a-amino-3-indolpropiónico, dicho derivado de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por nicotinamidas y nicotintioamidas N-sustituidas y dicho metabolito de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por NAD, NADH y NADPH;
expandiendo de este modo la población de dichas células madre mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas células madre ex vivo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IL03/00064.
Solicitante: GAMIDA CELL LTD.
Nacionalidad solicitante: Israel.
Dirección: 5 NAHUM HAFZADI STREET, OFER BUILDING, GIVAT SHAUL,95 484 JERUSALEM.
Inventor/es: PELED,TONY, TREVES,AVI, ROSEN,OREN.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07C51/09 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 51/00 Preparación de ácidos carboxílicos o sus sales, haluros o anhídridos. › a partir de lactonas o de ésteres de ácidos carboxílicos (saponificación de ésteres de ácidos carboxílicos C07C 27/02).
- C12N5/06B11P
- C12N5/06B14
- G01N33/50D2
- G01N33/50D6
Clasificación PCT:
- C12N5/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Clasificación antigua:
- C12N1/00 C12N […] › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
Fragmento de la descripción:
Expansión de poblaciones de células madre renovables.
Campo y Antecedentes de la invención
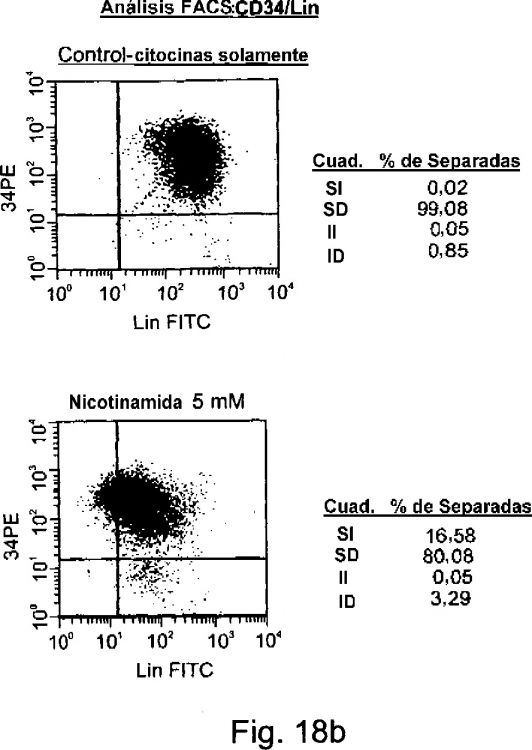
La presente invención se refiere a métodos de expansión de células madre renovables, a poblaciones expandidas de células madre renovables y a sus usos. En particular, la presente invención se refiere a métodos para reducir la expresión y/o actividad de CD38. La expansión de células madre ex vivo y/o in vivo se consigue mediante la regulación negativa de la señalización del receptor de ácido retinoico (RAR), el receptor de retinoides X (RXR), y/o el receptor de la Vitamina D (VDR), a nivel de proteínas mediante antagonistas de RAR, RXR y/o VDR o a nivel de la expresión mediante técnicas de ingeniería genética, tales como técnicas de ARN interferente pequeño (ARNip). La expansión ex vivo y/o in vivo de células madre se consigue mediante la regulación negativa de CD38 a nivel de proteínas mediante inhibidores de CD38, tales como, por ejemplo, nicotinamida, o a nivel de la expresión mediante técnicas de ingeniería genética, tales como técnicas de ARN interferente pequeño (ARNip). La presente invención se refiere además a aplicaciones terapéuticas en las que se utilizan estos métodos y/o las poblaciones de células madre expandidas obtenidas de este modo.
Ha surgido una necesidad cada vez mayor de cultivos ex vivo de células madre hematopoyéticas y no hematopoyéticas, en particular para fines tales como expansión de células madre y transducción génica mediada por retrovirus. Los métodos para generar cultivos ex vivo de células madre hasta la fecha, sin embargo, dan como resultado un rápido declive de la actividad de la población de células madre, que da como resultado además un potencial de auto-renovación marcadamente alterado y una reducida transplantabilidad de las poblaciones de células cultivadas. La necesidad de mejorar dichos métodos es obvia. Adicionalmente, las aplicaciones en terapia génica que usan vectores retrovirales necesitan el uso de células madre hematopoyéticas proliferantes, aunque requieren que estas células permanezcan indiferenciadas mientras están en cultivo, para mantener la expresión a largo plazo del gen transducido. Por lo tanto, la capacidad de mantener cultivos ex vivo de poblaciones de células madre hematopoyéticas y no hematopoyéticas con capacidad de auto-renovación a largo plazo es de importancia crítica para una amplia serie de aplicaciones médicas y terapéuticas.
Actualmente, la expansión de células madre renovables se ha conseguido cultivando las células madre sobre una capa nutritiva de fibroblastos, o cultivando las células en presencia de las citoquinas de acción temprana trombopoyetina (TPO), interleuquina-6 (IL-6), un ligando de FLT-3 y el factor de células madre (SCF) (Madlambayan GJ et al (2001) J Hematother Stem Cell Res 10: 481, Punzel M et al (1999) Leukemia 13: 92, y Lange W et al (1996) Leukemia 10: 943). Mientras que la expansión de células madre sobre una capa nutritiva da como resultado una amplia, sustancialmente sin fin expansión celular, la expansión de las células madre sin una capa nutritiva, en presencia de las citoquinas de acción temprana, da como resultado un elevado grado de diferenciación (véase los controles descritos en la sección de Ejemplos y Leslie NR et al (Blood (1998) 92: 4798), Petzer AL et al (1996) J Exp Med Jun 183: 2551, Kawa Y et al (2000) Pigment Cell Res 8: 73).
En cualquier caso, usando tecnología actual, las células madre no pueden expandirse a menos que en primer lugar se enriquezcan sustancialmente o se aíslen hasta homogeneidad.
La técnica actualmente no consigue enseñar un método eficaz para la expansión de células madre renovables sin una capa nutritiva.
CD38 es un miembro de una familia emergente de enzimas citosólicas y unidas a la membrana cuyo sustrato es nicotinamida adenin dinucleótido (NAD), una coenzima distribuida de forma ubicua en la naturaleza. En el ser humano, CD38 es una glucoproteína trans-membrana de tipo II de 45 kDa. Recientemente, se ha demostrado que CD38 es una enzima multifuncional que ejerce actividad NAD+ glucohidrolasa y actividad ADP-ribosil ciclasa y, por lo tanto, es capaz de producir nicotinamida, ADP-ribosa (ADPR), ADPR cíclica (cADPR) y ácido nicotínico adenin dinucleótido fosfato (NAADP) a partir de sus sustratos (Howard et al., 1993 Science 252: 1056-1059; Lee et al., 1999 Biol. Chem. 380; 785-793). El dominio soluble de CD38 humano cataliza la conversión de NAD+ en ADP cíclico-ribosa y en ADP-ribosa mediante un intermedio covalente común (Sauve, A. A., Deng, H. T., Angelletti, R. H., y Schramm, V. L. (2000) J. Am. Chem. Soc. 122, 7855-7859).
Sin embargo, se descubrió además que CD38 no solamente se caracteriza por actividad multienzimática, sino que es capaz además de movilizar calcio, de transducir señales y de adherirse a hialuronano y a otros ligandos. La interacción con CD38 en diversas subpoblaciones de leucocitos tiene efectos profundos aunque diversos sobre su esperanza de vida (Funaro A, Malavasi F J Biol Regul Homeost Agents, Enero-Marzo de 1999; 13 (1): 54-61 Human CD38, a surface receptor, an enzyme, an adhesion molecule and not a simple marker).
CD38 se expresa ampliamente en células obtenidas de forma hematopoyética y no hematopoyética. También se ha descubierto que los homólogos de CD38 se expresan en células del estroma de mamíferos (Bst-1) y en células aisladas del invertebrado Aplysia californica (Prasad GS, 1996, nature Structural Biol 3: 957-964).
Dos de los metabolitos producidos por CD38, cADPR y NAADP, han demostrado inducir la liberación de calcio intracelular en células aisladas de tejidos de plantas, invertebrados y mamíferos, lo que sugiere que estos metabolitos pueden ser reguladores globales de las respuestas al calcio (Lee et al., 1999 Biol. Chem. 380; 785-793). Se sabe que tanto cADPR como NAADP inducen la liberación de calcio de depósitos de calcio que son distintos de los controlados por receptores de Ip3 (Clapper, D L et al., 1987, J. Biological Chem. 262: 9561-9568).
Por lo tanto, CD38, siendo la ADP-ribosil ciclasa de mamífero mejor caracterizada, se postula para ser una importante fuente de ADP-ribosa cíclica in vivo.
Los iones de calcio nucleoplásmico (Ca+2) influyen en gran medida sobre funciones nucleares importantes tales como la transcripción génica, apoptosis, reparación de ADN, activación de topoisomerasa y desplegamiento de polimerasa. Aunque los receptores de inositol trisfosfato y los receptores rianodina, que son tipos de canal de Ca+2, están presentes en la membrana nuclear, su papel en la homeostasis de Ca+2 nuclear sigue sin estar claro.
Se descubrió que CD38/ADP-ribosil ciclasa tiene su sitio catalítico dentro del nucleoplasma y, por lo tanto, cataliza la cliclación intranuclear de NAD+, para producir cADPR nucleoplásmico. Este último activa los receptores de rianodina de la membrana nuclear interna para desencadenar la liberación de Ca+2 nucleoplásmico (Adebanjo OA et al. Nat Cell Biol noviembre de 1999; 1 (7): 409-14 A new function for CD38/ADP-ribosyl cyclase in nuclear Ca2+ homeostasis).
Se descubrió además que los agonistas de receptores de rianodina sensibilizan la liberación de calcio mediada por cADPR y los antagonistas de receptores de rianodina bloquean la liberación de calcio dependiente de cADPR (Galione A et al., 1991, Science 253: 143-146). Por lo tanto, se ha propuesto que es probable que cADPR regule las respuestas al calcio en tejidos tales como músculo y páncreas, en los que los receptores de rianodina se expresan (Day et al., 2000 Parasitol 120: 417-422; Silva et al., 1998, Biochem. Pharmacol 56: 997-1003). También se ha demostrado que, en células de músculo liso de mamífero, la liberación de calcio en respuesta a acetilcolina puede bloquearse no solamente con antagonistas del receptor de rianodina, sino también con antagonistas específicos de cADPR tales como 8-NH2-cADPR o 8-Br-cADPR (Guse, A H, 1999, Cell. Signal. 11: 309-316). Estos descubrimientos, así como otros, indican que los agonistas/antagonistas del receptor de rianodina tales como cADPR pueden regular las respuestas al calcio en células aisladas de diversas especies.
Como se ha descrito anteriormente en este documento, la auto-renovación de células madre y progenitoras hematopoyéticas (HPC), tanto in vivo como in vitro, está...
Reivindicaciones:
1. Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas células madre ex vivo, comprendiendo el método:
2. El método de cualquiera de la reivindicación 1, en el que dichas células madre se obtienen de una fuente seleccionada entre el grupo constituido por médula ósea, sangre periférica y sangre del cordón umbilical de neonato.
3. El método de la reivindicación 2, en el que dichas células madre hematopoyéticas están mezcladas con células comprometidas.
4. El método de la reivindicación 1, en el que dichas células madre están enriquecidas en células CD34+ hematopoyéticas.
5. El método de la reivindicación 4, en el que dichas células hematopoyéticas se caracterizan por una ausencia, o expresión significativamente reducida de antígenos de superficie celular, CD3, CD61, CD19, CD33, CD14, CD15 o CD4.
6. El método de la reivindicación 1, en el que dichas citoquinas son citoquinas de acción temprana y/o citoquinas de acción tardía.
7. El método de la reivindicación 6, en el que dichas citoquinas de acción temprana se seleccionan entre el grupo constituido por: factor de células madre, ligando FLT3, interleuquina-1, interleuquina-2, interleuquina-3, interleuquina-6, interleuquina-10, interleuquina-12, factor de necrosis tumoral-a y trombopoyetina y en el que dichas citoquinas de acción tardía se seleccionan entre el grupo constituido por: factor estimulador de colonias de granulocitos, factor estimulador de colonias de granulocitos/macrófagos, eritropoyetina, FGF, EGF, NGF, VEGF, LIF, factor de crecimiento de hepatocitos y factor estimulador de colonias de macrófagos.
8. Un método de modificación genética de células madre hematopoyéticas con un exógeno, comprendiendo dicho método:
9. El método de la reivindicación 8, en el que el exógeno se proporciona en un vector.
10. El método de la reivindicación 9, en el que el vector es un vector viral o un vector de ácido nucleico.
11. Un método de conservación de células madre hematopoyéticas que comprende:
12. Una preparación de células madre hematopoyéticas transplantables que comprende:
13. Uso de nicotinamida, de un análogo de nicotinamida, de un derivado de nicotinamida o de un análogo de nicotinamida o de un metabolito de nicotinamida o de un análogo de nicotinamida, para conservar células madre hematopoyéticas ex vivo, en el que dicho análogo de nicotinamida se selecciona entre el grupo constituido por benzamida, nicotintioamida, ácido nicotínico y ácido a-amino-3-indolpropiónico, dicho derivado de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por nicotinamidas y nicotintioamidas N-sustituidas y dicho metabolito de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por NAD, NADH y NADPH.
14. Uso de nicotinamida, un análogo de nicotinamida, un derivado de nicotinamida o de un análogo de nicotinamida o un metabolito de nicotinamida o de un análogo de nicotinamida, en el que dicho análogo de nicotinamida se selecciona entre el grupo constituido por benzamida, nicotintioamida, ácido nicotínico y ácido a-amino-3-indolpropiónico, dicho derivado de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por nicotinamidas y nicotintioamidas N-sustituidas y dicho metabolito de nicotinamida o de un análogo de nicotinamida se selecciona entre el grupo constituido por NAD, NADH y NADPH, para la preparación de una composición farmacéutica para expandir una población de células madre hematopoyéticas, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas células madre.
15. Uso de una preparación de células madre hematopoyéticas de acuerdo con la reivindicación 12, para la preparación de una composición farmacéutica para transplantar o implantar células hematopoyéticas.
16. Uso de una preparación de células madre hematopoyéticas de acuerdo con la reivindicación 12, para la preparación de una composición farmacéutica para inmunoterapia adoptiva.
17. Un método de preparación de células madre hematopoyéticas para transplante en un sujeto, método que comprende:
18. El método de una cualquiera de las reivindicaciones 1 a 11 ó 17, la preparación de células madre hematopoyéticas de la reivindicación 12 o el uso de una cualquiera de las reivindicaciones 13 a 16, en el que dicha nicotinamida, análogo de nicotinamida, derivado de nicotinamida o de un análogo de nicotinamida o metabolito de nicotinamida o de un análogo de nicotinamida es nicotinamida.
19. El uso de la reivindicación 16, en el que dicha preparación de células madre comprende células presentadoras de antígeno.
Patentes similares o relacionadas:
Procedimiento mejorado para la hidrólisis de triglicéridos de ácido dicarboxílico, del 22 de Abril de 2020, de NOVAMONT S.P.A.: Proceso para la preparación de ácidos dicarboxílicos a partir de triglicéridos de ácidos carboxílicos que tienen más de un grupo funcional ácido, que comprende los pasos […]
Proceso para despolimerizar cutina, del 11 de Marzo de 2020, de Apeel Technology Inc: Un método para preparar monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos derivados de la cutina a partir de material vegetal que contiene […]
Método y aparato para el reciclaje de materiales poliméricos a través del proceso de despolimerización, del 11 de Marzo de 2020, de GR3N SAGL: Un método para el reciclaje de poliésteres y/o poliamidas a través del proceso de despolimerización, que comprende una reacción de despolimerización del material que se va […]
Proceso de fabricación de ácido acrílico, del 5 de Febrero de 2020, de PURAC BIOCHEM BV: Proceso de preparación de ácido acrílico y/o el éster de ácido acrílico y ácido láctico a partir de un oligómero o polímero de ácido láctico, […]
Síntesis de ácido metacrílico a partir de metacrilato de alquilo basado en metacroleína, del 12 de Junio de 2019, de ROHM GMBH: Procedimiento para la preparación de metacrilatos de alquilo y ácido metacrílico, que presenta los siguientes pasos del proceso: a) síntesis […]
Producción de combustible a partir de sustancias químicas derivadas de biomasa, del 24 de Abril de 2019, de Enlighten Innovations Inc: Un procedimiento para formar un compuesto combustible de hidrocarburo que comprende: obtener una cantidad de azúcar hexosa; hacer reaccionar el azúcar […]
Procedimiento para la preparación y el aislamiento de ésteres de ácido carboxílico, del 27 de Febrero de 2019, de ThyssenKrupp Industrial Solutions AG: Procedimiento para la preparación y el aislamiento de ésteres de ácido carboxílico de ácidos mono- y dicarboxílicos, ácidos hidroxicarboxílicos y ácidos grasos […]
Carbonilación de compuestos etilénicamente insaturados, del 15 de Febrero de 2019, de LUCITE INTERNATIONAL UK LIMITED: Un procedimiento para la carbonilación de compuestos etilénicamente insaturados que comprende hacer reaccionar dicho compuesto con monóxido de carbono en presencia […]