METODO Y APARATO PARA MANTENIMIENTO Y EXPASION DE CELULAS MADRE HEMOPOYETICAS Y/O CELULAS PROGENITORAS.
Un método para expandir/mantener ex-vivo células madre hemopoyéticas no diferenciadas o células progenitoras,
comprendiendo el método las etapas de:
(a) cultivar en un biorreactor de flujo por conexión en fase estacionaria un cultivo de células estromales que comprende macrófagos, fibroblastos, adipositos y células endoteliales bajo flujo continuo de un medio de cultivo sobre un sustrato en la forma de una lámina, comprendiendo dicho sustrato una matriz fibrosa no tejida que forma una red tridimensional fisiológicamente aceptable de fibras para generar con la misma un cultivo de células estromales tridimensional; y
(b) sembrar las células madre hemopoyéticas no diferenciadas aisladas o células progenitoras en dicho biorreactor de flujo por conexión en fase estacionaria incluyendo, dicho cultivo de células estromales tridimensional y dicho flujo continuo de dicho medio de cultivo, expandiendo/manteniendo por lo tanto ex-vivo las células madre hemopoyéticas no diferenciadas aisladas o células progenitoras
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US00/02688.
Solicitante: TECHNION RESEARCH & DEVELOPMENT FOUNDATION LTD.
Nacionalidad solicitante: Israel.
Dirección: TECHNION CITY,HAIFA 32000.
Inventor/es: MERCHAV,SHOSHANA, MERETSKI,SHAI.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C12M3/04 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › C12M 3/00 Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus. › con medios que alimentan capas finas.
- C12N5/06B11P
Clasificación PCT:
- A61F2/02 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › A61F 2/00 Filtros implantables en los vasos sanguíneos; Prótesis, es decir, elementos de sustitución o de reemplazo para partes del cuerpo; Dispositivos para unirlas al cuerpo; Dispositivos para proporcionar permeabilidad o para evitar que colapsen las estructuras tubulares del cuerpo, p. ej. stents (como artículos cosméticos, ver las subclases apropiadas, p. ej. pelucas o postizos, A41G 3/00, A41G 5/00, uñas artificiales A45D 31/00; prótesis dentales A61C 13/00; materiales para prótesis A61L 27/00; riñones artificiales A61M 1/14; corazones artificiales A61M 60/00). › Prótesis implantables en el cuerpo.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- C12M3/04 C12M 3/00 […] › con medios que alimentan capas finas.
- C12N11/02 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 11/00 Enzimas fijadas sobre un soporte o inmovilizadas; Células microbianas fijadas sobre un soporte o inmovilizadas; Su preparación. › Enzimas o células microbianas inmovilizadas sobre o en un soporte orgánico.
- C12N11/08 C12N 11/00 […] › siendo el soporte un polímero sintético.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/06
Clasificación antigua:
- A61F2/02 A61F 2/00 […] › Prótesis implantables en el cuerpo.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- C12M3/04 C12M 3/00 […] › con medios que alimentan capas finas.
- C12N11/02 C12N 11/00 […] › Enzimas o células microbianas inmovilizadas sobre o en un soporte orgánico.
- C12N11/08 C12N 11/00 […] › siendo el soporte un polímero sintético.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/06
Fragmento de la descripción:
Método y aparato para mantenimiento y expansión de células madre hemopoyéticas y/o células progenitoras.
La presente invención se relaciona con un método para expandir/mantener células madre hemopoyéticas diferenciadas de acuerdo con la reivindicación 1, y 20, un método para preparar un medio celular estromal acondicionado de acuerdo con la reivindicación 38.
El uso de células madre hemopoyéticas no diferenciadas de acuerdo con la reivindicación 50.
La presente invención se relaciona con un método y aparato para mantenimiento y expansión de células madre hemopoyéticas. Más particularmente, la presente invención se relaciona con un birreactor de flujo de conexión celular estromal tridimensional para el mantenimiento y/o expansión de células madre hemopoyéticas y/o para la producción de un medio acondicionado para el mantenimiento y/o expansión de células madre hemopoyéticas.
El sistema hemopoyético en los mamíferos está compuesto de una población heterogénea de células que varían en función desde las células maduras con potencial proliferativo limitado a células madre pluripotentes con capacidades proliferativas, diferenciadoras y autorrenovadoras extensas (1-3). Las células madre hemopoyéticas (HSC) son requeridas exclusivamente para la reconstitución hemopoyética que sigue a los transplantes y sirve como un objetivo primario para la terapia de genes. A pesar del papel clave de las células madre en el mantenimiento del sistema hemopoyético, su frecuencia extremadamente baja en el tejido hemopoyético, así como la capacidad limitada para mantener o expandir las células madre no diferenciadas bajo condiciones ex-vivo durante períodos prolongados de tiempo, no solamente sigue siendo una desventaja principal para las aplicaciones clínicas esenciales de estas células, sino que también refleja la no disponibilidad actual de, y la necesidad de, novedosos reguladores de células madre.
Se acepta ampliamente que las células madre están asociadas íntimamente in vivo con nichos discretos dentro de la médula (4-6) que proporciona señales moleculares que median de manera colectiva su diferenciación y autorrenovación, a través de contactos célula-célula o interacciones de rango corto (7). Estos nichos son parte del "microambiente inductivo hemopoyético" (HIM), compuesto de células estromales medulares, por ejemplo, macrófagos, fibroblastos, adipositos y células endoteliales (8). Las células estromales de médula mantienen la integridad funcional del HIM proporcionando proteínas de matriz extracelular (ECM) y componentes de cimentación de membrana que facilitan el contacto célula-célula (9-11). También proporcionan diversas citoquinas solubles o residentes necesarias para la diferenciación y proliferación celular hemopoyética controlada (12-14).
A la vista de lo anterior, no es sorprendente que los esfuerzos para desarrollar sistemas de cultivo para el mantenimiento prolongado de HSC humanas estuvieran enfocados principalmente en el uso de monocapas de células estromales de médula primaria preestablecidas. Esto incluía cultivos a largo término de estromas de médula humanos primarios no irradiados (cultivos Dexter, 15) o irradiados (16-19), así como líneas celulares estromales humanas o de murina (16, 19-24), con o sin citoquinas añadidas exógenamente. Las pruebas de salida para HSC inicialmente se basaban en la capacidad de células para producir progenie mieloide (células que inician un cultivo a largo término; LTC-IC) o para generar colonias con morfología (células que forman área de canto rodado; CAFC) después del cultivo prolongado sobre a tales células estromales (16, 17). A pesar del amplio uso de las pruebas de LTC-IC y CAFC, se hace más obvio, sin embargo, que detecten progenitores altamente primitivos, más que las verdaderas células madre hemopoyéticas repobladoras (25, 26).
Un estudio de células madre humanas recientemente desarrollado detecta una célula de repoblación de SCID (SRC), la cual se aloja en la médula ósea de ratones diabéticos no obesos (NOD)/SCID (27), donde da lugar a poblaciones progenitoras humanas mieloide, linfoide, eritroide y CD34+ (28-30). El SRC se encuentra exclusivamente en fracciones celulares hemopoyéticas que expresan el antígeno de superficie CD34+38- (31) y su frecuencia en CB (1/3x105 células) es enriquecido en comparación con BM (1/9x105 células) o PB movilizado (1//6x106 células) (32). Estudios muy recientes mostraron que la SRC reside dentro de una subpoblación de células CD34+/38-/CXCR4+ (33). El CXR4, un receptor de superficie del factor 1 derivado de células estromales de quimoquina (SDF-1, 34), es aparentemente esencial para el alojamiento e inserción de células madre hemopoyéticas humanas en la médula NOD/SCID (33).
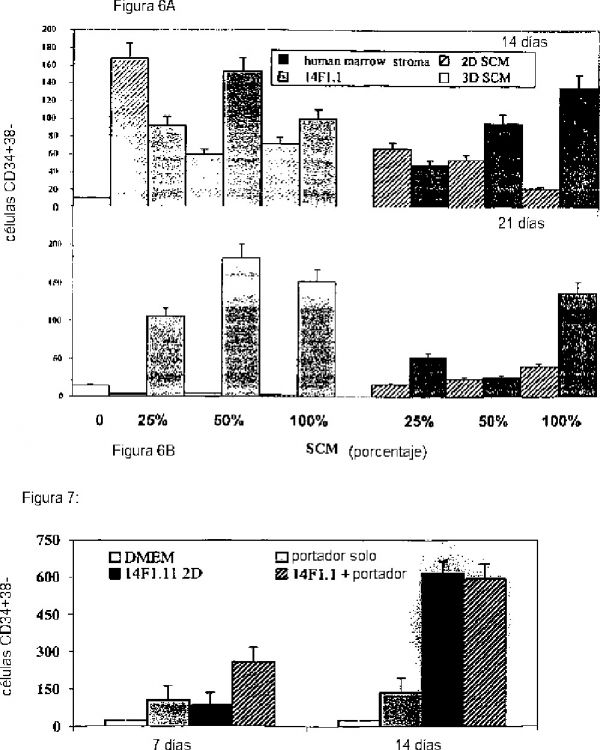
Los estudios tendientes al mantenimiento/expansión prolongado inducido de HSC humanas sobre cultivos de células estromales se basaron principalmente en fenotipos de CAFC, LTC-IC o CD34+38- como ensayos de prueba de punto final (16, 19-24). Los escasos reportes de mantenimiento/expansión de SRC en cultivos celulares estromales fallan al indicar un soporte a largo término significativo. Por ejemplo, las estromas de médula humana alogénicas se encontraron que inducían a mantenimiento a término corto (7 días) de SRC, seguido por un rápido y marcado descenso (6 veces) en la actividad (26). La incapacidad para soportar el mantenimiento/expansión a largo término de células madre humanas transplantables o sus capas de células estromales, puede atribuirse a varios factores relacionados con los cultivos in vitro de estas células. Entre estos, uno puede incluir el uso de monocapas celulares estromales, que no reflejan las condiciones de crecimiento in vivo dentro de la estructura natural tridimensional de la médula ósea. Tales condiciones pueden disminuir la capacidad de las células estromales para proveer y el microambiente de soporte apropiado óptimo, así como la capacidad de las células madre para localizarse en nichos específicos y para interactuar físicamente con células estromales y sus productos. En efecto, la evidencia de la importancia de una estructura tridimensional (3D) para la actividad biológica de células progenitoras hemopoyéticas, es provista por el crecimiento superior de unas líneas celular hemopoyética humana sobre células estromales sembradas en una matriz de colágeno 3D, en comparación con su proliferación sobre monocapas de tales células (35). De forma más importante, un biomaterial poroso recubierto con tántalo 3D, demostró recientemente que potencia el mantenimiento a corto término de células LTCIC o CD34+38- de macaco, en comparación con células cultivadas solas o sobre monocapas celulares estromales de médula (36). El efecto de los portadores 3D con recubrimiento de células endoteliales ha sido investigado en WO95/19793.
Estudio recientes han mostrado que la línea celular AFT024 de murina es superior al estroma humano, en el soporte de supervivencia y mantenimiento por 2-3 semanas (a pesar de no tener expansión) de CB SRC (37) humanas. Se ha encontrado que esta línea expresa varios novedosos genes HIM que codifican proteínas de enlace a la membrana (21, 38, 39), que pueden tener un papel esencial en la fisiología de las células madre. La posible expresión de estos y otros genes por células estromales bajo condiciones que imitan de manera más cercana su microambiente medular 3D, y así potencia su actividad funcional fisiológica óptima, no ha sido determinada aún.
Estudios extensos han mostrado que los cultivos sin contacto estromal (19, 21, 22, 40, 41) o medios condicionados de estroma (SCM) (21, 42-44), solo o con citoquinas, puede soportar el mantenimiento o expansión ex-vivo de progenitores hemopoyéticos primitivos. El SCM también ha demostrado mejorar la recuperación y eficiencia de la transducción de tales células (45, 46). Mientras que estos hallazgos de nuevo potencian la importancia de los factores celulares estromales solubles, el uso de los puntos finales de LTC-IC, CAFC o CD34+38- en tales pruebas no pueden reflejar el efecto de SMC sobre el mantenimiento/expansión de HSC transplantable. Adicionalmente, no se sabe si el SCM obtenido a partir de cultivos monocapa de células estromales, contiene en efecto todos los productos genéticos asociados con las células estromales involucrados en la fisiología HSC humana.
La atención reciente que apunta hacia la expansión ex-vivo de células madre hemopoyéticas transplantables se ha enfocado en el establecimiento de cultivos de suspensión suplementados con citoquina (47-53)....
Reivindicaciones:
1. Un método para expandir/mantener ex-vivo células madre hemopoyéticas no diferenciadas o células progenitoras, comprendiendo el método las etapas de:
2. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras son células aisladas a partir de un tejido seleccionado del grupo consistente de sangre de cordón umbilical, sangre periférica movilizada y médula ósea.
3. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras y células estromales de dicho cultivo de células estromales comparten antígenos HLA comunes.
4. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras y células estromales de dicho cultivo de células estromales son de un individuo en particular.
5. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras y células estromales de dicho cultivo de células estromales son de individuos diferentes.
6. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras y células estromales de dicho cultivo de células estromales son de la misma especie.
7. El método de la reivindicación 1, donde dichas células madre hemopoyéticas no diferenciadas o células progenitoras y células estromales de dicho cultivo de células estromales son de especies diferentes.
8. El método de la reivindicación 1, donde dichas células estromales de dicho cultivo de células estromales son cultivadas hasta una densidad de al menos 5x106 células por centímetro cúbico de dicho sustrato.
9. El método de la reivindicación 1, donde dichas células estromales de dicho cultivo de células estromales se cultiva hasta una densidad de al menos 107 células por centímetro cúbico de dicho sustrato.
10. El método de la reivindicación 1, donde dicha etapa de sembrar dichas células madre hemopoyéticas no diferenciadas o células progenitoras en dicho biorreactor de flujo por conexión en fase estacionaria se efectúa mientras que el flujo en dicho biorreactor es cortado durante al menos 10 horas después de dicha siembra.
11. El método de la reivindicación 1, donde dichas fibras forman un volumen de poro como un porcentaje del volumen total de 40 a 95% y un tamaño de poro de 10 micrones a 100 micrones.
12. El método de la reivindicación 1, donde dicha matriz está hecha de fibra seleccionada del grupo consistente de fibras planas, no redondeadas y huecas y mezclas de las mismas, siendo dichas fibras desde 0.5 micrones a 50 micrones en diámetro o anchura.
13. El método de la reivindicación 1, donde dicha matriz está compuesta de fibras formadas por cintas que tienen una anchura de 2 micrones a 20 micrones, y donde la proporción de anchura a espesor de las fibras es al menos 2:1.
14. El método de la reivindicación 1, donde dicha matriz tiene un volumen de poro como un porcentaje del volumen total de 60 a 95%.
15. El método de la reivindicación 1, donde la matriz tiene una altura de 50-1000 µm.
16. El método de la reivindicación 1, donde el material de la matriz es seleccionado del grupo consistente de poliésteres, polialquilenos, polifluorocloroetilenos, cloruro de polivinilo, poliestireno, polisulfonas, acetato de celulosa, fibras de vidrio y fibras de metales inertes.
17. El método de la reivindicación 1, donde la matriz es en una forma seleccionada del grupo consistente de cuadrados, anillos, discos y cruciformes.
18. El método de la reivindicación 1, donde la matriz está en forma de un disco.
19. El método de la reivindicación 1, donde la matriz está recubierta con poli-D-lisina.
Patentes similares o relacionadas:
Cámara de centrifugación con capas de membranas permeables a los gases para cultivo celular, del 21 de Agosto de 2019, de Miltenyi Biotec B.V. & Co. KG: Una cámara centrífuga que comprende un cilindro que tiene una placa base y una placa de cubierta , un eje geométrico de rotación con al menos un orificio […]
Procedimiento para la hibridación activa en chips de ADN con función desnaturalizadora, del 24 de Junio de 2019, de ROBERT BOSCH GMBH: Procedimiento para la hibridación activa con al menos una sonda de un chip de ADN que comprende las siguientes etapas: a. preparar un líquido […]
Sistema automatizado de ingeniería de tejidos, del 22 de Mayo de 2019, de Octane Biotech Inc: Un método para (a) la proliferación automatizada de células autólogas, alogénicas o xenogénicas para uso en procedimientos de ingeniería de tejidos, […]
Método y dispositivo para modificación celular, del 14 de Noviembre de 2018, de MILTENYI BIOTEC GMBH: Un dispositivo de modificación celular que comprende una cámara de centrifugación con por lo menos una superficie de modificación celular con un vector normal […]
Recipiente y procedimiento de producción de biomembrana, del 22 de Marzo de 2017, de HSU, CONNIE HUI-JU: Un recipiente para cultivar una biomembrana que comprende: una placa de fondo ; una pared lateral situada en la placa de fondo y rodeando […]
Método para esporular oocistos de coccidio purificados de heces animales, los oocistos esporulados obtenidos por este método y una vacuna que contiene estos oocistos esporulados, del 8 de Febrero de 2017, de INTERVET INTERNATIONAL B.V: Un método para esporular oocistos de coccidio purificados de heces animales , comprendiendo el método proporcionar los oocistos purificados como una capa sobre […]
Fabricación de tejido vascularizado usando moldes bidimensionales microfabricados, del 15 de Junio de 2016, de THE GENERAL HOSPITAL CORPORATION: Un aparato de preparación de láminas de tejido en el que el aparato comprende múltiples capas de láminas de tejido apiladas y unidas entre sí, en el que cada capa […]
 Biorreactor rotatorio de cámara doble: métodos y usos del mismo, del 20 de Enero de 2016, de Association For The Advancement Of Tissue Engineering And Cell Based Technologies & Therapies (A4TEC): Un biorreactor que comprende una placa de agitación magnética multiposición sobre la que se colocan al menos dos cámaras dobles, una placa superior que se encaja […]
Biorreactor rotatorio de cámara doble: métodos y usos del mismo, del 20 de Enero de 2016, de Association For The Advancement Of Tissue Engineering And Cell Based Technologies & Therapies (A4TEC): Un biorreactor que comprende una placa de agitación magnética multiposición sobre la que se colocan al menos dos cámaras dobles, una placa superior que se encaja […]