PROCEDIMIENTO PARA LA PREPARACION DE LOSARTAN.
Procedimiento para la preparación de un compuesto de fórmula general I,
**(Ver fórmula)** en la que R1 es un resto R1a o un resto R1b, - siendo R1a un resto de fórmula general II **(Ver fórmula)** en la que R2 significa un grupo protector de tetrazol, o - siendo R1b un resto que puede acoplar el grupo fenileno del compuesto de fórmula general I mediante reacción con un resto R3 complementario a éste que es constituyente de un compuesto de fórmula general III que contiene otra unidad de fenileno: R3 - R4 III en la que R4 es un resto de fórmula general II, con formación de un enlace C-C entre el grupo fenileno del compuesto de fórmula general I y el grupo fenileno del compuesto de fórmula general III, eligiéndose R1b y R3 de manera que formen uno de los siguientes pares complementarios: a) halógeno y un resto de fórmula general VI; **(ver fórmula)** en la que R8 y R9 significan hidrógeno, un grupo alquilo C1 a C6 o conjuntamente un grupo alcanodiílo C1 a C6, b) halógeno y un resto de trialquilestaño; y c) halógeno y un resto de halogenuro de magnesio (II); haciendo reaccionar un compuesto de fórmula general IV **(Ver fórmula)** en la que R5 - para el caso en que R1 en la fórmula I sea un resto R1a, significa un resto de fórmula general II, y - para el caso en que R1 en la fórmula I sea un resto R1b, tiene el mismo significado que el resto R1b en la fórmula I con un compuesto de fórmula general V **(Ver fórmula)** en la que R6 significa un halógeno del grupo Cl, Br, I, preferiblemente Br, y R7 significa un grupo alquilo C1-C6 ramificado o sin ramificar, preferiblemente un grupo isopropilo
Tipo: Resumen de patente/invención. Número de Solicitud: W06000164DE.
Solicitante: RATIOPHARM GMBH.
Nacionalidad solicitante: Alemania.
Dirección: GRAF-ARCO-STRASSE 3,89079 ULM.
Inventor/es: LI, YI, WANG,YAPING, LI,YONGGANG, LI,YULIN, ZHENG,GUOJUN.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C07C257/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 257/00 Compuestos que contienen grupos carboxilo, en que el átomo de oxígeno, unido por enlace doble, de un grupo carboxilo es sustituido por un átomo de nitrógeno unido por enlace doble, no estando este átomo de nitrógeno unido además a un átomo de oxígeno, p. ej. imino-éteres, amidinas. › que tienen átomos de carbono de grupos amidino unidos a átomos de carbono acíclicos.
- C07D233/64 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 233/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,3 o diazol-1,3 hidrogenado, no condensados con otros ciclos. › con radicales hidrocarbonados sustituidos, unidos a los átomos de carbono del ciclo, p. ej. histidina.
- C07D257/04 C07D […] › C07D 257/00 Compuestos heterocíclicos que contienen cuatro átomos de nitrógeno como únicos heteroátomos del ciclo. › Ciclos de cinco miembros.
- C07D403/10 C07D […] › C07D 403/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos por el grupo C07D 401/00. › unidos por una cadena de carbono que contiene ciclos aromáticos.
Clasificación PCT:
- C07C251/08 C07C […] › C07C 251/00 Compuestos que contienen átomos de nitrógeno, unidos por enlaces dobles a una estructura carbonada (compuestos diazo C07C 245/12). › siendo acíclica.
- C07D233/54 C07D 233/00 […] › que tienen dos enlaces dobles entre miembros cíclicos o entre miembros cíclicos y miembros no cíclicos.
- C07D257/04 C07D 257/00 […] › Ciclos de cinco miembros.
- C07D403/10 C07D 403/00 […] › unidos por una cadena de carbono que contiene ciclos aromáticos.
Fragmento de la descripción:
Procedimiento para la preparación de losartán.
La presente invención se refiere a un nuevo procedimiento para la preparación de losartán, un derivado de imidazol con el nombre químico 2-n-butil-4-cloro-5-hidroximetil-1-{[2'-(1H-tetrazol-5-il)bifenil-4-]metil}imidazol, así como a sales farmacológicamente activas del mismo. Además, la invención se refiere a nuevos productos intermedios que son adecuados para la preparación de losartán, así como a nuevos procedimientos para la preparación de compuestos intermedios que son adecuados para la preparación de losartán.
El losartán y las rutas eficientes y económicas para su preparación son de gran interés ya que el losartán ha demostrado ser un potente principio activo para combatir hipertensión en mamíferos incluidos los seres humanos y enfermedades concomitantes resultantes de la misma.
El losartán y su preparación se describieron por primera vez en el documento EP-A-253310. La síntesis comprendía como etapa esencial una N-alquilación, la reacción de un imidazol con, por ejemplo, un derivado de bromometil-bifenilo (documento EP 253310 B1, pág. 213, reivindicación 6).
En el documento EP-A-291969 se describen derivados de tetrazol protegidos con tritilo que son adecuados para la preparación de losartán.
El documento WO 03/093262 se refiere a la preparación de losartán a partir de derivados de tetrazol protegidos con tritilo mediante disociación del grupo protector.
La publicación de R.D. Larsen y col., Journal of Organic Chemistry, tomo 59, 1994, páginas 6391-6394, da a conocer un procedimiento para la preparación de losartán mediante el acoplamiento de Suzuki de los compuestos 5 y 10 (esquema 3). El documento no da a conocer ningún procedimiento para la preparación de un compuesto de fórmula I o losartán mediante cloración de un compuesto de fórmula XI.
La preparación de losartán potásico, la forma comercial habitual, a partir de losartán se ha descrito variadamente (véanse, por ejemplo, el documento EP 324377 A, página 191, ejemplo 316, parte D y el documento WO 95/17396, página 18, ejemplo 4 y página 24, ejemplo 9, etapa C).
Sin embargo, parece que las rutas de síntesis anteriormente mencionadas todavía requieren mejorar para preparar el losartán a escala industrial ya que los rendimientos totales dejan todavía que desear.
A todas las rutas de síntesis les es común que inicialmente se prepara un derivado de 1-H-imidazol que, a continuación, se alquila en la posición 1. Sin embargo, en esta reacción existe la posibilidad de que se formen dos isómeros dependiendo de cuál de los dos átomos de nitrógeno se alquila.
Por J. Org. Chem. 1997, 62(24), 8449-8454 (véase la Tabla 1) se conoce la síntesis específica de un derivado de imidazol alquilado en la posición 1 a partir de una amidina N-monosustituida. Sin embargo, no se informó de la preparación de precursores adecuados para la síntesis de losartán.
Por este motivo, era objetivo proporcionar nuevas rutas de síntesis y productos intermedios para la preparación de losartán y de sus sales farmacológicamente activas. Especialmente era objetivo de la invención proporcionar nuevas rutas de síntesis y productos intermedios para la preparación de losartán y de sus sales farmacológicamente activas con las que puede prepararse el losartán en un alto rendimiento global.
Además, era objetivo de la invención proporcionar nuevas rutas de síntesis y productos intermedios para la preparación de losartán y de sus sales farmacológicamente activas que pudieran prepararse con pequeño gasto de aparatos también a escala industrial. Además, en su mayor parte deberán usarse sustancias de uso industrial fácilmente disponibles y evitar el uso de sustancias tóxicas o que requieran un etiquetado especial.
Correspondientemente se hallaron los objetos descritos al principio.
Un aspecto central de la invención es la preparación de un compuesto de fórmula general I
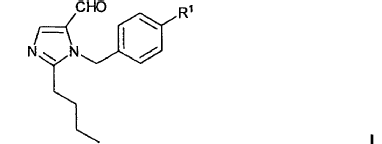
en la que R1 significa un resto R1a o resto R1b.
En el caso de R1a se trata de un resto de fórmula general II

en la que R2 significa un grupo protector de tetrazol.
En la fórmula general II, la "línea serpenteante" simboliza el punto de unión, por ejemplo, al compuesto según la fórmula general I.
Los grupos protectores de tetrazol adecuados en el resto de la fórmula general II anteriormente especificada se conocen por los documentos EP-A-291969 y WO 03/093262 (véanse allí los sustituyentes de triarilmetilo en el compuesto de fórmula general (II)). Los grupos protectores de tetrazol adecuados son especialmente trifenilmetilo o terc-butilo.
En el caso del resto R1b de fórmula general I se trata de un resto que puede unir el grupo fenileno del compuesto de fórmula general I mediante un acoplamiento C-C a otro grupo arilo.
En el caso del resto R1b de fórmula general I se trata especialmente de un resto que puede acoplar el grupo fenileno del compuesto de fórmula general I mediante reacción con un resto R3 complementario a éste que es constituyente de un compuesto de fórmula general III que contiene otra unidad de fenileno
en la que R4 significa un resto de fórmula general II,
con formación de un enlace C-C entre el grupo fenileno del compuesto de fórmula general I y el grupo fenileno del compuesto de fórmula general III. El acoplamiento C-C se realiza en este caso normalmente con disociación de los restos R1b y R3.
El compuesto de fórmula general I se prepara haciendo reaccionar un compuesto de fórmula general IV
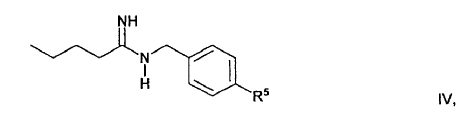
en la que R5
- - para el caso en que R1 en la fórmula I sea un resto R1a, significa un resto de fórmula general II, y
- - para el caso en que R1 en la fórmula I sea un resto R1b, tiene el mismo significado que el resto R1b en la fórmula
con un compuesto de fórmula general V

en la que R6 significa un halógeno del grupo Cl, Br, I, preferiblemente Br, y R7 significa un grupo alquilo C1-C6 ramificado o sin ramificar, preferiblemente un grupo isopropilo.
La reacción anteriormente descrita (reacción del compuesto de fórmula general IV con el compuesto de fórmula general V) se realiza preferiblemente en presencia de una base de Bronstedt, especialmente de una base de Bronstedt débil. Las bases de Bronstedt adecuadas son carbonatos alcalinos o hidrogenocarbonatos alcalinos como, por ejemplo, carbonato de sodio, carbonato de potasio o hidrogenocarbonato de sodio. Se prefiere carbonato de potasio.
Preferiblemente, la reacción se realiza en un sistema de 2 fases en el que una fase está formada por una solución acuosa y la otra fase se forma a partir de una solución que comprende un disolvente orgánico no infinitamente miscible con agua. Ejemplos de disolventes adecuados son tolueno, cloruro de metileno, cloroformo o mezclas de éstos.
La reacción de un compuesto de fórmula general IV con un compuesto de fórmula general V se realiza normalmente en una relación cuantitativa molar de 0,5 a 2 respecto a 1, referida a las cantidades molares de compuesto de fórmula general IV respecto a compuesto de fórmula general V.
En general, la duración de la reacción asciende a de 0,1 a 20 horas, preferiblemente de 5 a 15 horas.
A continuación se explica más detalladamente el resto R1b que puede estar contenido tanto en compuestos de fórmula general I como en compuestos de fórmula general IV (como resto R5):
El resto R1b del compuesto de fórmula general I o el resto R5 en el compuesto...
Reivindicaciones:
1. Procedimiento para la preparación de un compuesto de fórmula general I,
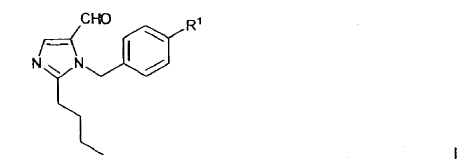
en la que R1 es un resto R1a o un resto R1b,
- siendo R1a un resto de fórmula general II

en la que R2 significa un grupo protector de tetrazol, o
- siendo R1b un resto que puede acoplar el grupo fenileno del compuesto de fórmula general I mediante reacción con un resto R3 complementario a éste que es constituyente de un compuesto de fórmula general III que contiene otra unidad de fenileno:
en la que R4 es un resto de fórmula general II,
con formación de un enlace C-C entre el grupo fenileno del compuesto de fórmula general I y el grupo fenileno del compuesto de fórmula general III,
eligiéndose R1b y R3 de manera que formen uno de los siguientes pares complementarios:
a) halógeno y un resto de fórmula general VI;

en la que R8 y R9 significan hidrógeno, un grupo alquilo C1 a C6 o conjuntamente un grupo alcanodiílo C1 a C6,
b) halógeno y un resto de trialquilestaño; y
c) halógeno y un resto de halogenuro de magnesio (II);
haciendo reaccionar un compuesto de fórmula general IV
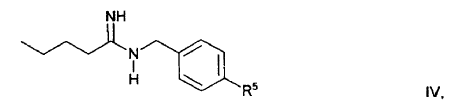
en la que R5
- - para el caso en que R1 en la fórmula I sea un resto R1a, significa un resto de fórmula general II, y
- - para el caso en que R1 en la fórmula I sea un resto R1b, tiene el mismo significado que el resto R1b en la fórmula I
con un compuesto de fórmula general V

en la que R6 significa un halógeno del grupo Cl, Br, I, preferiblemente Br, y R7 significa un grupo alquilo C1-C6 ramificado o sin ramificar, preferiblemente un grupo isopropilo.
2. Procedimiento según la reivindicación 1, en el que el grupo protector de tetrazol R2 en la fórmula II significa trifenilmetilo o terc-butilo.
3. Procedimiento según una de las reivindicaciones precedentes, en el que la reacción se realiza en presencia de una base de Bronstedt.
4. Compuesto de fórmula general IV que se define en la reivindicación 1, en la que R5 significa un resto de fórmula general II que se define en la reivindicación 1.
5. Procedimiento para la preparación del compuesto de fórmula general IV en la que R5 significa un resto de fórmula general II haciendo reaccionar un compuesto de fórmula general VII

en la que R10 significa un resto de fórmula II,
con un compuesto de fórmula general VIII
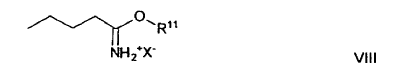
en la que R11 significa un resto alquilo C1 a C12 y X- el anión de un ácido mineral, en presencia de una base de Bronstedt.
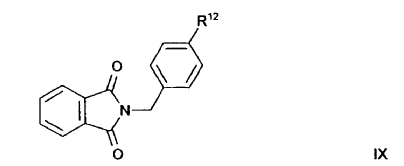
6. Procedimiento según la reivindicación 5, en el que se proporciona el compuesto de fórmula VII
7. Compuesto de fórmula general I que se define en la reivindicación 1, en el que R1 significa bromo.
8. Compuesto de fórmula general IV que se define en la reivindicación 1, en la que R5 significa halógeno, especialmente bromo.
9. Procedimiento según la reivindicación 1 ó 2, en el que el resto R1b en la fórmula I o el resto R5 en la fórmula IV significa bromo.
10. Procedimiento para la preparación de un compuesto de fórmula general IV que se define en la reivindicación 1 en la que R5 significa halógeno, en el que un derivado de bencilamina sustituido en la posición para con un átomo de halógeno se hace reaccionar con un compuesto de fórmula general VIII que se define en la reivindicación 5, en presencia de una base de Bronstedt.
11. Procedimiento según la reivindicación 10, en el que el compuesto de fórmula general IV en la que R5 significa halógeno se proporciona preparando un derivado de bencilamina sustituido en la posición para con un átomo de halógeno en una reacción de Gabriel con ftalimida a partir de un halogenuro de bencilo sustituido en la posición para con un átomo de halógeno.
12. Compuesto de fórmula general I que se define en la reivindicación 1, en la que R1 significa un resto de fórmula general VI, un resto de trialquilestaño o resto de halogenuro de magnesio (II).
13. Compuesto de fórmula general IV que se define en la reivindicación 1, en la que R5 significa un resto de fórmula general VI que se define en la reivindicación 1, un resto de trialquilestaño o resto de halogenuro de magnesio (II).
14. Procedimiento según la reivindicación 1, en el que R8 y R9 en la fórmula VI significan conjuntamente 2,3-dimetilbutano-2,3-diílo.
15. Procedimiento para la preparación de un compuesto de fórmula general IV que se define en la reivindicación 1, en la que R5 significa un resto de fórmula general VI que se define en la reivindicación 1, haciendo reaccionar un derivado de bencilamina sustituido en la posición para con un resto R5 de fórmula general VI con un compuesto de fórmula general VIII que se define en la reivindicación 5, en presencia de una base de Bronstedt.
16. Procedimiento según la reivindicación 15, en el que un compuesto de fórmula general IV en la que R5 significa un resto de fórmula general VI se proporciona preparando un derivado de bencilamina sustituido en la posición para con un resto R5 de fórmula general VI en una reacción de Gabriel con ftalimida a partir de un halogenuro de bencilo sustituido en la posición para con un resto R5 de fórmula general VI.
17. Compuesto de fórmula general XI
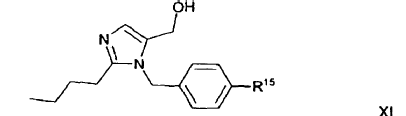
en la que R15 es un resto de fórmula general II:

en la que R2 significa un grupo protector de tetrazol.
18. Procedimiento para la preparación de losartán o una de sus sales farmacológicamente aceptables según la reivindicación 1 ó 2,
19. Procedimiento según una o varias de las reivindicaciones 1 a 3, 9, 14 y 18, en el que se usan uno o varios catalizadores que comprenden uno o varios metales de transición, preferiblemente seleccionados de MnCl2, CrCl3, FeCl2, Fe(acac)3, FeCl3, Fe(salen)Cl, NiCl2(PPh3)2, CoCl2(dppe), CoCl2(dpph), Co(acac)2, CoCl2(dppb), PdCl2(PPh3)2 o Pd(PPh3)4.
20. Procedimiento para la preparación de un derivado de imidazol que en un átomo de carbono del anillo de imidazol está sustituido con cloro (derivado de imidazol A), haciendo reaccionar un derivado de imidazol que en un átomo de carbono del anillo de imidazol lleva un átomo de hidrógeno (derivado de imidazol B) con CeCl3 y una sal alcalina de un ácido hipohaloso, preparándose un derivado de losartán en el que el átomo de hidrógeno del grupo tetrazol está sustituido con un grupo protector de tetrazol y usando como derivado de imidazol (B) el compuesto de fórmula general XI que se define en la reivindicación 17.
21. Procedimiento según la reivindicación 20, en el que el CeCl3 y la sal alcalina de un ácido hipohaloso se usan en cantidades estequiométricas o en exceso.
22. Procedimiento según una o varias de las reivindicaciones 20 ó 21, en el que como sal alcalina de ácido hipohaloso se usa una sal de potasio o sodio.
23. Procedimiento según una o varias de las reivindicaciones 20 a 22, en el que como sal alcalina de ácido hipohaloso se usa una sal alcalina de ácido hipocloroso.
24. Procedimiento según una o varias de las reivindicaciones 20 a 23, en el que la reacción se realiza en un sistema de 2 fases en el que una fase está formada por una solución acuosa y la otra fase se forma a partir de una solución que comprende un disolvente orgánico no infinitamente miscible con agua.
25. Procedimiento según la reivindicación 18, en el que en la etapa (b) el único átomo de hidrógeno que todavía queda en el grupo imidazol del compuesto preparado según la etapa (a) se sustituye con cloro haciendo reaccionar el compuesto preparado en la etapa (a) con CeCl3 y una sal alcalina de un ácido hipohaloso como reactivos.
Patentes similares o relacionadas:
Derivado de urea o sal farmacológicamente aceptable del mismo, del 8 de Abril de 2020, de KYORIN PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula general (I) o un hidrato, un solvato o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** […]
Análogos de fumarato y sus usos en el tratamiento de una enfermedad autoinmunitaria o una enfermedad inflamatoria, del 4 de Diciembre de 2019, de RIGEL PHARMACEUTICALS, INC.: Un compuesto de fórmula (A): **(Ver fórmula)** en el que: o bien: Y1 es Xa e Y2 es hidrógeno, o: Y2 es Xa e Y1 es hidrógeno; […]
Conjugados de RGD-(bacterio)clorofila para uso en el diagnóstico de tumores que comprenden dominios necróticos, del 16 de Octubre de 2019, de YEDA RESEARCH AND DEVELOPMENT COMPANY, LTD.: Un conjugado de un péptido que contiene RGD o un peptidomimético de RGD y un fotosensibilizador de clorofila o bacterioclorofila para uso en el diagnóstico de […]
Derivados de arilsulfuro y arilsulfóxido como acaricidas e insecticidas, del 2 de Octubre de 2019, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Compuestos de la fórmula (I)**Fórmula** en la que A y B junto con los átomos a los que están unidos, representan una subestructura que se selecciona del grupo que […]
Compuestos farmacéuticos, del 7 de Agosto de 2019, de Rafael Pharmaceuticals, Inc: Un compuesto seleccionado del grupo que consiste en:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Complejo de antagonista de receptor de angiotensina e inhibidor de endopeptidasa neutra, del 17 de Julio de 2019, de Chengdu Easton Biopharmaceuticals Co., Ltd: Un complejo de [3-((1S,3R)-1-bifenil-4-ilmetil-3-etoxicarbonil-1-butilcarbamoil)propionato-(S)-3'-metil-2'- (pentanoil{2"-(tetrazol-5-ilato)bifenil-4'-ilmetil}amino)butirato]…
Inhibidores de corrosión basados en tetrazol, del 10 de Julio de 2019, de Ecolab USA Inc: Una composición para inhibir la corrosión en una superficie causada por blanqueador de hipoclorito, comprendiendo la composición: un tetrazol; […]
Tetrazolonas como bioisósteros de ácido carboxílico, del 3 de Julio de 2019, de RIGEL PHARMACEUTICALS, INC.: Un compuesto seleccionado de:**Fórmula**