PROCEDIMIENTO PARA LA PREPARACION SELECTIVA DE FRAGMENTOS DE LISOBACTINA.
Procedimiento para la preparación de fragmentos de lisobactina que presenta las siguientes etapas,
concretamente
- apertura de anillo hidrogenolítica de lisobactina usando hidrógeno en presencia de un catalizador de hidrogenación en un disolvente para la formación de dihidro-lisobactina y/u octahidro-lisobactina,
- disociación enzimática de la dihidro-lisobactina y/u octahidro-lisobactina
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/011364.
Solicitante: AICURIS GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: FRIEDRICH-EBERT-STRASSE 475,42117 WUPPERTAL.
Inventor/es: FURSTNER, CHANTAL, SCHRODER, WERNER, DR., VON NUSSBAUM,FRANZ.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K7/06B
Clasificación PCT:
- C07K7/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
Fragmento de la descripción:
Procedimiento para la preparación selectiva de fragmentos de lisobactina.
La invención se refiere a procedimientos para la preparación selectiva de derivados de lisobactina mediante modificaciones químicas y enzimáticas combinadas. Especialmente, la invención se refiere a un procedimiento para la preparación del fragmento de lisobactina 4-11 mediante reducción química y disociación de los productos formados mediante quimotripsina.
La lisobactina es un depsipéptido cíclico que procede de un programa de cribado para encontrar nuevos antibióticos que intervienen en la biosíntesis de paredes celulares bacterianas (O'Sullivan J. y col. (1988) J. Antibiot. 41 (12), 1740-1744 y Bonner, D. P. y col. (1988) J. Antibiot. 41 (12), 1745-1751; Tymiak, A. A. y col. (1989) J. Org. Chem. 54, 1149-1157). Muestra una alta eficacia frente a bacterias aerobias y anaerobias Gram-positivas. Es poco común el alto número de aminoácidos no proteinógenos en la molécula. Además de los tres ß-hidroxiaminoácidos (2S,3R)-ß-hidroxi-leucina, (2S,3R)-ß-hidroxi-fenilalanina y (2S,3S)-ß-hidroxi-asparagina, también se presentan los D-aminoácidos D-leucina y D-arginina, así como alo-treonina. Esta complejidad y el tamaño de la sustancia natural lisobactina representan una gran dificultad para modificaciones químicas selectivas.
Por tanto, un objetivo de la presente invención es poner a disposición procedimientos de síntesis nuevos y alternativos para la síntesis selectiva de fragmentos de lisobactina para la preparación de nuevos antibióticos usando fragmentos de lisobactina.
Una solución la ofrece la disociación enzimática selectiva, la preparación enzimática selectiva y la posterior unión de fragmentos de lisobactina en combinación con etapas de modificación química, por ejemplo, la hidrogenación.
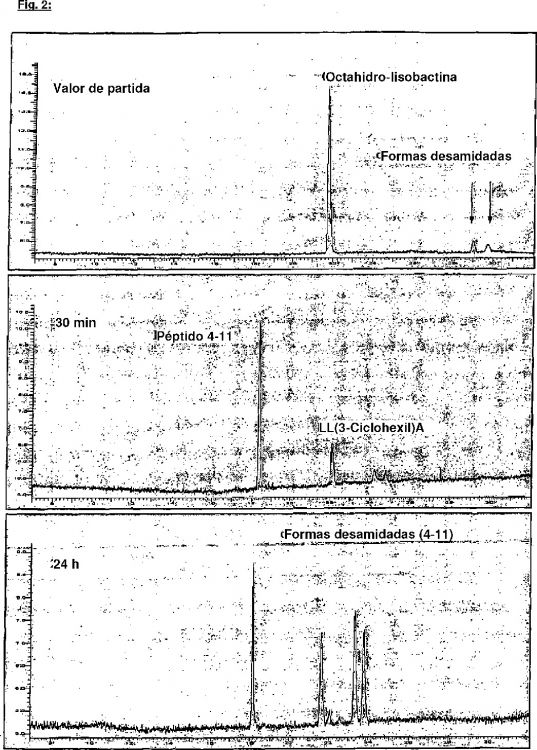
Los experimentos de digestión enzimática de lisobactina y de la forma de cadena abierta obtenida mediante hidrólisis ("lisobactina de cadena abierta"; compuesto de fórmula (I)) con enzimas como pepsina, tripsina, quimotripsina y peptidasa mucosa no mostraron ninguna digestión (como, por ejemplo, en pepsina) o sólo una digestión enzimática insuficiente (R. A. Blackburn y col. (1993) Drug Metab. Dispos. 21(4), 573-579). Una disociación enzimática ineficiente muy lenta de la lisobactina sólo se produce después de la apertura del anillo mediante hidrólisis en el tampón usado. Esto conduce como reacción secundaria no deseada a una desamidación de las cadenas laterales en (2S,3S)-ß-hidroxi-asparagina. Es decir, la unidad de ß-hidroxi-asparagina se convierte en una unidad de ß-hidroxi-aspartato.
Se encontró sorprendentemente que el fragmento de lisobactina 4-11 puede prepararse con alta eficiencia y cuantitativamente mediante disociación enzimática con quimotripsina a partir de dihidro-lisobactina (compuesto de fórmula (II)) y octahidro-lisobactina (compuesto de fórmula (III)), así como a partir de una mezcla de ambos componentes. La disociación tiene lugar tan rápidamente que los fragmentos 1-3 y 4-11 se forman prácticamente después de la mezcla de los correactantes (sustrato y enzima). No tienen lugar reacciones secundarias no deseadas en las cadenas laterales de aminoácidos.

La dihidro-lisobactina y la octahidro-lisobactina se obtienen mediante apertura hidrogenolítica de lisobactina con hidrógeno convirtiéndose la unidad de (2S,3R)-ß-hidroxi-fenilalanina en una fenilalanina o unidad de 3-ciclohexilalanina. Los fragmentos de lisobactina formados dihidro-lisobactina y octahidro-lisobactina se usan luego para la digestión enzimática.
Sorprendentemente, la dihidro-lisobactina y la octahidro-lisobactina también son buenos sustratos para otras enzimas de manera que mediante la elección de la enzima también pueden prepararse otros fragmentos con alto rendimiento.
Es objeto de la invención un procedimiento para la preparación de dihidro-lisobactina y/u octahidro-lisobactina en el que la lisobactina se convierte en dihidro-lisobactina y/u octahidro-lisobactina mediante apertura de anillo hidrogenolítica con hidrógeno en presencia de un catalizador de hidrogenación en un disolvente.
Los catalizadores de hidrogenación son, por ejemplo, catalizadores de paladio, rutenio, rodio, iridio y platino o níquel Raney. Estos catalizadores pueden usarse como sales (por ejemplo, dióxido de platino, cloruro de rodio (III)) o como catalizadores soportados (por ejemplo, paladio sobre carbón (del 5-30%) o rodio sobre carbón (del 5%)). Los materiales de soporte adecuados para catalizadores soportados son, por ejemplo, carbón activo, tierra de infusorios, gel de sílice, bentonita, caolín, piedra pómez, silicatos de aluminio u óxido de aluminio. El material de soporte preferido es carbón activo.
También pueden usarse catalizadores bimetálicos o bien catalizadores multicomponentes.
Se prefieren catalizadores de paladio, por ejemplo, paladio sobre carbón (del 5-30%), se prefiere especialmente paladio sobre carbón (del 10%).
La apertura de anillo hidrogenolítica se realiza en general en un disolvente, preferiblemente en un intervalo de temperatura de temperatura ambiente a 150ºC, preferiblemente en un intervalo de temperatura de temperatura ambiente a 80ºC, en un intervalo de presión normal de presión normal a 200 bar (20 MPa), preferiblemente en un intervalo de presión de 3 a 80 bar (0,3 a 8 MPa).
Los disolventes son, por ejemplo, alcoholes como metanol, etanol o isopropanol o mezclas de los alcoholes con agua, o ácido acético o disoluciones acuosas de ácido acético, o mezclas de THF-agua, o mezclas de dioxano-agua, o bien mezclas ternarias de los disolventes previamente mencionados, por ejemplo, isopropanol-agua-ácido acético. Se prefiere una mezcla de isopropanol-agua.
Otro objeto de la invención es un procedimiento para la preparación del fragmento de lisobactina 4-11 y el fragmento de lisobactina 1-3 en el que la dihidro-lisobactina y/o la octahidro-lisobactina se disocian enzimáticamente en el fragmento de lisobactina 4-11 y el fragmento de lisobactina 1-3.
Se prefiere una disociación enzimática de dihidro-lisobactina y/u octahidro-lisobactina usándose como enzima una serina proteasa eucariota o una serina proteasa microbiana.
Las serina proteasas eucariotas son, por ejemplo, quimotripsina, catepsina G, quimasa u otras enzimas de la familia de las quimotripsinas u otras serina proteasas eucariotas que se disocian después de aminoácidos aromáticos, se prefiere la quimotripsina.
Las serina proteasas microbianas son, por ejemplo, subtilisina, proteinasa K, proteasa A de Streptomyces u otras enzimas que se disocian después de aminoácidos aromáticos, se prefiere la subtilisina.
La invención comprende además un procedimiento para la disociación enzimática de dihidro-lisobactina y/u octahidro-lisobactina en fragmentos de lisobactina más pequeños.
Otro objeto de la invención es correspondientemente un procedimiento para la preparación del fragmento de lisobactina 3-11 y/o fragmento de lisobactina 5-11 y/o fragmento de lisobactina 4-10 y/o fragmento de lisobactina 1 -9, caracterizado porque la dihidro-lisobactina y/o la octahidro-lisobactina se disocian enzimáticamente para dar el fragmento de lisobactina 3-11 y/o el fragmento de lisobactina 5-11 y/o el fragmento de lisobactina 4-10 y/o el fragmento de lisobactina 1-9.
Se prefiere una disociación enzimática de dihidro-lisobactina y/u octahidro-lisobactina usándose como enzima una metaloproteasa o una cisteína proteasa.
Las metaloproteasas son, por ejemplo, termolisina o micolisina.
Las cisteína proteasas son, por ejemplo, papaína, bromelaína o ficina.
La disociación enzimática se realiza en general en un tampón de disociación acuoso con la adición de un alcohol C1-C4 o acetonitrilo, preferiblemente en un intervalo de temperatura de 10ºC a 40ºC, preferiblemente en un intervalo de pH de 6 a 9 a presión normal.
Un tampón de disociación acuoso contiene, por ejemplo, hidrogenocarbonato de amonio y urea, o fosfato de sodio, cisteína y EDTA, o tetraborato de sodio, u otros aditivos con los que se cubre un intervalo de tamponamiento de pH 6 a 9, se prefiere el hidrogenocarbonato de amonio y la urea.
El alcohol C1-C4 es, por ejemplo, metanol, etanol o isopropanol, se prefiere el metanol.
La...
Reivindicaciones:
1. Procedimiento para la preparación de fragmentos de lisobactina que presenta las siguientes etapas, concretamente
2. Procedimiento según la reivindicación 1, en el que como enzima se usa serina proteasa eucariota o una serina proteasa microbiana.
3. Procedimiento según la reivindicación 1, en el que como enzima se usa una metaloproteasa o una cisteína proteasa.
4. Procedimiento para la preparación de derivados de lisobactina que presenta las siguientes etapas, concretamente
5. Procedimiento para la preparación de dihidro-lisobactina y/u octahidro-lisobactina, caracterizado porque la lisobactina se convierte en dihidro-lisobactina y/u octahidro-lisobactina mediante apertura de anillo hidrogenolítica con hidrógeno en presencia de un catalizador de hidrogenación en un disolvente.
6. Procedimiento según la reivindicación 5, en el que como catalizador de hidrogenación se usa un catalizador de paladio.
7. Procedimiento según la reivindicación 5 ó 6, en el que como disolvente se usa una mezcla de isopropanol-agua.
8. Procedimiento para la preparación del fragmento de lisobactina 4-11 y el fragmento de lisobactina 1-3, caracterizado porque la dihidro-lisobactina y/u octahidro-lisobactina se disocia enzimáticamente para dar el fragmento de lisobactina 4-11 y el fragmento de lisobactina 1-3.
9. Procedimiento según la reivindicación 8, en el que como enzima se usa una serina proteasa eucariota o una serina proteasa microbiana.
10. Procedimiento según la reivindicación 8 ó 9, en el que como serina proteasa se usa quimotripsina.
11. Procedimiento para la preparación del fragmento de lisobactina 3-11 y/o el fragmento de lisobactina 5-11 y/o el fragmento de lisobactina 4-10 y/o el fragmento de lisobactina 1-9, caracterizado porque la dihidro-lisobactina y/u octahidro-lisobactina se disocian enzimáticamente para dar el fragmento de lisobactina 3-11 y/o el fragmento de lisobactina 5-11 y/o el fragmento de lisobactina 4-10 y/o el fragmento de lisobactina 1-9.
12. Procedimiento según la reivindicación 11, en el que como enzima se usa una metaloproteasa o una cisteína proteasa.
Patentes similares o relacionadas:
OLIGOPÉPTIDOS NO PROTEOLIZABLES INHIBIDORES DE LA GLICOPROTEINA GP41 DEL VIH, del 21 de Octubre de 2011, de UNIVERSIDAD DEL PAIS VASCO UNIVERSIDAD DE VALENCIA: Oligopéptidos no proteolizables inhibidores de la glicoproteína 41 del virus del SIDA. La presente invención se refiere a la identificación de oligopéptidos, […]
PEPTIDOS LINEALES ANTIMICROBIANOS CON AMINOACIDOS DE LA SERIE D, del 7 de Junio de 2011, de UNIVERSITAT DE GIRONA: Péptidos lineales antimicrobianos con aminoácidos de la serie D.La presente invención se refiere a nuevos péptidos lineales que presentan actividad […]
PURIFICACIÓN DE PÉPTIDOS, del 27 de Enero de 2011, de POLYPEPTIDE LABORATORIES A/S RASMUSSEN, JON H. RASMUSSEN, PALLE H: Un procedimiento de purificación de un nona- o deca-péptido por lo demás puro de disolvente orgánico residual, que comprende las siguientes etapas: […]
MODULADORES DEL PEPTIDO 1 SIMILAR AL GLUCAGON HUMANO Y SU USO EN EL TRATAMIENTO DE DIABETES Y AFECCIONES RELACIONADAS, del 31 de Mayo de 2010, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido aislado que comprende un polipéptido que tiene una secuencia de Fórmula I:
PROCEDIMIENTO PARA PREPARAR DERIVADOS DE LISOBACTINA, del 30 de Abril de 2010, de AICURIS GMBH & CO. KG: Procedimiento para preparar depsipéptidos cíclicos de la siguiente fórmula
NONADEPSIPEPTIDOS SUSTITUIDOS, del 29 de Abril de 2010, de AICURIS GMBH & CO. KG: Compuesto de la fórmula
PEPTIDOS LIBERADORES DE HORMONA DEL CRECIMIENTO, del 8 de Marzo de 2010, de IPSEN PHARMA: Un compuesto de acuerdo con la fórmula (I): (I)R1-A1-A2-A3-A4-A5-R2 o una sal del mismo farmacéuticamente aceptable, en la que: A1 es Aib, Ape o Inp; A2 […]
Péptido basado en colágeno tipo II alfa-1 útil para el tratamiento de una enfermedad de la superficie ocular, del 15 de Julio de 2020, de EYEBIO KOREA: Un péptido que consiste en una secuencia de aminoácidos representada por SEQ ID NO: 1.