PROCEDIMIENTO PARA LA PREPARACION DE MATERIAL VIRICO.
Procedimiento para la preparación de material vírico en un cultivo celular con microsoportes,
que comprende
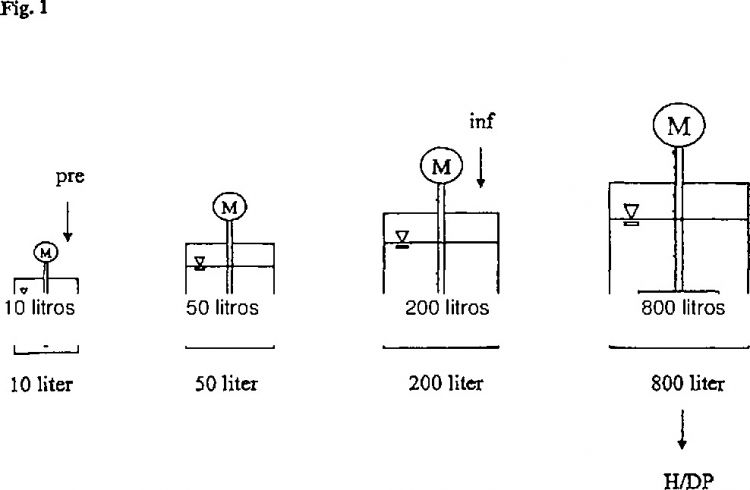
(a) una primera fase de cultivo que comprende un aumento del volumen del cultivo celular mediante la adición de medio de cultivo y material de microsoporte, alcanzándose un primer volumen de cultivo celular máximo;
(b) una etapa de infección que tiene lugar después de la mencionada primera fase de cultivo y que comprende la adición de material vírico infeccioso al mencionado cultivo celular con microsoportes;
(c) una segunda fase de cultivo que tiene lugar después de la mencionada etapa de infección y que comprende un aumento adicional del volumen del cultivo celular hasta un segundo volumen de cultivo celular máximo, generándose material vírico durante la segunda fase de cultivo; y
(d) una etapa de recolección para obtener el material vírico a partir del cultivo celular con microsoportes,
caracterizado porque
el mencionado segundo volumen de cultivo máximo es de dos a siete veces mayor que el mencionado primer volumen de cultivo máximo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/010810.
Solicitante: AICURIS GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: FRIEDRICH-EBERT-STRASSE 475,42117 WUPPERTAL.
Inventor/es: APELER, HEINER, HENZLER, HANS-JURGEN, DR., LANGER, UWE, DR., MINUTH,TORSTEN, POHLSCHEIDT,MICHAEL, BODEKER,BERTHOLD, BRABENDER,KATRIN, OTTO-BRABENDER,DIRK, KERPER,JOACHIM.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Abril de 2010.
Clasificación Internacional de Patentes:
- C12N7/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Aislamiento o purificación.
Clasificación PCT:
- C12N7/02 C12N 7/00 […] › Aislamiento o purificación.
Fragmento de la descripción:
Procedimiento para la preparación de material vírico.
El campo técnico
La invención se refiere a un procedimiento para la preparación de suspensiones de virus. La invención se refiere en particular a un procedimiento para la preparación de suspensiones de virus de titulación elevada en cultivos celulares. Los procedimientos preferidos comprenden un aumento de volumen del cultivo celular antes de la infección con material vírico y otras etapas o aumentos de volumen sucesivos, hasta llegar a un volumen final que es claramente superior al volumen máximo del cultivo antes de la infección.
Estado actual de la técnica
En el estado actual de la técnica se conocen varios procedimientos para la preparación de material vírico. En particular, se conocen procedimientos en los que el material vírico se prepara a partir de cultivos celulares animales.
El experto diferencia entre las líneas celulares de crecimiento adherente, es decir, las líneas celulares que crecen con preferencia sobre superficies sólidas, de las líneas celulares que crecen preferentemente en suspensión. Las líneas celulares de crecimiento adherente se cultivan o bien directamente sobre la superficie del recipiente de cultivo usado o crecen sobre partículas sólidas (por ej. sobre microsoportes (microcarriers)), que por su parte pueden estar presentes en suspensión en un medio de cultivo.
Se conocen procedimientos para la preparación de material vírico que usan líneas celulares que crecen en suspensión, así como también aquellos procedimientos que usan líneas celulares de crecimiento adherente.
En la preparación de suspensiones de virus con cultivos celulares tiene una gran importancia la composición del medio. En muchos casos es necesario añadir suero fetal de ternera (FCS) y factores de crecimiento de origen animal o vegetal. Además de las oscilaciones de las cargas y de los componentes proteínicos perturbadores en el procesamiento, el uso de suero significa un riesgo de seguridad biológico (BSE/TSE, micoplasmas, priones, etc.). Por lo tanto, ha de darse preferencia a los medios libres de suero y a ser posible sintéticos [MERTEN ET AL. 1994].
En particular al usar células adherentes, como por ej. en el caso de los cultivos sobre microsoportes, además de las típicas barreras técnicas del aumento de escala, como por ej, el mantenimiento de un suministro suficiente de oxígeno, la eliminación del CO2 o una homogeneización suficiente del cultivo de fermentos con un esfuerzo de cizallamiento mínimo, surgen también y de manera especial problemas en la inoculación de la siguiente escala del proceso de mayor dimensión [GLACKEN ET AL. 1990, J.B. GRIFFITHS ET AL. 1985, AMERSHAM 2001].
La "migración directa" de un soporte a otro de células de crecimiento adherente puro sólo puede producirse mediante una manipulación del proceso, de suerte que debido a la manipulación las células pierden su adherencia al menos en parte. El experto conoce estrategias para eliminar la adherencia de células de crecimiento adherente y las enzimas que se usan para ello [E. LINDNER ET AL. 1987, AMERSHAM 2001, DÜRRSCHMID ET AL. 2003] y deben tenerse en cuenta en el desarrollo del proceso en lo que respecta a la separación o la inactivación de las enzimas usadas. A una escala menor, en las décadas de 1970 y 1980 se llevaron a cabo con éxito experimentos para la migración celular directa desde la superficie de recipientes a microsoportes en botellas de cultivo rotatorias, placas Petri y frascos T. El experto conoce la migración con éxito de células de crecimiento adherente de un soporte a otro únicamente en reactores de lecho fijo siendo necesario reseñar, limitándolo, que en este caso se trata de líneas celulares que crecen tanto en suspensión como también de modo adherente [AMERSHAM 2001, DÜRRSCHMID ET AL. 2003].
El modo en que se lleva a cabo el proceso, en especial, desempeña un gran papel. En la literatura se describen diferentes procedimientos tales como, por ejemplo, los cultivos por lotes o por perfusión. Los cultivos por perfusión se usan para desacoplar el tiempo de permanencia de la tasa de crecimiento específica y para evitar los inhibidores o limitadores del medio de cultivo y aumentar de este modo la productividad, manteniéndose estos cultivos a menudo a lo largo de varios meses en el modo de "cultivo celular de alta densidad" ("High Density Cell Culture" (HDCC)). Sin embargo, estos sistemas requieren períodos de arranque complejos y lentos además de complicados dispositivos periféricos (separadores, filtros spin, retención celular con ultrasonidos, etc.) [M. REITER ET AL. 1989, GLACKEN ET AL. 1990, GRIFFITHS ET AL. 1985, AMERSHAM 2001, DÜRRSCHMID ET. AL. 2003A].
Una posibilidad adicional para conseguir un suministro suficiente de nutrientes lo constituye el aporte al cultivo celular de soluciones de sustrato muy concentradas. En particular con la modalidad HDCC, las inhibiciones resultantes del aporte, como por ejemplo amonio y/o lactato, pueden dar lugar a productividades y rendimientos más bajos. Hasta la fecha, para evitar las concentraciones inhibidoras se recomiendan los sistemas de perfusión o de diálisis.
En el campo de la preparación de material vírico por medio de cultivos celulares animales, en la que deben tenerse en cuenta las complejas cinéticas acopladas de las células y del virus, pueden surgir problemas en la realización del proceso en especial cuando se usan cultivos celulares sobre microsoportes.
Así por ejemplo, resulta cuestionable el aprovechamiento mediante perfusión compleja de la propagación de un virus causante de un CPE (efecto citopático) ya que los virus destruyen o lisan las células por lo general en un plazo breve (en parte inferior a los 3 a 7 días siguientes a la infección).
En la literatura se describen procesos por lotes para la multiplicación de virus a escala piloto y de producción (50 a 1.000:1). En todos los procesos de microsoporte descritos, la multiplicación de los virus se lleva a cabo con densidades celulares relativamente pequeñas. Después de la infección con el virus que hay que propagar, hasta la recolección la infección transcurre aproximadamente al volumen final tardío de la escala de producción [B. MONTAGNON ET AL. 1984, BAIJOT ET AL. 1987]. En algunos casos se han descrito cultivos por perfusión para virus lentos o no lisantes a escala de laboratorio. En un caso se describe un cambio del medio hasta el volumen original. [AMEMHAM 2001].
Los documentos US 6,455,298-B1 y US 6,656,720-B2 describen un procedimiento para la preparación de material vírico de la influenza con líneas celulares creciendo en suspensión. El procedimiento dado a conocer comprende una primera fase de cultivo en la que el material celular se multiplica en un cultivo en suspensión, una etapa de infección y a continuación una segunda fase de cultivo en la que se produce el virus. Durante esta fase se puede diluir más el cultivo añadiendo medio o bien llevándolo a cabo del mismo modo que un cultivo por perfusión. Lo ventajoso de este procedimiento es el hecho de que la capacidad del procedimiento no se ve circunscrita por la extensión limitada de la superficie interior de los recipientes de cultivo.
Sin embargo, resulta desventajoso que en el cultivo en suspensión no pueden alcanzarse densidades celulares tan altas como las que son posibles con los procedimientos basados en microsoportes para la producción de virus. Además, la separación del material celular del medio de cultivo en los cultivos en suspensión es mucho más laboriosa que en el caso de los procedimientos basados en microsoportes. En el procedimiento conforme a la presente invención se soslayan estas desventajas, puesto que aquí se usan líneas celulares de crecimiento adherente sobre microsoportes para la preparación del material vírico.
Los documentos US 6,726,907 y WO 95/24468 describen procedimientos para la preparación de material vírico que comprenden una primera fase de cultivo para la multiplicación del material celular, una etapa de infección y a continuación una segunda fase de cultivo en la que se produce el material vírico. A diferencia del procedimiento conforme a la invención, en la segunda etapa de cultivo no se lleva a cabo ningún aporte de medio de cultivo, de tal manera que el volumen del cultivo no aumenta más durante la segunda etapa de cultivo. El resultado es un volumen de recolección relativamente bajo, presentando además el cultivo una titulación de virus más pequeña en comparación...
Reivindicaciones:
1. Procedimiento para la preparación de material vírico en un cultivo celular con microsoportes, que comprende
caracterizado porque
el mencionado segundo volumen de cultivo máximo es de dos a siete veces mayor que el mencionado primer volumen de cultivo máximo.
2. Procedimiento conforme a la reivindicación 1, siendo el mencionado segundo volumen de cultivo máximo de tres a cuatro veces mayor que el mencionado primer volumen de cultivo máximo.
3. Procedimiento conforme a una de las reivindicaciones 1 o 2 en el que el mencionado aumento del volumen del cultivo celular se consigue mediante la adición de medio de cultivo no concentrado.
4. Procedimiento conforme a una de las reivindicaciones 1 a 3 en el que se usa un medio de cultivo libre de suero.
5. Procedimiento conforme a una de las reivindicaciones 1 a 4 en el que en la etapa de infección se usa una multiplicidad de infección (MI) de 0,001 a 2.
Patentes similares o relacionadas:
Virus recombinantes de la influenza de alto título con replicación mejorada en células Vero, del 29 de Julio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Una célula Vero infectada con un virus de la influenza recombinante aislado reordenado que comprende un segmento del gen HA que codifica […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ26 (KCCM11464P) que tiene una capacidad específica para matar Salmonella. Una composición que comprende el bacteriófago ΦCJ26 (KCCM11464P) según […]
Nuevo bacteriófago y composición que comprende al mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ24 (KCCM11462P) que tiene una capacidad específica para eliminar la Escherichia coli patogénica aviar.
Procedimiento para purificar partículas similares a virus (VLP), del 6 de Noviembre de 2019, de Life Science Inkubator Betriebs GmbH & Co. KG: Procedimiento para la purificación de partículas similares a virus (VLP), caracterizado porque se filtra una composición que contiene VLP por un medio filtrante con […]
Purificación del virus del herpes, del 23 de Octubre de 2019, de Sanofi Pasteur Biologics, LLC: Una composición que comprende partículas purificadas del virus del herpes simple (VHS) en un tampón de estabilización líquido, en donde el tampón de estabilización […]
Método para la producción y purificación a gran escala de parvovirus, del 23 de Octubre de 2019, de DEUTSCHES KREBSFORSCHUNGSZENTRUM: Un método para producir partículas de parvovirus vacías inactivas o completas activas, comprendiendo dicho método: (a) proporcionar la estirpe […]