INHIBIDORES PROTEINA QUINASA.
Un compuesto que tiene una estructura seleccionados de (II) o (III):
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/033870.
Solicitante: THE ARIZONA BOARD OF REGENTS ON BEHALF OF THE UNIVERSITY OF ARIZONA
SUPERGEN, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: P.O. BOX 210158,TUCSON AZ 85721-0158.
Inventor/es: VON HOFF, DANIEL, D., HURLEY,LAURENCE H, MAHADEVAN,DARUKA, HAN,HAIYONG, BEARSS,DAVID J, VANKAYALAPATI,HARIPRASAD, BASHYAM,SRIDEVI, MUNOZ,RUBEN M, WARNER,STEVEN L, DELLA CROCE,KIMIKO, GRAND,CORY L.
Fecha de Publicación: .
Fecha Concesión Europea: 29 de Julio de 2009.
Clasificación Internacional de Patentes:
- C07D239/94 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Atomos de nitrógeno.
- C07D405/12 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
- C07D405/14 C07D 405/00 […] › que contienen tres o más heterociclos.
- C07D487/04 C07D […] › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
- C07D491/04 C07D […] › C07D 491/00 Compuestos heterocíclicos que contienen en el sistema cíclico condensado, a la vez uno o más ciclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo, y uno o más ciclos que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos en los grupos C07D 451/00 - C07D 459/00, C07D 463/00, C07D 477/00 ó C07D 489/00. › Sistemas orto-condensados.
- C07D495/04 C07D […] › C07D 495/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tiene átomos de azufre como únicos heteroátomos del ciclo. › Sistemas orto-condensados.
Clasificación PCT:
- C07D239/94 C07D 239/00 […] › Atomos de nitrógeno.
- C07D405/12 C07D 405/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
- C07D405/14 C07D 405/00 […] › que contienen tres o más heterociclos.
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
- C07D491/04 C07D 491/00 […] › Sistemas orto-condensados.
- C07D495/04 C07D 495/00 […] › Sistemas orto-condensados.
Clasificación antigua:
- C07D239/94 C07D 239/00 […] › Atomos de nitrógeno.
- C07D405/12 C07D 405/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
- C07D405/14 C07D 405/00 […] › que contienen tres o más heterociclos.
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
- C07D491/04 C07D 491/00 […] › Sistemas orto-condensados.
- C07D495/04 C07D 495/00 […] › Sistemas orto-condensados.
Fragmento de la descripción:
Inhibidores proteína quinasa.
Antecedentes de la invención
La presente invención se refiere, en general, a componentes que inhiben la actividad de la proteína quinasa, y a composiciones y métodos correspondientes.
El cáncer (y otras enfermedades hiperproliferativas) se caracteriza por proliferación celular no controlada. Esta pérdida normal de control de proliferación celular a menudo parece ocurrir como el resultado del daño genético a senderos de la célula que controlan el progreso a través del ciclo celular. El ciclo celular consiste de la síntesis del ADN (fase S), división celular o mitosis (fase M), y periodos no sintéticos referidos como brechas 1 (G1) y brecha 2(G2). La fase M esta compuesta de mitosis y citocinesis (separación en dos células). Todos los pasos en el ciclo celular son controlados por una cascada ordenada de la fosforilación de la proteína y varias familias de la proteína quinasa están involucradas en llevar estos pasos de fosforilación. En adición, la actividad de muchas proteínas quinasas se eleva en tumores humanos comparados a tejidos normales y esta actividad de crecimiento puede ser debido a muchos factores, incluyendo los elevados niveles de una quinasa o cambios en la expresión de proteínas coactivadoras o inhibidoras.
Las células tienen proteínas que gobiernan la transición de una fase del ciclo celular a otra. Por ejemplo, las ciclinas son una familia de proteínas de las cuales su concentración aumenta y disminuye por todo el ciclo celular. Las ciclinas se encienden, en el tiempo apropiado, diferentes proteínas quinasas ciclina dependiente (QCD) que fosforilan sustratos esenciales por progresión a través del ciclo celular. La actividad del específico QCD en momentos específicos es esencial para ambas iniciaciones y un progreso coordinado a través del ciclo celular. Por ejemplo, QCD1 es el regulador del ciclo celular más prominente que instrumenta las actividades de la fase M. sin embargo, un numero de de otras proteínas quinasas mitóticas que participan en la fase M han sido identificadas, el cual incluye miembros del polo, aurora, y NEMA (Nunca-En-Mitosis-A) familias y quinasas implicadas en controles mitóticas, salida mitótica y citocinesis.
Las quinasas Aurora son una familia de las quinasas oncogeno serina/treonina que se encuentran en el aparato mitótico (centrosoma, polos del huso bipolar, o medio cuerpo) y regula la realización de la separación del centrosoma, formación del huso bipolar y segregación cromosomita. Tres homólogos humanos de las quinasas Aurora han sido identificados (aurora-1, aurora-2 y aurora-3). Todos comparten un elevado dominio catalítico conservado situado en el extremo carboxilo, pero sus extensiones amino terminales son de una longitud variable sin similitud de secuencia. Las quinasas humanas aurora son expresadas en células proliferadas y son también sobre expresadas en líneas celulares de numerosos tumores incluidos el cáncer de mama, ovario, próstata, páncreas y colon. La quinasa Aurora-2 actúa como un oncogén y transforma ambas células rata1 fibroblástico y ratón NIH3T3 in Vitro, y aurora-2 transforma células de crecimiento NIH 3T3 como tumores en ratones desnudos. El exceso de aurora-2 puede conducir a las células a aneuploidia (un numero anormal de cromosomas) acelerando la perdida de genes supresores de tumores y/o amplificando oncogenes, evento conocido a la contribución de la transformación celular. Células con exceso de aurora-2 pueden escapar del control mitótico, que a su vez puede activar proto-oncogenes inapropiadamente. La regulación de Aurora-2 ha sido demostrada en una serie de líneas celulares de cáncer de páncreas. Adicionalmente, el tratamiento aurora-2 quinasa de oligonucleotidos antisentido ha sido mostrado para causar la detención del ciclo celular y el aumento de la apoptosis. Por tanto, la aurora-2 quinasa es un objetivo atractivo para un diseño racional de la pequeña molécula novel inhibidora para el tratamiento del cáncer y otras condiciones.
El kit-C es una transmembrana receptora perteneciente al subgrupo de tipo 3 de tirosina quinasas receptoras que también incluye receptor de derivado de las plaquetas del factor de crecimiento (RDPFC), receptor del factor 1 estimulante de colonias (F-1EC), y FMS como quinasa tirosina (Flt-3). Tumores del estroma gastrointestinal (TEGI), los cuales son los tumores mesenquimales más comunes del tracto gastrointestinal, ha sido demostrado que con frecuencia sobre expresan el kit-C. TEGIs se cree que se originan en las células intersticiales de Cajal (ClCs) que juegan un rol en el control de la motilidad intestinal. ClCs expresa el kit-c proto oncogén. Cuando el kit-c se une a su ligando factor de célula madre (FCM) y dimeriza con otro receptor kit-c, trans-autofosforilación en tirosinas y se activa un número de vías de señalización posteriores que conduzcan a una respuesta proliferativa. Se cree que estos eventos contribuyen a la inducción de TEGI.
Otros TEGIs están asociados con actividad excesiva del receptor A del derivado de las plaquetas del factor de crecimiento (R-ADPFC), el cual es considerado un jugador clave en la formación del nuevo vaso sanguíneo necesaria para tumores que crecen mas allá de mas de unos milímetros. R-ADPFC es encontrado en estroma y pericitos (células de apoyo para vasos sanguíneos). Los niveles R-ADPFC fueron encontrados para ser aumentado en un número de otros tipos de tumores.
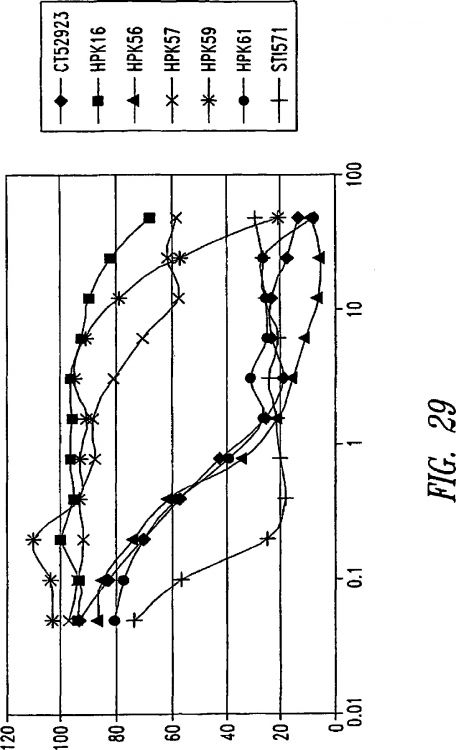
Los investigadores han estudiado los métodos de tratamiento del cáncer que inhibe la tirosina quinasas y otras proteínas implicadas en la transducción de señales no controladas. Por ejemplo, los inhibidores de transducción de señales STI571, SU5614, CT52923 (aquí HPK15) y PD1739 son conocidos por inhibir la actividad de tirosina quinasas Bcr-Abl, kit-c y RDPFC. STI571 (Gleevec; fenilaminopirimidina) es una pequeña molécula inhibidora actualmente usado en la clínica, que bloquea selectivamente el dímero tiroxina quinaza BCR-ABL en leucemia mieloide crónica. Sin embargo, Gleevec también ha sido mostrado para inhibir el kit-c y la tirosina quinasas RDPFC y por tanto puede también ser útil en tumores que sobre expresan estos receptores. Estudios recientes en pacientes con Regis metastático tratados con STI571 han mostrado disminución en el tamaño del tumor en tomografía computarizada y MRI y la respuesta metabólica medida con 19-fluoro-desoxiglucosa tomografía de emisión de positrones (FDG-PET). Sin embargo, Sin embargo, dos ensayos de fase I con STI571 a dosis de 400 mg o 600 mg al día mostró una respuesta parcial en el 54%, enfermedad estable en 34% y progresión de la enfermedad en el 12% de los pacientes evaluados en 1-3 meses. Estas pruebas iniciales indican que aunque una buena parte de respuesta fue inicialmente obtenida, una respuesta completa era muy rara, y pacientes eventualmente desarrollaron enfermedad progresiva. Estudios recientes mostraron que un determinado mutante (V560G) de kit-c es mas sensible a STI571, y un mutante en el dominio kit-c quinasa (D816V) fue resistente. Por lo tanto, el diseño y desarrollo de nuevos inhibidores de mutantes kit-c y/o de RDPFC son necesarios para el tratamiento de TEGI y otras condiciones asociadas con exceso de kit-c y/o actividad RDPFC.
Derivados de quinazolina se han propuesto para la inhibición de la actividad de la proteína quinasa. Por ejemplo, WO 96/09294, WO 96/33981 y EP 0837 063 describe el uso de ciertos componentes de quinazolina como receptores inhibidores tirosina quinasa. En adición, WO 01/21596 propone el uso de derivados de quinazolina para inhibir la quinasa aurora-2.
Lo que sigue siendo necesario, sin embargo, son adicionales y improvistos inhibidores de la actividad de proteínas quinasa, particularmente inhibidores de quinasa aurora-2, kit-c y/o actividad quinasa R-ADPFC. La presente invención rellena estas necesidades y ofrece otras ventajas relacionadas.
Breve resumen de la invención
La invención provee un componente según cualquiera de las reivindicaciones del 1 al 15, una composición según la reivindicación 16, y un uso o componente para el uso según en cualquiera de las reivindicaciones del 17 al 20.
Los componentes revelados en este documento tiene la siguiente estructura (I):
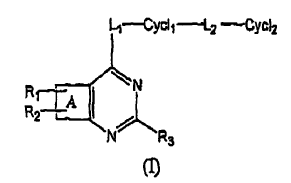
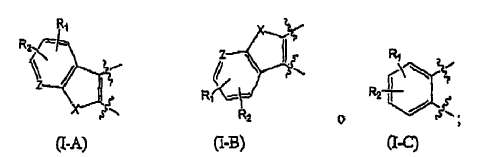
incluyendo esteroisómeros, profármacos y sus sales farmacéuticamente aceptables, en donde A es una fracción de anillo seleccionado de:
Reivindicaciones:
1. Un compuesto que tiene una estructura seleccionados de (II) o (III):
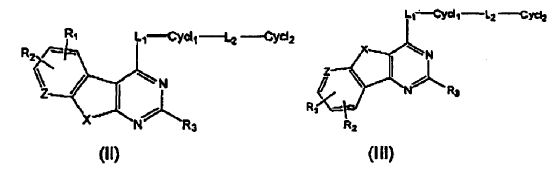
o un esteroisomero o de sus sales farmacéuticamente aceptables,
donde
X es NH, S o O;
Z es CH o N;
R1 y R2 son iguales o diferentes y son independientemente hidrógeno, hidroxilo Halo, -CN, -NO2, -NH2, -R, -OR, -SCH3, -CF3, -C(=O)OR o -OC(=O)R, donde R es C1-6 alquilo; R3 es hidrógeno o -NH2;
L1 es un enlace directo;
Cycl1 es:
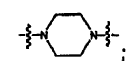
L2 es -C(=S)NH- o -C(=S)NH(CH2)-; y
Cycl2 es seleccionado de:
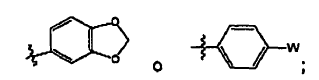
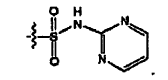
donde W es
2. El compuesto de la reivindicación 1, donde el compuesto tiene la estructura (II).
3. El compuesto de la reivindicación 2 donde X es NH y Z es CH.
4. El compuesto de la reivindicación 3 donde R1 y R2 son seleccionados de -OCH3, -OH, -Cl, -CF3OR-OC(=O)CH3.
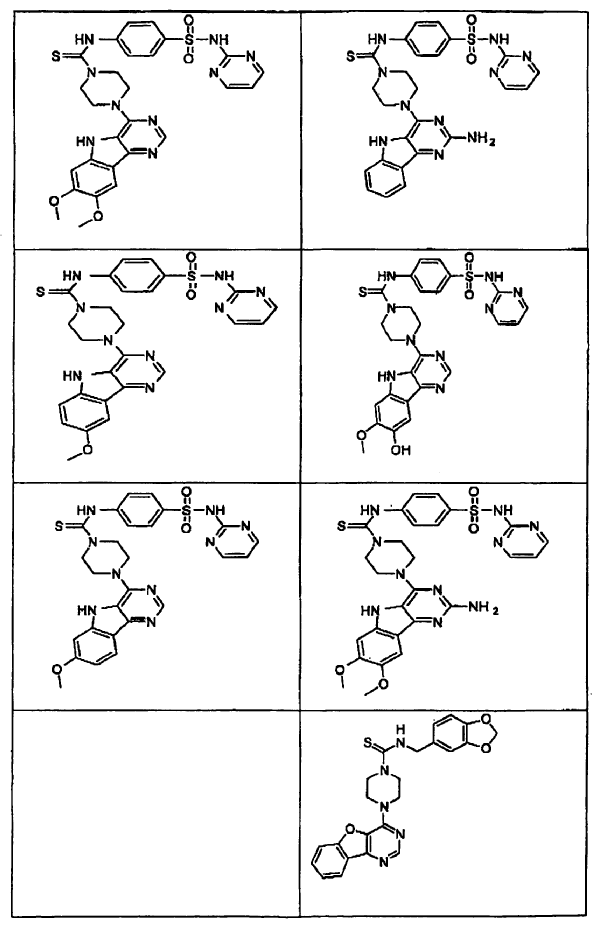
5. Un compuesto que tiene una estructura seleccionada de:
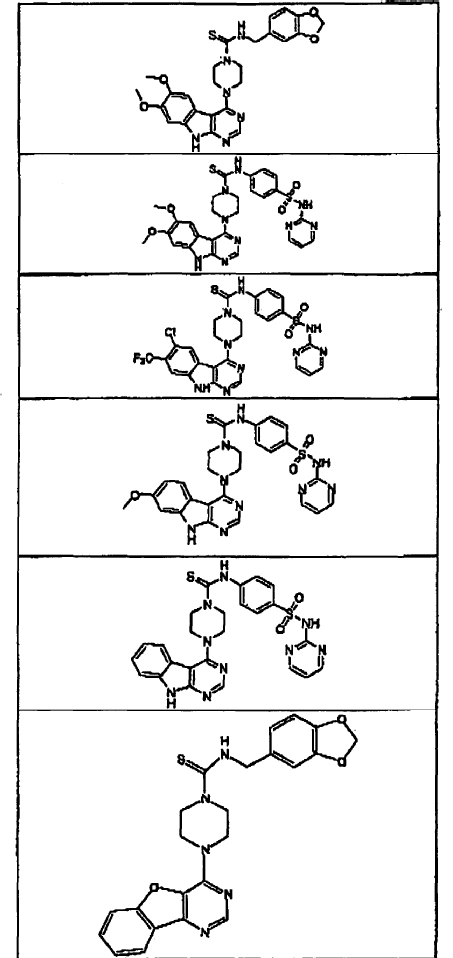
6. El compuesto de la reivindicación 5 que tiene la siguiente estructura (II-2-7):
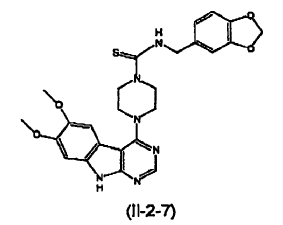
7. El compuesto de la reivindicación 1, donde el compuesto tiene la estructura (III).
8. El compuesto de la reivindicación 7 donde R1 y R2 son seleccionados de hidrógeno, -OH o -OCH3.
9. El compuesto de la reivindicación 7 o 8, donde Z es N y X es S.
10. El compuesto de la reivindicación 7 o 8 donde Z es CH y X es O.
11. El compuesto de la reivindicación 5 o 7 que tiene la siguiente estructura (III-1-3):

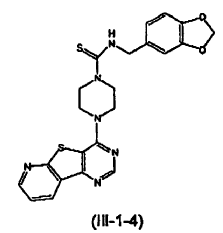
12. El compuesto de la reivindicación 7 que tiene la siguiente estructura (III-1-4):
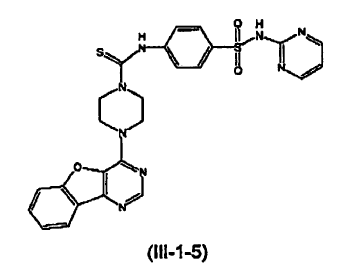
13. El compuesto de la reivindicación 7 que tiene la siguiente estructura (III-1-5):
14. Un compuesto que tiene una estructura seleccionada de:
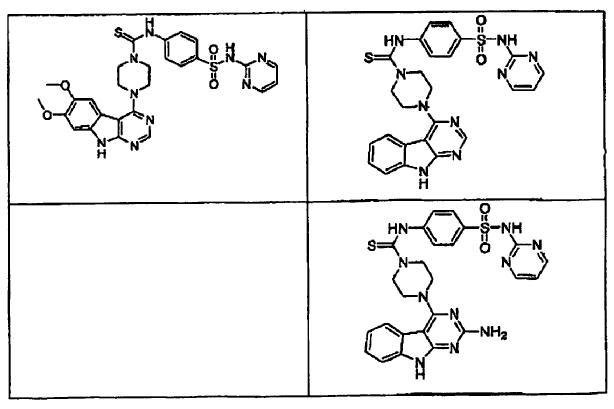

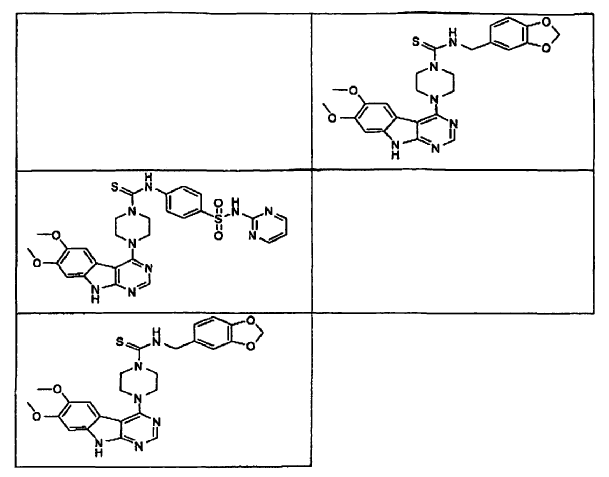
15. Un compuesto que tiene una estructura seleccionada de:
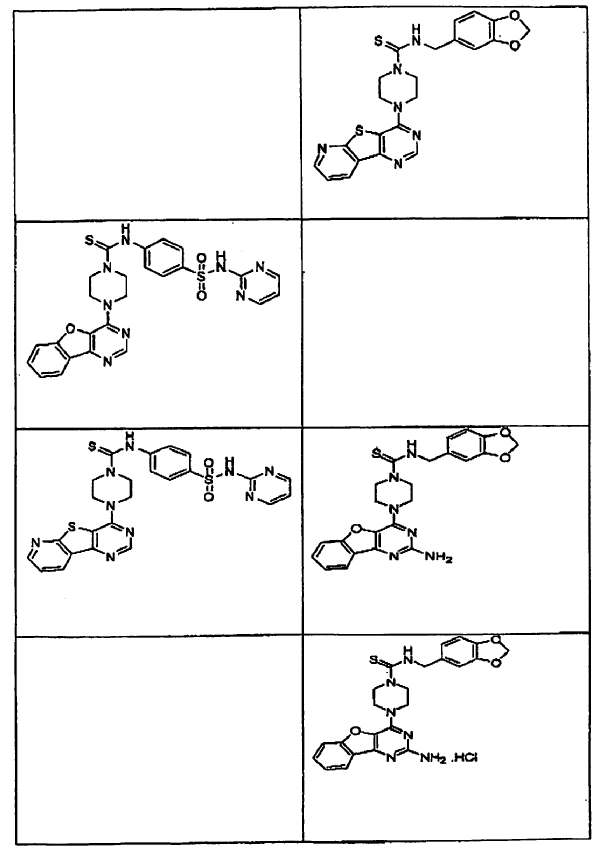
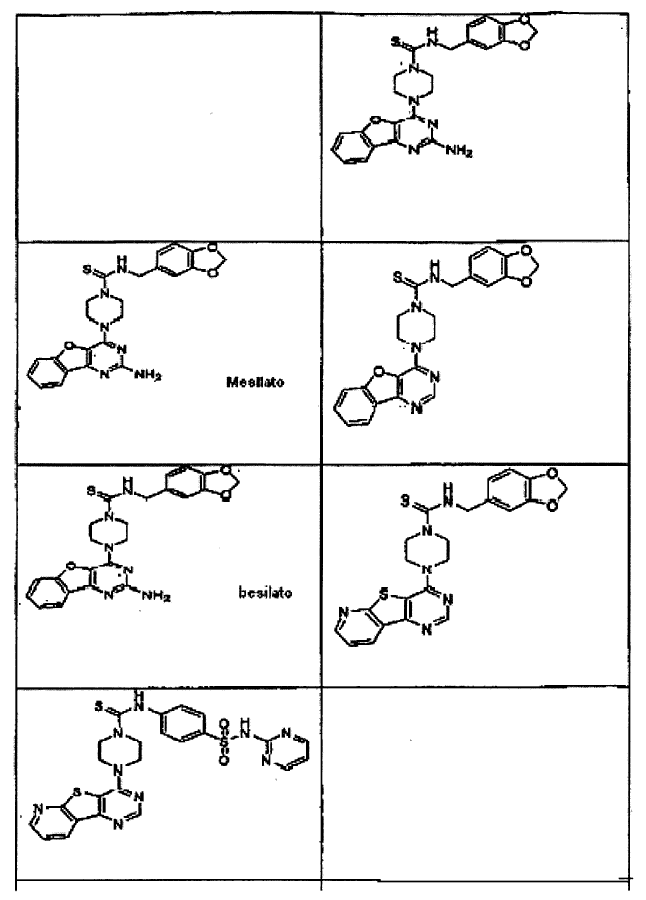
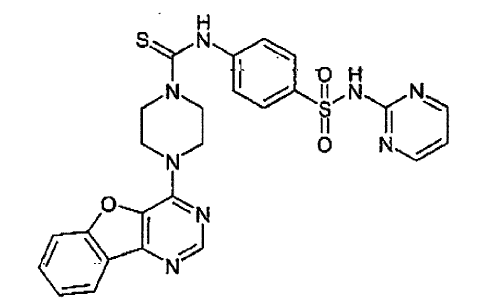
16. Una composición farmacéutica comprendiendo un compuesto como se afirma en cualquiera de las reivindicaciones de 1 a 15 en combinación con un excipiente farmacéuticamente aceptable.
17. Una composición farmacéutica de la reivindicación 16, donde la composición esta formulada para la administración oral en forma de tableta, píldora, pastilla, gragea, capsula, liquido, gel, jarabe, purina o suspensión.
18. El uso de un compuesto como se afirma por cualquiera de las reivindicaciones de 1 a 15, o de una composición como se afirma por la reivindicación 16 o 17, en la fabricación de un medicamento para el tratamiento de una enfermedad mediada de la proteína quinasa, donde la enfermedad mediada de la proteína quinasa es el cáncer.
19. Un compuesto como se afirma por cualquiera de las reivindicaciones de 1 a 15, o una composición como se afirma por la reivindicación 16 o 17, para el uso en el tratamiento de la enfermedad mediada de la proteína quinasa, donde la enfermedad mediada de la proteína quinasa es el cáncer.
20. El uso de la reivindicación 18, o el compuesto o composición para el uso de la reivindicación 19, donde el cáncer es cáncer de páncreas, cáncer de mama, cáncer de ovario o de colon.
21. El uso de la reivindicación 18, o el compuesto o composición para el uso de la reivindicación 19, donde el cáncer es seleccionado del cáncer de pulmón, cáncer de pulmón de células no pequeñas, cáncer de células de avena, cáncer de hueso, cáncer de páncreas, cáncer de piel, protuberancias dermatofibrosarcoma, cáncer de la cabeza y del cuello, melanoma cutánea o intraocular, cáncer de útero, cáncer de ovario, cáncer colorrectal, cáncer de la zona anal, cáncer de estomago, cáncer de colon, cáncer de mama, tumores ginecológicos, enfermedad de Hodgkin's, cáncer hepatocelular, cáncer de esófago, cáncer del intestino delgado, cáncer del sistema endocrino, sarcomas de tejidos blandos, cáncer de la uretra, cáncer de pene, cáncer de próstata, leucemia crónica o aguda, tumores sólidos de la infancia, hipereosinofilia, linfomas linfociticas, cáncer de vejiga, cáncer de riñón o uréter, malignidad pediátrica, neoplasias del sistema nervioso central, el esófago de Barret's (síndrome pre-maligno), y enfermedad neoplásica cutánea.
22. La utilización, compuesto o composición para el uso de cualquiera de las reivindicaciones 18 a 21, donde el compuesto es utilizado en combinación con un agente quimioterapeutico adicional.
23. La utilización, compuesto o composición de la reivindicación 22, donde el agente quimioterapeutico adicional es seleccionado del grupo consistente de inhibidores mitóticos, agentes alquilantes, antimetabolitos, inhibidores del ciclo celular, enzimas, inhibidores de la topoisomerasa tales como CAMPTOSAR (irinotecan), modificadores de la respuesta biológica, anti-hormonas, agentes antiangiogenicos tales como inhibidores MMP-2, MMP-9 y COX-2, anti-andrógenos, complejos de coordinación de platino, ureas sustitutas tales como hidroxiurea; derivados metilhidracina, supresores de la corteza suprarrenal, hormonas y antagonistas de las hormonas tales como los adrenocorticosteriodos, progestinas, estrógenos, antiestrógenos tales como tamoxifeno, andrógenos, y inhibidores de la aromatasa, tales como anestrozole, y AROMASIN (exemestano).
24. La utilización, compuesto o composición de la reivindicación 23, donde el complejo de coordinación de platino es cisplatino.
25. Una sal farmacéuticamente aceptable de un compuesto de la reivindicación 1, tal sal es una sal de adición de ácido el cual se obtiene por reacción de la base libre del compuesto de la reivindicación 1 con un ácido inorgánico tal como el ácido hidroclórico, ácido hidrobromico, ácido nítrico, ácido fosforito, ácido sulfúrico, ácido perclórico y similares, o con un ácido orgánico tal como el ácido acético, ácido oxálico, ácido málico-(D)- o (L), ácido maleico, ácido metanosulfonico, ácido etanosulfonico, el ácido p-toluenesulionic, ácido salicílico, ácido tartárico, ácido cítrico, ácido succínico o el ácido masónico.
26. La sal de la reivindicación 25, el cual es una sal de adición el cual se obtiene por reacción de la base libre del compuesto de la reivindicación 1 con ácido hidroclórico.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
N-acil-N''-(piridin-2-il) ureas y análogos que presentan actividades anticancerosas y antiproliferativas, del 24 de Junio de 2020, de Deciphera Pharmaceuticals, LLC: Un compuesto de fórmula I, **(Ver fórmula)** o una sal, un enantiómero, un estereoisómero o un tautómero farmacéuticamente aceptables del mismo, en donde […]
Derivados de lactama, urea cíclica y carbamato y de triazolona como inhibidores potentes y selectivos de ROCK, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Fórmula (I): **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable del mismo, en donde: […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Nuevos derivados de dihidroisoquinolin-1-ona bicíclicos, del 17 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto seleccionado de 6-cloro-2-piridin-3-il-3,4-dihidro-2H-isoquinolin-1-ona; 5-(6-cloro-1-oxo-3,4-dihidro-1H-isoquinolin-2-il)-nicotinonitrilo; […]