DERIVADOS DE METOTREXATO DE UNION A PROTEINAS Y MEDICAMENTOS QUE LOS CONTIENEN.
Derivado de metotrexato con la fórmula I:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/006618.
Solicitante: MEDAC GESELLSCHAFT FUR KLINISCHE SPEZIALPRAPARATE MBH.
Nacionalidad solicitante: Alemania.
Dirección: THEATERSTRASSE 6,22880 WEDEL.
Inventor/es: KRATZ, FELIX, WARNECKE,ANDRE.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K47/48R4
- C07K5/10A1A
- C07K7/06A
Clasificación PCT:
- A61K47/48
- C07K5/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 5/00 Péptidos con hasta cuatro aminoácidos en una secuencia totalmente determinada; Sus derivados. › Tretapéptidos.
- C07K7/06 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
Fragmento de la descripción:
Derivados de metotrexato de unión a proteínas y medicamentos que los contienen.
La presente invención se refiere a derivados de metotrexato y a derivados peptídicos de metotrexato, que contienen un grupo que se une a una proteína y que se pueden escindir enzimáticamente en el cuerpo con la liberación de la sustancia activa o de un derivado de la sustancia activa de bajo peso molecular, a un procedimiento para la preparación de derivados de metotrexato, a su uso y a medicamentos que contienen derivados de metotrexato.
El metotrexato (MTX) es un antagonista del ácido fólico, empleado en el tratamiento del cáncer y de la artritis reumatoide. Su uso está limitado por una serie de efectos secundarios (por ejemplo, mareos, alopecia, estomatitis, síntomas gastrointestinales, aumento de la susceptibilidad a la infección). Para mejorar el perfil de los efectos secundarios y la eficacia del MTX o de los derivados de MTX, se han preparado formas de transporte macromoleculares de MTX mediante el acoplamiento de la sustancia activa con polímeros sintéticos, tales como polietilenglicol (Riebeseel, K.; Biederman, E.; Löser, R.; Breiter, N.; Hanselmann, R.; y col. Bioconjugate Chem. 2002. 13, 773-785), copolímeros de HPMA (Subr, V.; Strohaim, J. y col., Controlled Release 1997, 49, 123-132) o seroalbúmina humana (SAH) unida eventualmente a espaciadores peptídicos determinados (Wunder, A.; Muller-Ladner y col., J. Immunol. 2003, 170, 4793-4801; Wunder, A.; Stehle, G. y col., Int. J. Oncol. 1997, 11, 497-507; i Fitzpatrick, J. y col., Anti-Cancer Drug Design 1995, 10, 1-9). Sin embargo, sigue habiendo una necesidad de nuevos sistemas que contengan MTX o derivados de MTX, con un bajo perfil de efectos secundarios y una eficacia mejorada sustancialmente, en comparación con el MTX libre.
Por tanto, la invención se basa en la misión de preparar profármacos de metotrexato, que liberan el metotrexato o los derivados metotrexato en el tejido tumoral o en el tejido reumático.
Esta misión se logra con las realizaciones caracterizadas en las reivindicaciones.
En particular, se proporcionan derivados de metotrexato de fórmula general

en donde R1 = H o CH3, R2 = H o COOH, P1-P3 = L-aminoácidos o D-aminoácidos, Xaa es un aminoácido mediador en la solubilidad, m = 0 hasta 6, n = 0 hasta 5, o = 0 hasta 2, p = 1 hasta 10 y PM es un grupo que se une a proteína.
De acuerdo con la presente invención, un punto de ruptura predeterminado e integrado que es escindible hidrolítica o enigmáticamente, permite liberar de forma controlada la sustancia activa o un derivado del espaciador-sustancia activa, in vivo, de modo que los derivados de metotrexato de la presente invención constituyen profármacos.
Los derivados de MTX de acuerdo con la invención, están compuestos por un componente de metotrexato anti-tumoral o anti-reumático, una molécula espaciadora, una cadena peptídica y un reticulador heterobifuncional. Esta estructura se explica a continuación con más detalle:
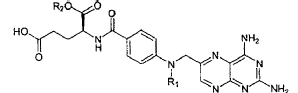
El componente de MTX con eficacia anti-tumoral de acuerdo con la presente invención, es una sustancia activa con la fórmula general
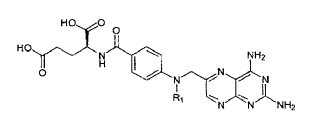
en donde R1 = CH3 o H.
La sustancia activa preferida es metotrexato.
La molécula espaciadora de acuerdo con la presente invención, es una diamina con la fórmula general

en donde
R2 = H o COOH
p = 1 hasta 10.
Los espaciadores preferidos son etilendiamina (R2 = H, p = 1) y espaciadores en los que p = 4 ó 5. Un espaciador particularmente preferido es la L-lisina (R2 = COOH, p = 4).
En la presente invención, el péptido está compuesto por una secuencia escindible enzimáticamente, así como por un componente mediador en la solubilidad N-terminal, y tiene la fórmula general
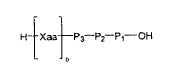
en donde
P1-P3 = L-aminoácidos o D-aminoácidos
Xaa = un aminoácido con una cadena lateral básica
o = 0-2.
En la presente invención, el aminoácido P1 se selecciona entre los aminoácidos lisina, metionina, alanina, prolina y glicina. El aminoácido P2 se selecciona entre los aminoácidos leucina, fenilalanina, metionina, alanina, prolina y tirosina. El aminoácido P3 se selecciona entre los aminoácidos D-alanina, alanina, D-valina, valina, leucina y fenilalanina. Los aminoácidos preferidos en la posición P1 son lisina, alanina y metionina. Los aminoácidos preferidos en la posición P2 son fenilalanina, metionina, alanina y tirosina. Los aminoácidos preferidos en la posición P3 son D-alanina, alanina, D-valina, valina y fenilalanina.
Las secuencias peptídicas particularmente preferidas se muestran en la tabla siguiente
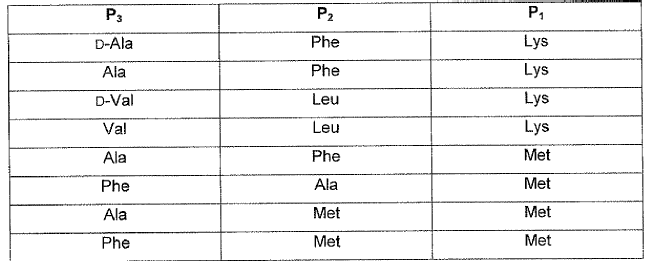
De acuerdo con la presente invención, el grupo Xaa mediador en la solubilidad, se selecciona preferiblemente entre los aminoácidos arginina, lisina e histidina. Un grupo particularmente preferido es la arginina.
En la presente invención, el reticulador heterobifuncional es un ácido carboxílico que tiene un grupo que se une a proteínas, con la fórmula general
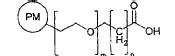
en donde
m = 0 hasta 6
n = 0 hasta 5
PM = grupo que se une a proteínas.
El grupo que se une a proteínas (PM) se selecciona preferentemente entre un grupo 2-ditiopiridilo, un grupo haloacetamida, un grupo haloacetato, un grupo disulfuro, un grupo éster de ácido acrílico, un grupo éster de ácido monoalquil-maleico, un grupo amida de ácido monoalquil-maleámico, un grupo éster de N-hidroxi-succinimidilo, un grupo isotiocianato, un grupo aziridina o un grupo maleinimida. Un grupo que se une a proteína particularmente preferido, es el grupo maleinimida.
Los reticuladores preferidos se caracterizan por m = 3 y n = 1, así como por m = 0 y n = 4.
De acuerdo con la presente invención, la sustancia activa y la molécula espaciadora están unidas por un enlace amida entre el grupo ?-carboxilo de la sustancia activa y el primer grupo amino de la molécula espaciadora. La unión entre la molécula espaciadora y la unidad reticulador-péptido consiste en un enlace amida entre el segundo grupo amino de la molécula espaciadora y el grupo carboxilo C-terminal de la unidad reticulador-péptido. La unión entre el reticulador y la cadena peptídica consiste en un enlace amida entre el extremo N-terminal de la cadena peptídica y el grupo carboxilo del reticulador.
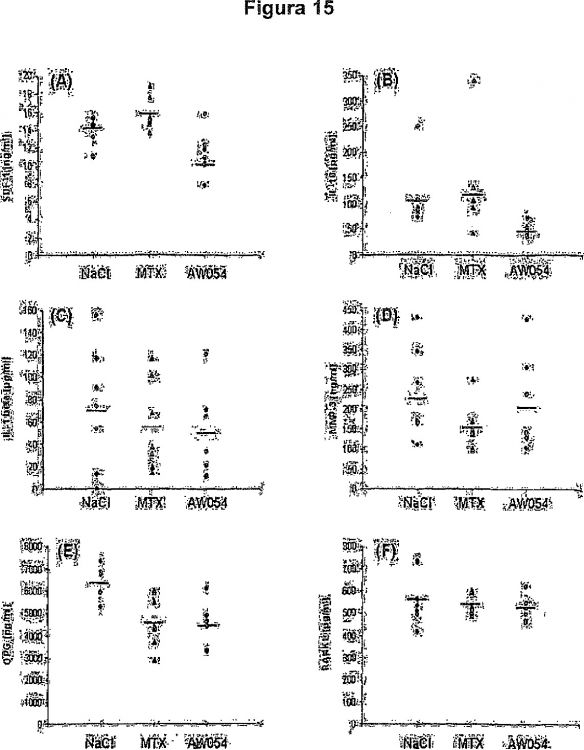
Una propiedad esencial de los derivados de MTX de acuerdo con la invención, es que el enlace entre la molécula espaciadora y el reticulador se puede escindir enzimáticamente, permitiéndose de este modo una liberación controlada de la sustancia activa o de un derivado del espaciador-sustancia activa en el tejido tumoral o en el tejido reumatoide. Proteasas tales como, p. ej., la plasmina o la catepsina se hiperexpresan en muchos tumores humanos y en tejidos reumatoides, representando por tanto un punto ideal para aplicar una activación enzimática dirigida al blanco de los profármacos (Yan, S. y col., Biol. Chem. 1998, 2, 113-123; Leto, G. y col., Clin. Exp. Metastasis 2004, 91-106; Sloane, B. F., Yan, S. y col., Seminars in Cancer Biology, 2005, 15, 149-157, Dano, K., Behrendt, N. y col., Thrombosis and Haemostasis 2005, 93, 676-681; Hashimoto, Y., Kakegawa, H. y col., Biochem. Biophys. Res. Commun. 2001, 283, 334-339;...
Reivindicaciones:
1. Derivado de metotrexato con la fórmula I:
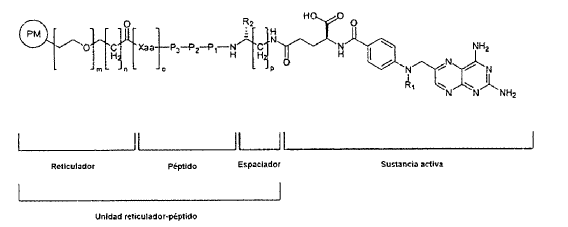
en donde
R1 = H o CH3
R2 = H o COOH
P1 = lisina, metionina, alanina, prolina o glicina
P2 = leucina, fenilalanina, metionina, alanina, prolina o tirosina
P3 = D-alanina, alanina, D-valina, valina, leucina o fenilalanina
Xaa = aminoácido con cadena lateral básica
m = 0 hasta 6
n = 0 hasta 5
o = 0 hasta 2
p = 1 hasta 10
PM es un grupo que se une a proteína.
2. Derivado de metotrexato de acuerdo con la reivindicación 1, en el que PM se selecciona entre el grupo consistente en un grupo maleinimida, un grupo 2-ditiopiridilo, un grupo haloacetamida, un grupo haloacetato, un grupo disulfuro, un grupo éster de ácido acrílico, un grupo éster de ácido monoalquil-maleico, un grupo amida de ácido monoalquil-maleámico, un grupo éster de N-hidroxi-succinimidilo, un grupo isotiocianato y un grupo aziridina, que pueden estar opcionalmente sustituidos.
3. Derivado de metotrexato de acuerdo con la reivindicación 2, en el que PM es un grupo maleinimida que puede estar opcionalmente sustituido.
4. Derivado de metotrexato de acuerdo con la reivindicación 3, en donde m = 0 y n = 4.
5. Derivado de metotrexato de acuerdo con la reivindicación 3, en donde m = 3 y n = 1.
6. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde R1 = CH3.
7. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde R2 = COOH y p = 4.
8. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde P1 = lisina, alanina o metionina.
9. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde P2 = fenilalanina, metionina, alanina o tirosina.
10. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde P3 = D-alanina, alanina, D-valina, valina o fenilalanina.
11. Derivado de metotrexato de acuerdo con una de las reivindicaciones 8 a 10, en donde P1 = lisina, P2 = leucina o fenilalanina y P3 = alanina, D-alanina, valina o D-valina.
12. Derivado de metotrexato de acuerdo con la reivindicación 11, en donde P2 = leucina y P3 = D-valina.
13. Derivado de metotrexato de acuerdo con la reivindicación 11, en donde P2 = leucina y P3 = valina.
14. Derivado de metotrexato de acuerdo con la reivindicación 11, en donde P2 = fenilalanina y P3 = D-alanina.
15. Derivado de metotrexato de acuerdo con la reivindicación 11, P2 = fenilalanina y P3 = alanina.
16. Derivado de metotrexato de acuerdo con una de las reivindicaciones 8 a 10, en donde P1 = metionina, P2 = metionina, alanina o fenilalanina y P3 = alanina, D-alanina o fenilalanina.
17. Derivado de metotrexato de acuerdo con la reivindicación 16, en donde P2 = alanina y P3 = fenilalanina.
18. Derivado de metotrexato de acuerdo con la reivindicación 16, en donde P2 = fenilalanina y P3 = alanina.
19. Derivado de metotrexato de acuerdo con la reivindicación 16, en donde P2 = metionina y P3 = alanina.
20. Derivado de metotrexato de acuerdo con la reivindicación 16, en donde P2 = metionina y P3 = fenilalanina.
21. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde o = 0.
22. Derivado de metotrexato de acuerdo con una de las reivindicaciones anteriores, en donde Xaa = arginina, lisina o histidina.
23. Derivado de metotrexato de acuerdo con la reivindicación 22, en donde Xaa = arginina y o = 2.
24. Procedimiento para la preparación de derivados de metotrexato según una de las reivindicaciones anteriores, en donde un derivado de metotrexato que tiene la fórmula general II
en donde
R1 = CH3, H o COCF3
R2 = C(CH3)3, un grupo bencilo sustituido con alcoxi o un grupo trialquil-sililo
reacciona con una unidad de reticulador-péptido de fórmula general III
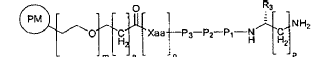
en donde
R3 = H, COOH COOtBu
P1 = lisina, metionina, alanina, prolina o glicina
P2 = leucina, fenilalanina, metionina, alanina, prolina o tirosina
P3 = D-alanina, alanina, D-valina, valina, leucina o fenilalanina
Xaa = aminoácidos con cadenas laterales básicas
m = 0 hasta 6
n = 0 hasta 5
o = 0 hasta 2
p = 1 hasta 10
PM es un grupo que se une a proteína
en donde grupos nucleófilos están presentes en P1, P2 y Xaa eventualmente en forma protegida con grupos protectores adecuados, en presencia de un reactivo para la activación del ácido carboxílico y con la adición de catalizadores/bases auxiliares, y en una segunda etapa se trata con un ácido, eventualmente con adición de reactivos para la captura de cationes.
25. Procedimiento según la reivindicación 24, en donde el reactivo para la activación del ácido carboxílico se selecciona entre el grupo consistente en N,N'-diisopropil-carbodiimida, N,N'-diciclohexilcarbodiimida, hexafluorofosfato de (benzotriazol-1-iloxi)tris(dimetilamino)fosfonio, yoduro de 2-cloro-1-metilpiridinio y hexafluorofosfato de O-(azabenzotriazol-1-il)-N,N,N',N'-tetrametiluronio.
26. Procedimiento según la reivindicación 24, en donde el catalizador/base auxiliar se selecciona entre el grupo consistente en trialquilaminas, piridina, 4-dimetilaminopiridina (DMAP) e hidroxibenzotriazol (HOBt) o una combinación de los mismos.
27. Procedimiento según una de las reivindicaciones 24 a 26, en donde se emplea hexafluorofosfato de O-(azaben-zotriazol-1-il)-N,N,N',N'-tetrametiluronio junto con N-etildiisopropilamina, como reactivo para la activación del ácido carboxílico.
28. Procedimiento según la reivindicación 24, en donde cloruro de hidrógeno se emplea como ácido en la segunda etapa.
29. Procedimiento según la reivindicación 24, en donde se emplea ácido trifluoroacético como ácido en la segunda etapa.
30. Procedimiento según la reivindicación 24, en donde en la segunda etapa, el reactivo para la captura de cationes se selecciona entre el grupo consistente en agua, fenol, tioanisol, diisopropilsilano y 1,2-etano-ditiol, o una combinación de los mismos.
31. Procedimiento según la reivindicación 24, en donde el éster de metotrexato-?-terc.-butílico reacciona con trifluoroacetato de ((((6-maleinimidohexanoil)D-alanil)fenilalanil)terc.-butoxilcarbonilsilil)lisina empleando hexafluorofosfato de O-(azabenzotriazol-1-il)-N,N,N',N'-tetrametiluronio junto con N-etildiisopropilamina y se trata con ácido trifluoroacético en una segunda etapa.
32. Medicamento que comprende un derivado de metotrexato según una de las reivindicaciones 1 a 23, opcionalmente junto con uno o varios agentes auxiliares farmacéuticamente aceptables.
33. Medicamento según la reivindicación 32, para el tratamiento de enfermedades cancerosas.
34. Medicamento según la reivindicación 32, para el tratamiento de enfermedades reumáticas.
Patentes similares o relacionadas:
OLIGOPÉPTIDOS NO PROTEOLIZABLES INHIBIDORES DE LA GLICOPROTEINA GP41 DEL VIH, del 21 de Octubre de 2011, de UNIVERSIDAD DEL PAIS VASCO UNIVERSIDAD DE VALENCIA: Oligopéptidos no proteolizables inhibidores de la glicoproteína 41 del virus del SIDA. La presente invención se refiere a la identificación de oligopéptidos, […]
PÉPTIDOS ESPECÍFICOS PARA LAS METÁSTASIS Y SUS APLICACIONES EN DIAGNÓSTICO Y TERAPÉUTICAS, del 19 de Julio de 2011, de UNIVERSITA' DEGLI STUDI DI TORINO: Un péptido capaz de fijarse selectivamente a células metastásicas, preferiblemente células de metástasis hepáticas humanas, que tiene el motivo de secuencia LRS, una longitud […]
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
COMPOSICIÓN COSMÉTICA O FARMACÉUTICA QUE CONTIENE PÉPTIDOS CON LA SECUENCIA ARG-GLY-SER, del 3 de Junio de 2011, de SOCIETE D'EXTRACTION DES PRINCIPES ACTIFS ( VINCIENCE SA): Composición cosmética y/o dermatológica y/o farmacéutica caracterizada porque contiene en un medio aceptable, como principio activo, por lo menos un péptido de fórmula […]
LIGACIÓN QUÍMICA "SEUDO"- NATURAL, del 1 de Junio de 2011, de AMYLIN PHARMACEUTICALS, INC.: Procedimiento para sintetizar un polipéptido deseado de fórmula: aaNH2-Q-aax-aay-W-aaCOOH en la que Q y W indican cada uno la presencia opcional de uno o más restos […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]
POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]