ANTICUERPOS ANTI-VEGF-2.
Un anticuerpo que de manera inmunoespecífica se enlaza con un polipéptido VEGF-2,
consistiendo dicho anticuerpo en una secuencia de aminoácido que es al menos 95% idéntica a una secuencia de aminoácido seleccionada del grupo consistente en: (a) la secuencia de aminoácido del dominio VH de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79; y (b) la secuencia de aminoácido del dominio VH del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4095
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/011474.
Solicitante: HUMAN GENOME SCIENCES, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 14200 SHADY GROVE ROAD ROCKVILLE, MD 20850 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ROSEN, CRAIG A., RUBEN, STEVEN, M., WAGER,RUTH,E, ALBERT,VIVIAN,R.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Abril de 2002.
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación PCT:
- C07K16/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
Clasificación antigua:
- C07H21/04 C07 […] › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
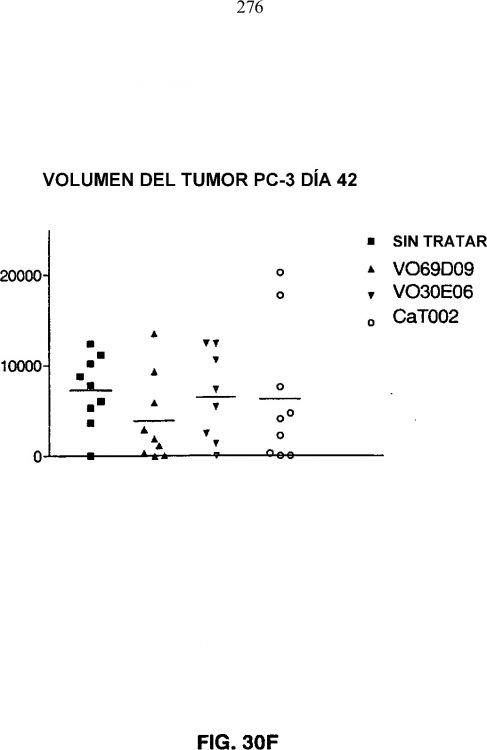
Fragmento de la descripción:
Contexto de la Invención
La presente descripción hace referencia a polinucleótidos recién identificados, polipéptidos codificados por dichos polinucleótidos, anticuerpos específicos para tales polipéptidos, el uso de estos anticuerpos, así como la producción de estos anticuerpos. Los polipéptidos de la presente descripción han sido identificados como miembros de la familia del factor de crecimiento endotelial vascular. Más en particular, los polipéptidos de la presente descripción son del factor 2 de crecimiento endotelial vascular humano (VEGF-2). Los anticuerpos de la invención son específicos para dichos polipéptidos VEGF -2. La invención también hace referencia a la inhibición de la acción de dichos polipéptidos.
La formación de nuevos vasos sanguíneos, o angiogénesis, es esencial para el desarrollo embriónico, el posterior crecimiento y la reparación de tejidos. La angiogénesis es también una parte esencial de ciertas condiciones patológicas, como neoplasia (por ejemplo, tumores y gliomas). La angiogénesis anormal se asocia con otras enfermedades como inflamación, artritis reumatoide, psoriasis, y retinopatía diabética (Folkman, J. y Klagsbrun, M., Science 235:442447 (1987)).
Las moléculas de factor de crecimiento de fibroblasto ácidas y básicas son mitógenos para células endoteliales y otros tipos de células. La angiotropina y angiogenina pueden inducir angiogénesis, a pesar de que sus funciones no están muy claras (Folkman, J., Cancer Medicine, Lea y Febiger Press, pp. 153-170 (1993)). El factor de crecimiento endotelial vascular o VEGF es un mitógeno muy selectivo para células endoteliales vasculares (Ferrara, N. et al., Endocr. Rev. 13:19-32 (1992)), que también se conoce como factor de permeabilidad vascular (FPV).
El factor de crecimiento endotelial vascular es un mitógeno angiogénico segregado cuya especificidad de célula objetivo parece estar restringida a células endoteliales vasculares. El gen VEGF de ratones se ha caracterizado y su patrón de expresión en embriogénesis se ha analizado. Se observó una expresión persistente de VEGF en células epiteliales adyacentes al endotelio fenestrado, es decir, en los plexos coroideos y en los glomérulos renales. Los datos fueron consistentes con el papel de VEGF como regulador multifuncional de crecimiento y diferenciación celular endotelial (Breier, G. et al., Development 114:521-532 (1992)).
VEGF comparte la homología secuencial con los factores de crecimiento derivados de plaquetas humanas, PDGFa y PDGFb (Leung D. W., et al., Science 246:1306-1309, (1989)). La extensión de homología es de aproximadamente 21% y 23%, respectivamente. Ocho residuos de cisteína que contribuyen a la formación del enlace de disulfuro se conservan de manera estricta en estas proteínas. Aunque son similares, hay diferencias específicas entre VEGF y PDGF. Mientras que PDGF es un factor de crecimiento principal para tejido conector, VEGF es muy específico para célula endoteliales. De manera alternativa, se han identificado ARNs ensamblados para VEGF, PLGF y PDGF y estos productos ensambladores difieren en actividad biológica y en especificidad de enlace con el receptor. VEGF y PDGF funcionan como homo-dímeros y hetero-dímero y se enlazan con receptores que provocan actividad intrínseca de tirosina quinasa seguida de dimerización del receptor.
VEGF tiene cuatro formas diferentes de 121, 165, 189 y 206 aminoácidos debido al ensamblaje alternativo. VEGF121 y VEGF165 son solubles y son capaces de producir angiogénesis, mientras que VEGF189 y VEGF-206 están unidos a heparina que contiene proteoglicanos en la superficie celular. La expresión temporal y espacial de VEGF se ha relacionado con la proliferación fisiológica de los vasos sanguíneos (Gajdusek, C.M., y Carbon, S.J., Cell Physiol. 139:570-579 (1989); McNeil, P.L., et al., J. Cell. Biol. 109:811-822 (1989)). Sus puntos de enlace de elevada afinidad se localizan solamente en células endoteliales en secciones del tejido (Jakeman, L.B., et al., Clin. Invest. 89:244-253 (1989)). El factor puede aislarse de células pituitarias y varias líneas celulares tumorales, y ha estado implicado en algunos gliomas humanos (Plate
K.H. Nature 359:845-848, (1992)). De manera interesante, la expresión de VEGF121 y VEGF165 confiere en células de ovarios en hámsteres chinos la habilidad para formar tumores en ratones desnudos (ratón inmunológicamente deficiente utilizado para permitir el crecimiento de células tumorales de otro ratón o de otras especies, como la humana) (Ferrara, N. et al., J. Clin. Invest. 91:160-170 (1993)). La inhibición de la función VEGF por la acción de anticuerpos monoclonales anti-VEGF se mostró para inhibir crecimiento tumoral en ratones inmunodeficientes (Kim, K.J., Nature 362:841-844) (1993)). Además, un mutante dominante negativo del receptor VEGF ha demostrado inhibir el crecimiento de glioblastomas en ratones.
El factor de permeabilidad vascular (VPF) también ha demostrado ser responsable de la hiperpermeabilidad microvascular persistente para proteínas de plasma incluso tras el cese de la lesión, que es una característica de la curación normal de una herida. Esto sugiere que VPF es un factor importante en la curación de heridas. Brown, L. F., et al., J. Exp. Med. 176:1375-1379 (1992).
La expresión de VEGF es alta en tejidos vascularizado, (por ejemplo, pulmón, corazón, placenta y tumores sólidos) y se relaciona con angiogénesis tanto temporalmente como espacialmente. VEGF también ha demostrado provocar angiogénesis in vivo. Debido a que la angiogénesis es esencial para la reparación de tejidos normales, especialmente tejidos vasculares, VEGF ha sido propuesto para uso en la estimulación de reparación de tejidos vasculares (por ejemplo, en ateroesclerosis).
La patente U.S Nº 5,073492, concedida el 17 de diciembre de 1991 de Chen et al., describe un método para mejorar sinergísticamente el crecimiento celular endotelial en un ambiente apropiado que consiste en la adición al ambiente de VEGF, efectores y factor derivado de suero. Así mismo, ADN con sub-unidad de factor C de crecimiento de célula endotelial vascular se ha preparado mediante técnicas de reacción en cadena de polimerasa. El ADN codifica una proteína que existe como heterodímero o homodímero. La proteína es un nitrógeno celular endotelial vascular de mamífero y, como tal, es útil para la estimulación de desarrollo y reparación vascular, tal y como se describe en la Solicitud de Patente Europea Nº 92302750.2, publicada el 30 de septiembre de 1992.
Resumen de la Invención
Los polipéptidos de la presente descripción se han identificado supuestamente como un factor nuevo de crecimiento endotelial vascular basado en la homología de secuencia de aminoácido para VEGF humano.
También se describen polipéptidos maduros nuevos, así como fragmentos biológicamente activos y diagnósticamente o terapéuticamente útiles, análogos y derivados de los mismos. Los polipéptidos de la presente descripción son de origen humano.
También se describen moléculas aisladas de ácido nucleico que están formadas por polinucleótidos que codifican polipéptidos VEGF-2 de longitud completa o truncados que tienen secuencias de aminoácidos mostradas en SEQ ID Nos: 2 o 4, respectivamente, o secuencias de aminoácido codificadas por los clones cADN depositados en huéspedes bacterianos como ATCC Número de Depósito 97149 el 12 de mayo de 19995 o ATCC Número de Depósito 75698 el 4 de marzo de 1994.
La presente descripción también se relaciona con fragmentos biológicamente activos y diagnósticamente o terapéuticamente útiles, análogos y derivados de VEGF-2.
También se describen proceso para producir tales polipéptidos y técnicas recombinantes que consisten en cultivar células huéspedes recombinantes procarióticas y/o eucarióticas, que contienen la secuencia de ácido nucleico codificadora de la presente descripción, bajo condiciones que impulsan la expresión de dichas proteínas y la posterior recuperación de dichas proteínas.
También se describen procesos para utilizar dichos polipéptidos, o polinucleótidos que codifican estos polipéptidos para fines terapéuticos, por ejemplo, para estimular angiogénesis, curación de heridas, crecimiento de hueso o tejido dañado, y para estimular la reparación de tejido vascular. En concreto, se proporcionan procesos para utilizar estos polipéptidos, o polinucleótidos que codifican tales polipéptidos, para el tratamiento de enfermedad arterial periférica, como isquemia crítica...
Reivindicaciones:
1ª. – Un anticuerpo que de manera inmunoespecífica se enlaza con un polipéptido VEGF-2, consistiendo dicho anticuerpo en una secuencia de aminoácido que es al menos 95% idéntica a una secuencia de aminoácido seleccionada del grupo consistente en:
(a) la secuencia de aminoácido del dominio VH de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79; y
(b) la secuencia de aminoácido del dominio VH del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4095.
2ª. – El anticuerpo de la reivindicación 1 que consiste en una secuencia de aminoácido que es 100% idéntica a una secuencia de aminoácido como la definida en la reivindicación 1 (a) o (b).
3ª. – El anticuerpo de la reivindicación 1 ó 2, que además consiste en una secuencia de aminoácido que es al menos 95% idéntica a una secuencia de aminoácido seleccionada del grupo consistente en:
(a) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79;
(b) la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4095;
(c) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:80;
(d) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:81;
(e) la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4179;
(f) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:82;
(g) la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4096;
(h) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:83;
(i) la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4180;
(j) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:72;
(k) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:73;
(l) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:74;
(m) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:75;
(n) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:76;
(o) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:77; y
(p) la secuencia de aminoácido del dominio VL de un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:78.
4ª. – El anticuerpo de la reivindicación 3 que consiste en una secuencia de aminoácido que es 100% idéntica a una secuencia de aminoácido como la definida en cualquiera de las reivindicaciones 3
(a) a (p).
5ª. – El anticuerpo de la reivindicación 3, donde el dominio VH es al menos 95% idéntico a la secuencia de aminoácido del dominio VH del anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79 y el dominio VL es al menos 95% idéntico a la secuencia de aminoácido del dominio VL del anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79.
6ª. – El anticuerpo de la reivindicación 5, donde el dominio VH es 100% idéntico a la secuencia de aminoácido del dominio VH del anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79 y el dominio VL es 100% idéntico a la secuencia de aminoácido del dominio VL del anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79.
7ª. – El anticuerpo de la reivindicación 3, donde el dominio VH es al menos 95% idéntico a la secuencia de aminoácido del dominio VH del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4095 y el dominio VL es al menos 95% idéntico a la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA4095.
8ª. – El anticuerpo de la reivindicación 7, donde el dominio VH es 100% idéntico a la secuencia de aminoácido del dominio VH del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA-4095 y el dominio VL es 100% idéntico a la secuencia de aminoácido del dominio VL del anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCCC PTA4095.
9ª. – El anticuerpo de la reivindicaciones 1 a 8, que además consiste en un dominio constante VH seleccionado del grupo consistente en:
(a)un dominio constante IgM
(b)un dominio constante IgG; y
(c)un dominio constante IgA. 10ª. – El anticuerpo de la reivindicación 9, donde el dominio constante VH es un dominio constante VH humano.
11ª. – El anticuerpo de la reivindicación 10, donde el dominio constante VH humano se selecciona del grupo consistente en un dominio constante IgG1, un dominio constante IgG2, un dominio constante IgG3 y un dominio constante IgG4.
12ª. – El anticuerpo de cualquiera de las reivindicaciones 3 a 8, que además contiene un dominio constante VL seleccionado del grupo consistente en:
(a)un dominio constante kappa; y
(b)un dominio constante lambda.
13ª. – El anticuerpo de la reivindicación 12, donde el dominio constante VL es un dominio constante VL humano.
14ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 13, donde el polipéptido VEGF-2 se selecciona del grupo consistente en:
(a) un polipéptido VEGF-2 que contiene los aminoácidos 1-419 de SEQ ID NO:18;
(b) un polipéptido VEGF-2 que contiene los aminoácidos 32-419 de SEQ ID NO:18;
(c) un polipéptido VEGF-2 que contiene los aminoácidos 103227 de SEQ ID NO:18;
(d) un polipéptido VEGF-2 que contiene los aminoácidos 112227 de SEQ ID NO:18;
(e) un polipéptido dimérico VEGF-2 que consiste en dos polipéptidos consistiendo cada uno de ellos en aminoácidos 103-227 de SEQ ID NO:18;
(f) un polipéptido dimérico VEGF-2 que consiste en dos polipéptidos consistiendo cada uno de ellos en aminoácidos 112-227 de SEQ ID NO:18;
(g) la secuencia de aminoácido de la forma segregada del polipéptido VEGF-2 de SEQ ID NO:18; y
(h) la secuencia de aminoácido de la forma segregada del polipéptido VEGF-2 codificada por el cADN contenido en el Número de Depósito ATCC 97149.
15ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 14, que se enlaza de manera inmunoespecífica con VEGF-2 en un Western blot o en un ELISA.
16ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 15, donde dicho anticuerpo se selecciona del grupo consistente en:
(a) un fragmento Fab;
(b) un fragmento Fab';
(c) un F(ab') 2;
(d) un Fd;
(e) una cadena Fv sencilla;
(f) un Fv enlazado con disulfato;
(g) un anticuerpo monoclonal;
(h) un anticuerpo humano; y
(i) un anticuerpo humanizado.
17ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 16, donde dicho anticuerpo tiene una constante de disociación (KD) de 10-9 M o menos.
18ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 16, donde dicho anticuerpo tiene una constante de disociación seleccionada del grupo consistente en:
(a) una constante de disociación de 10-3/seg o menos; y
(b) una constante de disociación de 10-4/seg o menos. 19ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 17, donde dicho anticuerpo se fusiona con un polipéptido heterólogo. 20ª. – El anticuerpo de la reivindicación 19, donde el polipéptido heterólogo es albúmina de suero humano.
21ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 20, donde dicho anticuerpo se enlaza o conjuga con una etiqueta detectable.
22ª. – El anticuerpo de la reivindicación 21, donde la etiqueta detectable es una etiqueta radioactiva.
23ª. – El anticuerpo de la reivindicación 22, donde la etiqueta radioactiva es 125I, 131I, 111In, 90Y, 99Tc, 177Lu, 166Ho o 153Sm.
24ª. – El anticuerpo de la reivindicación 21, donde la etiqueta detectable es una enzima, una etiqueta fluorescente, una etiqueta luminiscente, o una etiqueta bioluminiscente.
25ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 24, donde el anticuerpo es biotinilado.
26ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 25, donde dicho anticuerpo es un antagonista de VEGF-2.
27ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 26, donde dicho anticuerpo tiene una actividad seleccionada del grupo consistente en:
(a) neutralización de VEGF-2;
(b) inhibición de enlace de VEGF-2 con flk-1;
(c) inhibición de enlace de VEGF-2 con flt-4;
(d) inhibición de fosforilación inducida por VEGF-2 de Elk-1;
(e) inhibición de proliferación inducida por VEGF-2 de células endoteliales vasculares;
(f) inhibición de proliferación inducida por VEGF-2 de células endoteliales linfáticas; e
(g) inhibición de angiogénesis. 28ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 25, donde dicho anticuerpo es un agonista de VEGF-2.
29ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 25, donde dicho anticuerpo tiene una actividad seleccionada del grupo consistente en:
(a) inhibición de crecimiento tumoral; y
(b)inhibición de metástasis tumoral.
30ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 29, donde dicho anticuerpo se conjuga con un agente terapéutico o citotóxico.
31ª. – El anticuerpo de la reivindicación 30, donde el agente terapéutico o citotóxico es un antimetabolito, un agente alquilante, un antibiótico, un factor de crecimiento, una citoquina, un agente anti-angiogénico, un agente anti-mitótico, una antraciclina, una toxina o un agente apoptótico.
32ª. – Un anticuerpo que se enlaza con el mismo epítope en VEGF-2 como un anticuerpo seleccionado del grupo consistente en:
(a) un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79; y
(b) un anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCC PTA-4095.
33ª. – Un anticuerpo que de manera competitiva inhibe el enlace de un anticuerpo seleccionado del grupo consistente en:
(a) un anticuerpo que tiene la secuencia de aminoácido de SEQ ID NO:79; y
(b) un anticuerpo expresado por la línea celular de hibridoma depositada bajo el Número de Depósito ATCC PTA-4095.
34ª. – El anticuerpo de cualquiera de las reivindicaciones 1 a 33, en un portador farmacéuticamente aceptable.
35ª. -Un polinucleótido que codifica el anticuerpo de cualquiera de las reivindicaciones 1 a 20, 26 a 29, 32 y 33.
36ª. – Un vector que comprende el polinucleótido de la reivindicación 35.
37ª. – Una célula huésped que comprende el vector de la reivindicación 36 o el polinucleótido de la reivindicación 35.
38ª. – Una línea celular fabricada para expresar el anticuerpo de cualquiera de las reivindicaciones 1 a 20.
39ª. – La línea celular de la reivindicación 38, donde las células son células NSO o células CHO.
40ª. – Un método para hacer un anticuerpo que consiste en:
(a) expresar el anticuerpo codificado por el polinucleótido de la reivindicación 35; y
(b) recuperar dicho anticuerpo.
41ª. – Un método para detectar la expresión de un polipéptido VEGF-2 que consiste en:
(a) someter a ensayo la expresión de un polipéptido VEGF-2 en una muestra biológica de un individuo usando el anticuerpo de cualquiera de las reivindicaciones 1 a 34; y
(b) comparar el nivel de un polipéptido VEGF-2 con un nivel estándar de un polipéptido VEGF-2.
42ª. – Un método para detectar, diagnosticar, pronosticar, o controlar cánceres y otros trastornos hiperproliferativos que consiste en:
(a)someter a ensayo la expresión de un polipéptido VEGF-2 en una muestra biológica de un individuo usando el anticuerpo de cualquiera de las reivindicaciones 1 a 34; y
(b) comparar el nivel de un polipéptido VEGF-2 con un nivel estándar de un polipéptido VEGF-2. 43ª. – Un kit que contiene el anticuerpo de cualquiera de las reivindicaciones 1 a 34.
44ª. – El kit de la reivindicación 49 que además contiene un anticuerpo de control.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Método para el tratamiento de la osteoporosis, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina que comprende una CDR-H1 de la SEQ ID NO: 245, una CDR-H2 de la SEQ ID NO: 246, una CDR-H3 de la SEQ ID NO: 247, […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
 Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Método para tratar la pérdida de hueso alveolar mediante el uso de anticuerpos antiesclerostina, del 3 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina para su uso en un método para aumentar la altura del hueso alveolar en un sujeto que padece pérdida de hueso alveolar, donde […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]