ANTICUERPOS ANTI-RECEPTOR CCR7 PARA EL TRATAMIENTO DEL CANCER.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/006556.
Solicitante: UNIVERSIDAD AUTONOMA DE MADRID.
Nacionalidad solicitante: España.
Inventor/es: MUUOZ CALLEJA,CECILIA, ALFONSO PEREZ,MANUEL JESUS, LOPEZ GIRAL,SONIA.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07K16/28H
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
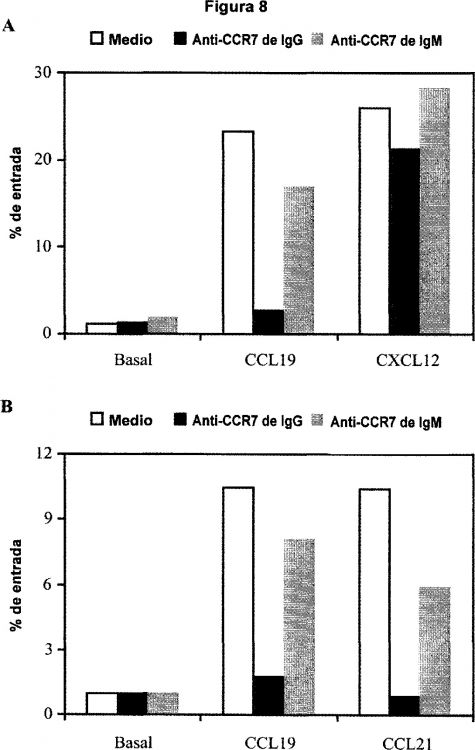
Fragmento de la descripción:
Anticuerpos anti-receptor CCR7 para el tratamiento del cáncer.
Campo de la invención
La presente invención se refiere, en general, al tratamiento del cáncer. Más específicamente, la invención se refiere al tratamiento de cánceres cuyas células tumorales son células que expresan un receptor CCR7 usando anticuerpos contra un receptor CCR7 que son capaces de matar selectivamente, obstaculizar la migración y/o bloquear la diseminación de dichas células tumorales.
Antecedentes de la invención
El cáncer es un grupo de enfermedades caracterizado por una división celular incontrolada (o por un aumento de la supervivencia o la resistencia a la apoptosis) y por la capacidad de dichas células de invadir otros tejidos adyacentes (invasión) y diseminarse a otras zonas del cuerpo en las que normalmente no se ubican las células (metástasis) a través de los vasos linfáticos y sanguíneos, circular por el torrente sanguíneo y después invadir tejidos normales en cualquier otra parte del cuerpo. Dependiendo de si pueden diseminarse o no mediante invasión y metástasis, los tumores se clasifican en benignos o malignos: los tumores benignos son tumores que no pueden diseminarse mediante invasión o metástasis, es decir, sólo crecen localmente; mientras que los tumores malignos son tumores que son capaces de diseminarse mediante invasión y metástasis.
Existen diversos tipos de cánceres que pueden clasificarse según el tipo de célula en la que se originan y por la localización de la célula, es decir, carcinomas, que proceden de las células que recubren las superficies corporales externas e internas, por ejemplo, la piel, el tracto digestivo o glándulas; la leucemia, que comienza en los tejidos formadores de sangre tales como la médula ósea, y provoca que se produzcan y entren en el torrente sanguíneo grandes cantidades de células sanguíneas anormales; el linfoma, que es un cáncer que se origina en los nódulos linfáticos y en los tejidos del sistema inmune del cuerpo; el melanoma, que aparece en los melanocitos; el sarcoma, que comienza en el tejido conectivo del hueso o el músculo; y el teratoma, que comienza dentro de las células germinativas.
El cáncer puede tratarse mediante cirugía, quimioterapia, terapia de radiación, inmunoterapia u otros procedimientos. La elección de la terapia depende de la ubicación y el grado del tumor y del estadio de la enfermedad.
Un importante problema a abordar en los regímenes de tratamiento de tumores es el deseo de una "destrucción celular total". Esto significa que los regímenes de tratamiento más eficaces se aproximan a una destrucción celular total de todas las denominadas células malignas "clonogénicas", es decir, células que tienen la capacidad de crecer incontroladamente y dar lugar a la formación de una masa tumoral que podría ser eliminada mediante la terapia.
Otra estrategia en el tratamiento de tumores es el uso de una "inmunotoxina", en la que se usa un anticuerpo contra la célula tumoral para administrar una toxina a las células tumorales. Sin embargo, al igual que las metodologías quimioterapéuticas descritas anteriormente, la terapia con inmunotoxinas también adolece de unos importantes inconvenientes. Por ejemplo, pueden sobrevivir células negativas en antígeno o deficientes en antígeno y repoblar el tumor o dar lugar a metástasis adicionales. Incluso si un cáncer primario se elimina completamente, un tumor maligno a menudo será metastásico. La formación de metástasis de tumores malignos, iniciada a partir de un tumor primario en más o menos ubicaciones remotas del cuerpo, es uno de los efectos más graves del cáncer y para el que actualmente no hay disponible un protocolo de tratamiento satisfactorio. Los procedimientos de tratamiento disponibles actualmente en la terapia del cáncer bien han tenido un éxito limitado para prevenir las metástasis, o bien han dado lugar a efectos secundarios graves e indeseables.
Aunque la administración específica de agentes terapéuticos, tales como agentes anticelulares, toxinas y factores de la coagulación, a la masa tumoral representa un avance significativo en los protocolos de tratamiento del cáncer, todavía hay sitio para terapias adicionales o incluso alternativas. La identificación de dianas adicionales para permitir la destrucción específica del tumor in vivo sería lógicamente beneficiosa para expandir el número de opciones de marcaje de objetivos.
Las nuevas estrategias terapéuticas para el tratamiento del cáncer se mueven ahora hacia el uso de tratamientos específicos, incluyendo anticuerpos monoclonales (AcMc) contra los diferentes antígenos expresados por las células tumorales, de los que se espera que curen la enfermedad.
La selección del antígeno en inmunoterapia debe tener en cuenta bien la especificidad tumoral del antígeno, la densidad antigénica en la superficie de las células tumorales y la modulación del antígeno o bien la internalización del complejo antígeno-anticuerpo, que puede reducir la capacidad para producir la muerte celular. En la mayoría de los casos se cree que la lisis celular dependiente del complemento (LCDC) y la citotoxicidad celular dependiente de anticuerpo (CCDA) son responsables de la utilidad clínica de los AcMc no conjugados, aunque la inducción de apoptosis o la detención del ciclo celular también podrían jugar un papel sustancial en otros casos.
Las células cancerosas pueden expresar ciertos receptores moleculares. Diferentes estudios muestran que el receptor 7 de quimioquinas CC (CCR7) es expresado en diferentes células tumorales, por ejemplo, leucemia linfocítica crónica de las células B, linfomas no Hodgkinianos, células de cáncer de mama, tumores malignos de mama, etc. Además, parece que el receptor CCR7 desempeña un papel en la metástasis a los nódulos linfáticos de diferentes cánceres, por ejemplo, carcinoma gástrico, melanoma, cánceres de pulmón no microcíticos, células de leucemia de células T, etc. Por lo tanto, dicho receptor de quimioquinas (CCR7) puede ser elegido como una posible diana para la terapia con AcMc en el cáncer.
El CCR7 es un receptor acoplado a proteínas G con siete dominios transmembranales (GPCR). La familia de los receptores acoplados a proteínas G (GPCRs) incluye receptores para hormonas, neurotransmisores, factores de crecimiento y virus [Yoshie O, Imai T, Nomiyama H. Novel lymphocyte-specific CC chemokines and their receptors. J Leukoc Biol. 1997; 62: 634-644; Kim CH, Pelus LM, White JR, Applebaum E, Johanson K, Broxmeyer HE. CK beta-11/macrophage inflammatory protein-3 beta/EBI1-ligand chemokine is an efficacious chemoattractant for T and B cells. J Immunol. 1998; 160: 2418-2424; Dieu MC, Vanbervliet B, Vicari A, y col. Selective recruitment of immature and mature dendritic cells by distinct chemokines expressed in different anatomic sites. J Exp Med. 1998; 188: 373-386; Willimann K, Legler DF, Loetscher M, y col. The chemokine SLC is expressed in T cell areas of lymph nodes and mucosal lymphoid tissues and attracts activated T cells via CCR7. Eur J Immunol. 1998; 28: 2025-2034; Yoshida R, Nagira M, Imai T, y col. EBI1-ligand chemokine (ELC) attracts a broad spectrum of lymphocytes: activated T cells strongly up-regulate CCR7 and efficiently migrate toward ELC. Int Immunol. 1998; 10: 901-910; Sallusto F, Schaerli P, Loetscher P, y col. Rapid and coordinated switch in chemokine receptor expression during dendritic cell maturation. Eur J Immunol. 1998; 28: 2760-2769].
Un caso particular de leucemia en el que las células tumorales expresan un receptor CCR7 es la leucemia linfocítica crónica (LLC), el tipo más común de leucemia en el ser humano adulto. Dicha leucemia es una leucemia de células B caracterizada por la acumulación de un único clon de células B CD5+ con una gran resistencia a experimentar apoptosis debido a una desregulación de los fenómenos de señalización extracelulares o intracelulares implicados en la muerte celular programada. A pesar de su muy bajo índice de proliferación, el recuento linfocítico en sangre periférica alcanza valores mayores de 5 x 103/µL, y las células leucémicas muestran una acusada tendencia a invadir los nódulos linfáticos, el bazo y la médula ósea.
El tratamiento de la LLC se basa en el uso de análogos de la purina, particularmente fludarabina, solos o en asociación, como régimen de primera línea. Hasta la fecha, la única combinación terapéutica que da como resultado una tasa de remisión completa mayor que la obtenida con fludarabina, ha sido el uso de rituximab, un anticuerpo monoclonal anti-CD20, en asociación con...
Reivindicaciones:
1. Uso de un anticuerpo que se une a un receptor CCR7, en la elaboración de una composición farmacéutica para matar células tumorales que expresan un receptor CCR7.
2. Uso según la reivindicación 1, en el que dichas células tumorales son células de leucemia linfocítica crónica (LLC) o células de linfoma de las células del manto (LCM).
3. Uso según cualquiera de las reivindicaciones 1 ó 2, en el que el anticuerpo que se une a un receptor CCR7 se usa en combinación con un compuesto adicional terapéuticamente activo.
4. Un método in vitro para matar células tumorales que expresan un receptor CCR7 que comprende poner en contacto dichas células con un anticuerpo que se une a dicho receptor CCR7.
5. Método según la reivindicación 4, en el que dichas células tumorales son células de leucemia linfocítica crónica (LLC) o células de linfoma de las células del manto (LCM).
6. Un método para identificar un compuesto para matar células tumorales que expresan un receptor CCR7 que comprende
en el que un compuesto que mata dichas células que expresan un receptor CCR7, es un compuesto potencialmente útil para inducir apoptosis de células tumorales.
7. Método según la reivindicación 6, en el que dichas células son células de leucemia linfocítica crónica (LLC) o células de linfoma de las células del manto (LCM).
Patentes similares o relacionadas:
ANTICUERPOS MONOCLONALES FRENTE A EPHA2 Y PROCEDIMIENTOS DE USO DE LOS MISMOS, del 8 de Febrero de 2012, de MEDIMMUNE, LLC: Un anticuerpo aislado que se une específicamente a EphA2 con una Koff inferior a 3 x 10 -3 s -1 e induce fosforilación de la EphA2, en el […]
APLICACIONES TERAPÉUTICAS Y DIAGNÓSTICAS BASADAS EN LA FUNCIÓN DEL GEN CXCR-4 EN LA TUMORIGÉNESIS, del 3 de Febrero de 2012, de NORTHWEST BIOTHERAPEUTICS, INC.: Una composición farmacéutica para el tratamiento de la oncogénesis, que comprende un ácido nucleico antisentido complementario a al menos […]
MÉTODO PARA PURIFICAR ANTICUERPOS, del 3 de Febrero de 2012, de F. HOFFMANN-LA ROCHE AG: Método de purificación de una inmunoglobulina a partir de agregados de inmunoglobulina, que consta de las siguientes etapas: a) preparar una […]
ANTICUERPO BIESPECÍFICO QUE SUSTITUYE AL FACTOR VIII, del 13 de Diciembre de 2011, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Anticuerpo que reconoce un enzima proteolítico y un sustrato del mismo, en el que dicho anticuerpo es un anticuerpo biespecífico que puede actuar como cofactor que aumenta la […]
ANTICUERPOS HUMANIZADOS CONTRA EL RECEPTOR DE INTERFERON ALFA 1 (IFNAR-1), del 21 de Noviembre de 2011, de MEDAREX, INC.: Un anticuerpo humanizado, o fragmento de unión a antígeno del mismo, que se une específicamente al receptor de IFN alfa 1, que comprende: una región variable […]
USOS DE LA CITOQUINA IL-23 DE MAMÍFERO; REACTIVOS RELACIONADOS, del 2 de Noviembre de 2011, de SCHERING CORPORATION: El uso de un agonista de la IL-23 en la preparación de un medicamento para tratar una herida o para mejorar la cicatrización de heridas, en el que el agonista comprende: […]
CÉLULAS CON DEPRESIÓN O DELECIÓN DE LA ACTIVIDAD DE LA PROTEÍNA QUE PARTICIPA EN EL TRANSPORTE DE GDP-FUCOSA, del 5 de Julio de 2011, de KYOWA HAKKO KIRIN CO., LTD.: Una célula en la cual la actividad de un transportador de GDP-fucosa está suprimida o más disminuida que en su célula parental, donde la célula se selecciona entre los […]
COMPOSICIONES FARMACÉUTICAS DE ANTICUERPOS PARA ENFERMEDADES CAUSADAS POR VIRUS, del 3 de Junio de 2011, de THERANOR SPRL: Una composición farmacéutica para usar en el tratamiento de una enfermedad causada por virus de la gripe en seres humanos, conteniendo dicha composición una […]